miR-34a-5p靶向GMFB抑制细胞增殖对先天性巨结肠的治疗意义
张亚飞 余辉 郑百俊 谢崇 葛鑫 李鹏 高亚 潘伟康
先天性巨结肠症(hirschsprung disease,HSCR)是由神经嵴细胞发育受损导致的常见消化疾病,肠神经节细胞缺乏为其主要特征[1]。HSCR是由多种因素引起的复杂疾病,包括调节胚胎期的肠神经嵴细胞增殖分化的遗传和环境因子[2]。这种发育障碍表现为新生儿和儿童的功能性肠梗阻。 HSCR的发病率约为1/5 000,新生儿的男性和女性的比例为4 : 1[3-4]。目前尚无理想的根治手段,因此深入研究HSCR的发病机制为提高HSCR的疗效具有重要意义。
miRNA为19 ~ 25个核苷酸大小的内源性小非编码RNA,在多种细胞过程中起重要作用,如细胞增殖、分化和迁移[5-6]。miRNA的失调已被证实与HSCR相关,如miR-939、miR-181通过抑制细胞增殖参与HSCR的发生发展[7]。国内外大量研究表明,miR-34a-5p与肿瘤的增殖和迁移密切相关,但其在HSCR病理过程中的作用未见报道[8]。本研究探讨miR-34a-5p对HSCR中神经嵴细胞增殖的影响及其作用机制。
材料与方法
一、材料
(一)实验材料
人神经嵴细胞SH-SY5Y(购于美国菌种保藏中心-ATCC)。选择2015年8月至2017年2月在陕西省核工业二一五医院经病理确诊并实施手术切除的HSCR患者结肠组织10例,从未患HSCR或其他先天性异常的患者中取正常结肠组织10例,每例标本均经过病理科医师严格鉴定。所有组织样本取下后迅速置于液氮冻存。本实验方案通过伦理委员会审批,并取得患者知情同意。
(二)试剂
胎牛血清(美国HyClone公司),DMEM细胞培养基 (美国Gibico公司),胰酶、Lipofectamine 2000(美 国 Thermo fisher公 司),miR- 34a-5p mimics及其对照物miR-NC (广州锐博生物科技有限公司),CCK8 (美国Sigma公司),GMFB Rabbit mAb (美国Santa公司),GAPDH Rabbit mAb (美国CST公司)。
二、实验方法
(一)细胞培养与细胞转染
人神经嵴细胞系SH-SY5Y用含有10%胎牛血清的DMEM培养基培养,于37 ℃、5% CO2培养,每2天换1次培养基,细胞汇合至80%以上传代培养。转染前1 d,6孔板接种SH-SY5Y细胞,用不含抗生素的培养基培养。待细胞密度达到70% ~80%的时候,按照Lipofectamine 2000操作说明进行细胞转染,6 h后去除6孔板内培养基,加入含10%胎牛血清的DMEM培养基。37 ℃、5% CO2正常培养后用于后续检测实验。
(二)CCK8法检测细胞死亡率
取转染后的SH-SY5Y细胞,0.25%胰酶消化离心,接种5×103个细胞于96孔板中,37 ℃、5%CO2培养箱中培养,每组设置6个复孔,培养24 h,每孔加入10 μl CCK8培养液,于细胞培养箱培养2 h后,于酶标仪450 nm下测定吸光值(A450),并绘制CCK8曲线图。
(三)双荧光素酶报告基因分析
通过生物信息学在线预测出miR-34a-5p与GMFB的3'UTR之间存在碱基互补关系。通过点突变构建GMFB 3'UTR突变型载体(3'UTR MUT),分别将miR-34a-5p mimics及其对照物miR-NC与GMFB 3'UTR野生型(WT)和突变型载体(MUT)转染进SH-SY5Y。48 h后收集细胞,按照双荧光素酶报告基因检测试剂盒操作说明,检测细胞中萤火虫荧光素酶和海肾荧光素酶活性。
(四)荧光定量PCR检测miR-34a-5p的表达
取液氮冻存的结肠组织样本,将组织于液氮中充分研磨,加入适量的Trizol试剂,提取结肠组织的总RNA,然后按照miRNA cDNA合成试剂盒说明书将RNA逆转录为cDNA,按照miRNA荧光定量PCR试剂盒说明书进行PCR体系的配制。以U6为内参,检测miR-34a-5p的相对表达量。
(五)Western Blot检测蛋白表达
培养转染后的人神经嵴细胞SH-SY5Y,处理后加入蛋白裂解液收集细胞蛋白样品,定量后取等量蛋白样品进行 SDS-PAGE电泳分离、转膜,5%脱脂奶粉封闭1 h,加入(1 : 500)稀释的抗GMFB抗体(GAPDH为内参),室温孵育1 h。洗涤后加入HRP标记的二抗,室温孵育1 h,洗涤后加入化学发光液显色,成像拍照,软件进行灰度值统计分析。
三、统计学分析方法
实验数据采用SPSS 17.0软件进行分析,结果重复3次,CCK8、双荧光素酶报告基因检测、荧光定量PCR和Western Blot实验数据采用± s表示。两组间的比较采用t检验,多组间的比较采用单因素方差分析,以P< 0.05为差异有统计学意义。
结 果
一、miR-34a-5p在HSCR组织中表达下调
荧光定量PCR结果表明,HSCR结肠组中的miR-34a-5p的相对表达量为0.43±0.10,与正常结肠组1.15±0.18相比差异具有统计学意义(P< 0.01),提示miR-34a-5p可能在 HSCR 的发生发展过程中发挥重要作用(图1)。
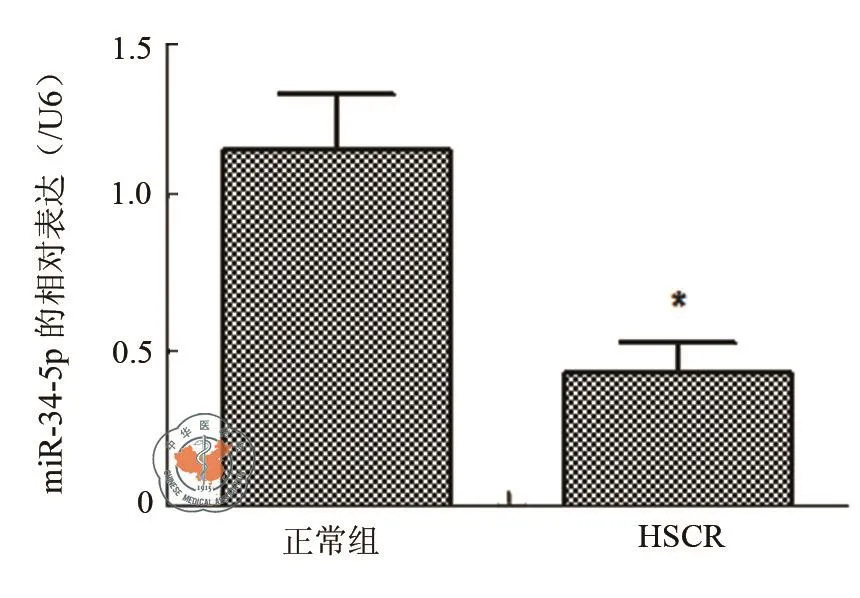
图1 miR-34a-5p在HSCR和正常结肠组织中的表达量
二、miR-34a-5p抑制神经嵴细胞SH-SY5Y细胞活力
CCK8结果所示,miR-34a-5p mimics组细胞在培养24 h和48 h后细胞A450值分别为0.53±0.03和0.87±0.04,分别与miR-NC对照组(0.87±0.03,1.42±0.04)比较差异具有统计学意义(P< 0.01,表1)。这表明miR-34a-5p能抑制神经细胞增殖能力。
三、GMFB是miR-34a-5p的靶基因
生物信息学在线预测出miR-34a-5p与GMFB的3'UTR之间存在碱基互补关系。双荧光素酶报告基因检测结果显示,miR-34a-5p mimics与GMFB 3'UTR WT载体共转染组荧光强度为0.44±0.03,明显低于对照miR-NC与WT载体共转染组1.02±0.06,差异具有统计学意义(P< 0.01)。而miR-34a-5p mimics与GMFB 3'UTR MUT载体共转染组与其对照miR-NC与MUT载体共转染组之间的荧光强度无差异(P> 0.05,图 2,表 2~3)。这表明GMFB是miR-34a-5p下游靶基因之一。
四、GMFB促进神经嵴细胞增殖
CCK8结果所示,miR-34a-5p mimics+GMFB组细胞培养24 h和48 h后,A450值分别为0.99 ±0.02和 1.50 ± 0.03,分别与 miR-34a-5p mimics组(0.53±0.03,0.87±0.04)比较差异具有统计学意义(P< 0.01,表4)。GMFB能促进神经细胞增殖能力,这揭示miR-34a-5p对细胞活力的影响与GMFB的表达有关。
表1 miR-34a-5p mimics组和miR-NC组细胞在不同时间细胞活力(A450)的比较结果(± s)

表1 miR-34a-5p mimics组和miR-NC组细胞在不同时间细胞活力(A450)的比较结果(± s)
注:与miR-NC组比较,aP < 0.01
分组 样本数 12 h 24 h 48 h miR-NC组 3 0.47±0.03 0.87±0.03 1.42±0.04 miR-34a-5p mimics组 3 0.46±0.03 0.53±0.03a 0.87±0.04a t 值 0.45 7.07 9.14 P值 0.68 < 0.01 < 0.01
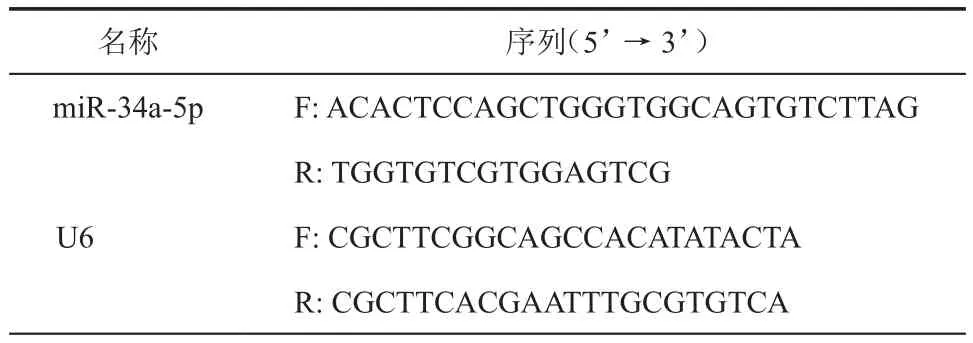
表2 qRT-PCR引物序列
五、miR-34a-5p对神经嵴细胞GMFB蛋白表达的影响
Western Blot检测结果显示,miR-34a-5p mimics组细胞的GMFB蛋白表达量为0.25±0.01,与miR-NC对照组0.90±0.03比较差异具有统计学意 义(P< 0.01)。miR-34a-5p mimics+GMFB 组 细胞GMFB蛋白表达量为1.03±0.03,与miR-34a-5p mimics组(0.25±0.01)比较差异具有统计学意义(P< 0.01,图3)。这表明miR-34a-5p可以调控SHSY5Y细胞GMFB蛋白的表达水平,可能通过调控GMFB蛋白的表达水平影响细胞增殖能力。

图3 miR-34a-5p对人神经嵴细胞GMFB蛋白表达的影响
讨 论
HSCR是以新生儿和儿童的功能性肠梗阻为表现形式的常见消化疾病[9]。HSCR的病因未知,学者普遍认为是胚胎期肠神经嵴细胞分化和发育受损,最终导致肠神经节细胞的缺乏[10~11]。肠神经嵴细胞在胚胎发生过程中经历了长达数周的远端肠道途径,影响肠神经细胞增殖、存活、迁移或分化的因素都可能导致神经节细胞增生,最终导致HSCR。在HSCR的研究中,由于HSCR的肠神经嵴细胞模型的限制,笔者搜索了许多论文并发现了一种合适的细胞系,即SH-SY5Y细胞。大量研究表明,抑制SH-SY5Y的迁移和增殖能够抑制HSCR的发生发展[12]。因此本研究中,神经嵴细胞SH-SY5Y细胞系被用于HSCR患者肠神经细胞的细胞模型。研究影响神经嵴细胞增殖和凋亡的调控因子对于HSCR的治疗具有重要的意义。
表3 miR-34a-5p mimics组和miR-NC组细胞的荧光素酶活性(FIR/REN)的比较结果(± s)

表3 miR-34a-5p mimics组和miR-NC组细胞的荧光素酶活性(FIR/REN)的比较结果(± s)
注:与miR-NC组比较,aP <0.01
分组 样本数 GMFB 3'UTR WT GMFB 3'UTR MUT miR-NC 组 3 1.02±0.06 1.04±0.03 miR-34a-5p mimics组 3 0.44±0.03a 1.08±0.02 t 值 8.56 1.10 P值 < 0.01 0.33
表4 两组细胞在不同时间细胞活力(A450)的比较结果(± s)
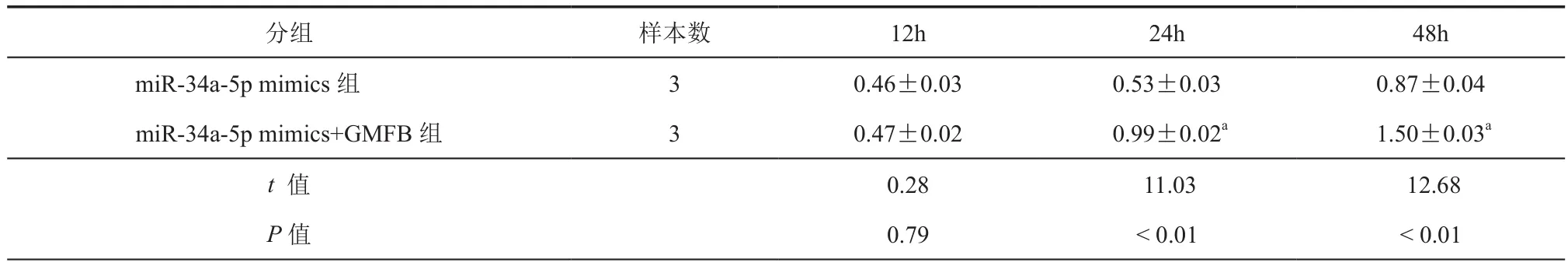
表4 两组细胞在不同时间细胞活力(A450)的比较结果(± s)
注:与 miR-34a-5p mimics组比较,aP <0.01
分组 样本数 12h 24h 48h miR-34a-5p mimics组 3 0.46±0.03 0.53±0.03 0.87±0.04 miR-34a-5p mimics+GMFB 组 3 0.47±0.02 0.99±0.02a 1.50±0.03a t 值 0.28 11.03 12.68 P值 0.79 < 0.01 < 0.01
miRNA具有调控癌基因和抑癌基因的作用,在神经系统疾病、肿瘤等各种疾病的发生发展过程中发挥重要的作用[13~14]。miR-34a-5p是广泛存在哺乳动物中的一类高度保守的miRNA,国内外大量研究表明miR-34a-5p具有抑癌作用,对胃癌和结肠癌等癌症具有抑制作用[15~16]。本研究推测miR- 34a-5p对HSCR也具有影响,基于该推论,通过Q-PCR检测了miR-34a-5p在HSCR组织中的表达水平,结果表明miR-34a-5p在HSCR组织中表达下调,通过双荧光素酶报告基因检测了miR-34a-5p的靶基因,并通过CCK8实验检测了miR-34a-5p及其靶基因对神经嵴细胞增殖的影响,结果显示miR-34a-5p能够抑制神经嵴细胞增殖,这与国内外其他的研究结果一致,即miR-34a-5p作为抑癌调控因子抑制细胞的增殖和迁移。
神经胶质成熟因子(glia maturation factor,GMF)作为一种生长和分化因子于1972年首次在牛脑中分离出来[17]。该蛋白质实际上是两种化合物的混合物:神经胶质成熟因子-β (GMFB)和GMF-γ。GMFB是一种高度进化的保守蛋白质,主要在中枢神经系统中表达,而其表达也在包括结肠、胸腺和肾脏的各种其他组织中检测到[18]。有研究表明,GMFB是创伤性脑损伤后反应性胶质增生所必需的[19]。而且有研究表明,GMFB能够促进免疫T细胞和神经细胞增殖和分化[19~20]。本研究通过双荧光素酶报告基因实验证实了miR-34a-5p能够与GMFB 3'UTR结合,影响GMFB的启动子活性,而免疫印迹结果也证实了miR-34a-5p mimics能够抑制GMFB的蛋白表达,进一步证实了GMFB是miR-34a-5p的下游靶基因。CCK8检测显示,GMFB过表达能够抑制miR-34a-5p mimics诱导的细胞活力的降低,证实了miR-34a-5p对神经嵴细胞增殖调控是通过影响靶基因GMFB的蛋白表达水平来实现的。国内外研究表明,GMFB与人胶质瘤新生血管形成和预后不良有关,抑制GMFB能够抑制胶质瘤细胞的增殖[21]。本研究结果与国内外的其他研究结果一致,即抑制GMFB的蛋白的表达能够抑制细胞的增殖和分化。
综上所述,本研究证实了GMFB是miR-34a-5p下游重要靶基因之一,miR-34a-5p能抑制人神经嵴细胞增殖,并且抑制GMFB蛋白表达。miR-34a-5p调控神经嵴细胞增殖可能与其靶向抑制GMFB的表达有关,其作用机制还需要进一步研究。本研究结果有助于了解miR-34a-5p和GMFB在HSCR中的作用,为HSCR的治疗提供理论依据和实验基础。

