鸡白痢沙门菌cpxR基因缺失株的构建及体外应激试验
吴同垒,于秀剑,黄翠琴,张志强,李佩国*,朱国强
(1.扬州大学,江苏 扬州 225009;2.河北科技师范学院,河北 秦皇岛 066004;3.福建省家畜传染病防治与生物技术重点试验室,福建龙岩 364000)
鸡白痢是由沙门菌中的鸡白痢沙门菌(S.pullorum)引起的一种全身性疾病,能够引起雏鸡的大规模死亡,成年鸡感染后症状不明显,有时仅表现为体重和产蛋率下降[1]。鸡白痢能够水平传播,也能垂直传播给雏鸡,这是其难以净化的关键所在,在我国该病依然是严重危害养禽业的传染病之一[2-3]。
鸡白痢沙门菌主要以粪-口途径传播,细菌经过口腔、胃、最后吸附于小肠上皮,在小肠上皮细胞内定植,并逐渐扩散至肝脏、卵巢等器官,引起严重的炎症反应,造成雏鸡大量死亡和成鸡的生产性能下降[4]。细菌要完成这一感染过程,必须能够抵御胃肠道和细胞内的不良环境应激。CpxR/A系统是多数革兰氏阴性菌重要的双组分调控系统,它由一个跨内膜的组氨酸蛋白激酶CpxA和位于细胞质的响应调控蛋白CpxR组成[5]。有研究表明,CpxR/A系统在细菌适应环境应激过程中意义重大。本研究对白痢沙门菌CpxR进行外源表达,并制备其抗血清,利用λ-Red同源重组技术对cpxR进行了基因敲除,并进行体外应激试验和庆大霉素保护试验,以阐明鸡白痢沙门菌双组份系统CpxR/A的作用。
1 材料与方法
1.1 细胞、实验动物及主要试剂鼠源巨噬细胞Raw264.7由吉林农业大学单晓枫教授惠赠;6周龄~8周龄SPF级BALB/c雌鼠,购自北京金牧阳实验动物养殖有限责任公司(北京)。TaqDNA聚合酶、dNTP、DNA Marker均购自宝生物工程(大连)有限公司;T4连接酶、限制性内切酶和蛋白质Marker均购自 Fermentas公司;L-阿拉伯糖购自Sigma公司;细菌基因组提取试剂盒购自康为试剂生物技术有限公司;ATB自动鉴定系统及ID32E生化鉴定试纸条购自Biomerieux公司;CpxR鼠源多克隆抗体(CpxR-PcAb)由河北科技师范学院动物科技学院动物传染病研究室保存;羊抗鼠HRP-IgG购自康为世纪生物技术有限公司。
1.2 菌株和质粒鸡白痢沙门菌标准菌株ATCC19945由吉林商检王伟利研究员惠赠;质粒pKD3、pKD46、pCP20、pBBR322由扬州大学朱国强教授惠赠。
1.3 λ-Red同源重组引物的设计根据NCBI登录的鸡白痢沙门菌基因组序列(CP012347.1),利用Primer Premier 5设计引物。
引物P1和P2由两部分组成,5'端(有下划线部分)与cpxR基因序列同源,3'端与质粒 pKD3氯霉素抗性基因同源,该对引物用于扩增cat基因。引物 P3、P4用于扩增cpxR基因开放阅读框(ORF),构建cpxR基因回补菌株。引物P5、P6位于cpxR基因ORF外侧,用于cpxR基因缺失菌株的鉴定。引物由上海生工生物工程技术服务有限公司合成(表1)。

表1 引物信息Table 1 Primers designed for target genes
1.4 鸡白痢沙门菌cpxR基因缺失株及回补菌株的构建以质粒pKD4为模板,使用引物P1/P2扩增打靶片段;挑取鸡白痢沙门菌ATCC 19945(携带pKD46)单菌落,在 LB(含 Amp 100 μg/μL)中培养至对数期,加入阿拉伯糖(终浓度30 mmol/L)诱导2 h。取出培养后的菌液冰上放置10 min后,使用冰冷的去离子水重悬3次,制备感受态细胞。将打靶片段电转化到感受态细胞中,涂布氯霉素平板,培养24 h后挑取单菌落进行PCR鉴定。42℃热激去除质粒pKD4,得到一次重组菌株ATCC19945::cat。挑取单菌落摇菌至对数期,冰冷的去离子水重悬,制备感受态细胞,电转化质粒pCP20,消除氯霉素抗性标记,最终得到缺失cpxR基因的二次重组菌株ATCC19945ΔcpxR,采用引物 P5/P6对其进行 PCR鉴定。
使用细菌基因组提取试剂盒提取鸡白痢沙门菌基因组DNA,作为模板,利用P3/P4引物扩增cpxR基因片段,将其克隆至pBR322质粒中,构建pBR322-cpxR,电转化至菌株 ATCC19945ΔcpxR中,构建回补菌株ATCC19945ΔcpxR+cpxR。
得到的菌株 ATCC19945ΔcpxR和 ATCC19945 ΔcpxR+cpxR,使用CpxR-PcAb作为一抗,以羊抗鼠HRP-IgG作为二抗,western blot鉴定基因缺失菌株和回补菌株cpxR基因的表达情况。
1.5 重组菌生长曲线和生化特性的测定挑取ATCC19945、ATCC19945ΔcpxR和 ATCC19945ΔcpxR+cpxR单菌落接种LB液体培养基中过夜培养,次日按1∶50转接新鲜LB,37℃震荡培养;每隔 2 h测定一次菌液OD600nm,绘制3种菌的生长曲线。采用ATB自动鉴定系统对ATCC19945、ATCC19945ΔcpxR和ATCC19945ΔcpxR+cpxR进行生化特征的鉴定。
1.6 重组菌胞内存活能力的测定取生长良好的Raw264.7巨噬细胞接种24孔细胞板;将培养至对数 生 长 期 的 ATCC19945、ATCC19945ΔcpxR和ATCC19945ΔcpxR+cpxR细菌计数。按照 MOI=10的剂量将3种细菌分别加入细胞培养孔中,孵育1 h后置换为含 20 μg/mL庆大霉素的 DMEM继续培养,以杀死细胞外的细菌。取不同感染时间点(2 h、6 h、10 h、24 h)裂解细胞,进行细菌计数。试验重复3次,数据统计使用Prism 5.0软件分析。
1.7 重组菌的应激试验将培养至对数期的ATCC19945、ATCC19945ΔcpxR和 ATCC19945ΔcpxR+cpxR分别使用pH3.5和pH10.0的灭菌生理盐水,37℃ 孵育30 min,测试重组菌对酸、碱的应激;测试上述菌在42℃,生理盐水中孵育10 min的热应激;测试上述菌在含10 mmoL/L H2O2的生理盐水,37℃孵育10 min的氧化应激。测试完成后倍比稀释进行细菌计数。试验重复3次,数据统计采用Prism 5.0软件。
1.8 重组菌的抗蛋清杀伤试验取4~6枚鸡蛋表面消毒后,无菌吸取蛋清。将培养至对数期的ATCC19945、ATCC19945ΔcpxR和 ATCC19945ΔcpxR+cpxRPBS重悬并稀释至 1×104cfu/mL后,取菌液加入等体积蛋清液中充分混匀,37℃孵育。在不同时间点进行细菌计数,计算细菌存活率(不同时间点的活菌数与初始活菌数之比)。
2 结果
2.1 ATCC19945ΔcpxR基因缺失株与回补株的构建及鉴定PCR扩增含有cpxR基因同源序列和氯霉素基因的打靶片段,电转化至鸡白痢沙门菌ATCC19945感受态细胞中,得到一次重组菌株ATCC19945::cat;利用质粒pCP20消除氯霉素片段,得到二次重组菌株 ATCC19945ΔcpxR。利用质粒pBBR322,构建回补菌株 ATCC19945ΔcpxR+cpxR。经过PCR验证,获得了一次重组菌株ATCC19945::cat和二次重组菌株 ATCC19945ΔcpxR(图 1A)。为了进一步确认cpxR基因的敲除,利用鼠源抗CpxRPcAb进行western blot分析,结果显示cpxR基因在缺失菌株中没有表达,在回补菌株中获得了表达(图1B)。表明,获得了cpxR基因敲除菌株和其回补菌株。

图1 鸡白痢沙门菌cpxR基因缺失株ATCC19945ΔcpxR的鉴定Fig.1 Identifiation of cpxR-deletion strain of S.pullorum
2.2 重组菌的生化特性分析和生长曲线绘制利用ATB全自动生化鉴定系统对ATCC19945、ATCC19945 ΔcpxR和ATCC19945ΔcpxR+cpxR的生化反应谱进行测定。结果显示:3株菌之间生化反应谱无区别,表明cpxR基因缺失并不影响鸡白痢沙门菌生化特性。菌株 ATCC19945、ATCC19945ΔcpxR和 ATCC19945 ΔcpxR+cpxR的生长曲线结果显示,在LB液体培养基中,37℃培养条件下,3株细菌的生长速度无明显差异(p<0.01)(图 2)。表明,cpxR基因缺失并未造成鸡白痢沙门菌的营养缺陷。
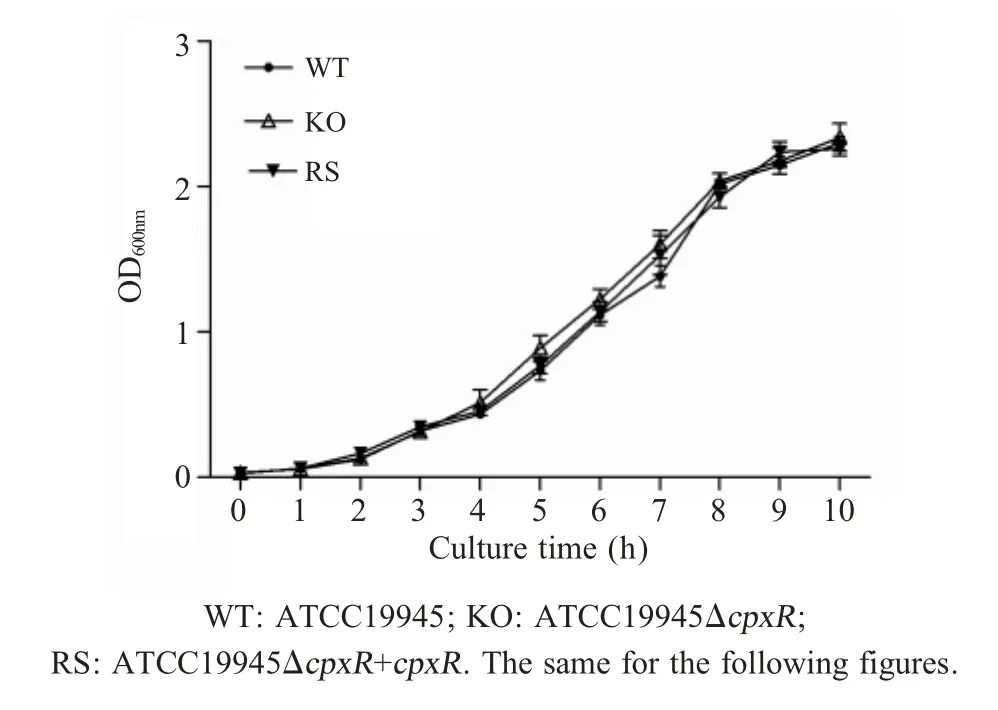
图2 各菌株生长曲线测定Fig.2 Growth curve determination of the S.pullorum strains
2.3 cpxR基因缺失对白痢沙门菌胞内存活的影响取 ATCC19945、 ATCC19945ΔcpxR和 ATCC19945ΔcpxR+cpxR菌液,以MOI=10的剂量感染鼠源巨噬细胞系Raw264.7,测定其胞内存活能力。结果显示,在感染后的不同时间点,3种菌的活菌数无明显差异(p>0.05)(图 3)。结果表明,在细胞水平上cpxR基因对鸡白痢沙门菌的胞内存活能力没有明显的影响。
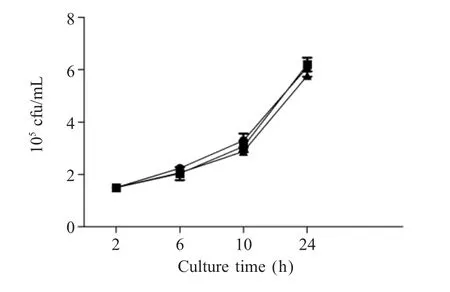
图3 各菌株的胞内存活试验Fig.3 Intracellular survival test of the S.pullorum strains
2.4 cpxR基因缺失对白痢沙门菌抗应激能力的影响体外应激试验检测菌株ATCC19945、ATCC19945 ΔcpxR和ATCC19945ΔcpxR+cpxR对酸、碱、热和氧化应激的抵抗能力。结果显示,cpxR基因缺失株在应激条件下其存活菌数均低于野生型菌株(p<0.01),抗应激能力减弱,回补菌株则恢复了抗应激能力(图4)。表明CpxR参与白痢沙门菌对环境应激的抵抗。
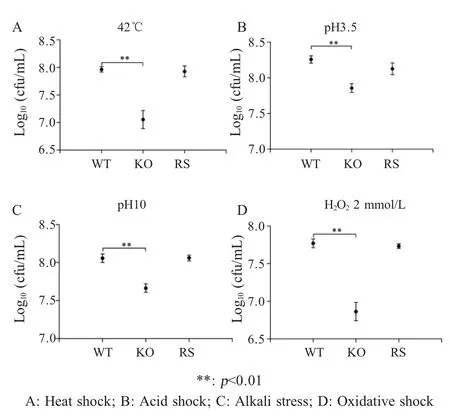
图4 环境应激对cpxR基因缺失株生长的影响Fig.4 Effects of environmental stress on the growth of cpxR gene-knockout strain
2.5 重组菌的抗蛋清杀伤试验将菌株ATCC19945、ATCC19945ΔcpxR和 ATCC19945ΔcpxR+cpxR与蛋清混合孵育后,通过活菌计数法算出各细菌存活率。结果显示,蛋清对白痢沙门菌有一定的杀伤作用,菌株ATCC19945ΔcpxR存活率明显低于 ATCC19945(p<0.01),回补菌株抗蛋清杀伤能力有所恢复(图5)。 结果表明,CpxR参与鸡白痢沙门菌对蛋清杀伤能力的抵抗。
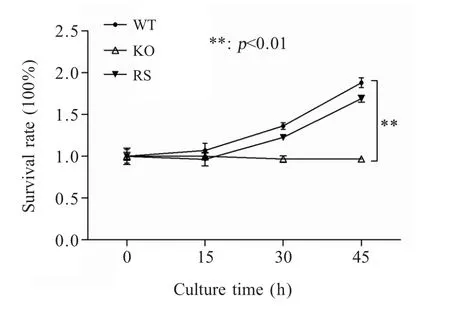
图5 cpxR基因缺失对ATCC19945菌株在蛋清中存活率的影响Fig.5 Survival rate of ATCC19945 related strains in egg albumen
3 讨论
鸡白痢由沙门菌中的鸡白痢沙门菌引起,在我国,该病依然是严重危害养禽业的传染病之一[3]。沙门菌的致病性表现为对宿主细胞的侵袭能力和在细胞内增殖的能力。经食物和水源进入消化道后,沙门菌要耐受胃肠道应激和细胞内的杀伤,实现在宿主细胞内的增殖[6]。因此,鸡白痢沙门菌需要抵御环境应激的能力。研究表明,多种调控系统在其中发挥了重要作用,例如双组分系统CpxR/A。嗜血杆菌、柠檬酸杆菌和阪崎肠杆菌等细菌的CpxR/A系统缺失菌株均发生了不同程度的毒力降低,表明该系统可能参与了对多种应激条件的抵抗[7-11]。为了证明CpxR/A系统的重要作用,本研究利用λ-Red重组技术构建了鸡白痢沙门菌cpxR基因缺失菌株,进行了各项应激试验。结果显示,cpxR基因参与了鸡白痢沙门菌抵御热、酸、碱和氧化应激。利用鼠源巨噬细胞Raw264.7进行体外细胞感染试验,结果显示cpxR基因缺失株并未表现出明显的毒力降低,这可能是由于体外试验并不能完全模拟体内感染,鸡白痢沙门菌在体内遇到的不良环境复杂的多,因此简单的体外细胞感染试验并不能显示出细菌毒力的变化。同时,由于本研究采用的鼠源巨噬细胞,而没有使用鸡源巨噬细胞,这也可能是胞内存活能力没有明显差异的一个原因。
在成年母鸡体内,鸡白痢沙门菌能够穿过卵巢进入卵中,并能耐受蛋清中多种杀菌成分而存活下来,引起雏鸡发病。在蛋清中,多种成分具有抑菌杀菌作用,一是蛋清中含有的卵转铁蛋白,可以大量螯合蛋清中的铁离子,使得细菌难以获得铁;二是蛋清中的溶菌酶,可以溶解细菌;三是蛋清中的核酸内切酶和外切酶,能够破坏细菌的DNA,最终杀伤细菌[12-13]。耐受蛋清杀伤的能力是鸡白痢沙门菌能够垂直传播的重要原因[14-15]。本研究显示cpxR基因缺失后,鸡白痢沙门菌在蛋清中的存活能力显著降低,表明cpxR基因参与了鸡白痢沙门菌对蛋清杀伤的抵抗,其具体机制尚需进一步研究。
总之,cpxR基因参与了鸡白痢沙门菌抵御环境应激和蛋清杀伤,在不同环境应激中,细菌的存活率降低,但是cpxR基因缺失株在鼠源巨噬细胞Raw264.7内的增殖能力没有发生改变。本研究通过cpxR基因敲除及应激试验证明CpxR/A系统在鸡白痢沙门菌抵御环境应激中发挥了重要作用,但是其调控机制尚不明确,这将是本研究室下一步的研究重点。

