采用RNAscope原位杂交技术检测PRRSV与PCV2的共感染
王晓捷,崔蒙蒙,常天明,王 刚,李江南,何希君,刘长明,熊 涛,翁长江*
(1.长江大学 生命科学学院,湖北 荆州 434025;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069;3.华中农业大学 动物医学院,湖北 武汉 430070)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的一种严重威胁世界养猪业的高度接触性传染病,该病可导致母猪流产、产死胎、木乃伊胎等繁殖障碍以及各日龄猪特别是育肥仔猪的严重呼吸道症状[1]。临床上PRRS的发生常伴随其它病毒的混合感染或细菌的继发性感染。流行病学调查结果显示,猪圆环病毒2型(Porcine circovirus type 2,PCV2)与PRRSV共感染最为常见。在出现断奶仔猪多系统衰竭综合征(PMWS)临床症状的猪群中,PRRSV和 PCV2共感染比率可高达 47.7%[2]。与PRRSV或PCV2单独感染相比,PRRSV和PCV2共感染的仔猪病理变化明显加重,病毒血症持续时间增长[3]。先感染高致病性 PRRSV(HP-PRRSV)再感染PCV2的猪群发病率和死亡率明显提高[4],这些结果表明PRRSV和PCV2共感染具有协同致病能力。
PCR、RT-PCR、免疫组化方法和ELISA是检测PRRSV和PCV2共感染的常用方法[5-6]。新一代基于双Z结构寡核苷酸探针的RNAscope原位杂交技术被广泛应用于检测示踪组织或细胞内的RNA[7]。RNAscope技术已经在肿瘤、胚胎发育等研究领域得到广泛应用,适用于检测细胞、石蜡包埋切片或新鲜冰冻组织切片中的RNA。已有研究报道RNAscope能够有效检测猪肺泡巨噬细胞(PAM)和组织中的PRRSV RNA[8]。本研究利用RNAscope原位杂交技术,检测了PRRSV和PCV2共感染的PAM和石蜡包埋切片中的PRRSVN基因和PCV2Rep基因。为PRRSV和PCV2共感染提供了一种新的检测方法,为探究PRRSV和PCV2共感染协同致病机制奠定基础。
1 材料与方法
1.1 病毒、细胞和临床组织样品PRRSV HuN4株由哈尔滨兽医研究所田志军研究员惠赠;PCV2b YJ株由哈尔滨兽医研究所刘长明研究员惠赠;PAMs采用肺灌洗的方法分离自28日龄健康仔猪[9];临床PRRSV-PCV2共感染猪的肺脏、脾脏、淋巴结和肾脏石蜡包埋组织由华中农业大学动物医学院提供。
1.2 主要实验材料多聚甲醛、Triton X-100、DAPI、TRITC标记的山羊抗兔IgG、FITC标记的山羊抗鼠IgG购自美国Sigma-Aldrich公司;8孔EZ培养皿购自德国Millicell公司;ImmedgeTM疏水性屏障笔、RNAscopeR二代荧光检测试剂盒、Hybez杂交炉均购自美国 Advanced Cell Diagnostics(ACD)公司;兔抗PRRSV Nsp9多克隆抗体由中国农业大学封文海教授惠赠;鼠抗PCV2 Cap单克隆抗体(MAb)由刘长明研究员惠赠。
1.3 RNAscope技术检测PRRSV-PCV2共感染
1.3.1 探针的设计和合成针对PRRSV HuN4株N基因(14 800 bp~15 151 bp)序列设计8对探针,命名为 PRRSV-N-probes;针对 PCV2 YJ株Rep基因(2 bp~894 bp)序列设计 19对探针,命名为PCV2-Rep-probes。探针均由ACD公司设计与合成。
1.3.2 PRRSV-PCV2共感染细胞样品的制备通过肺灌洗的方法制备PAMs,并接种于8孔EZ培养皿内,采用0.1 MOI PRRSV感染PAMs 24 h作为PRRSV感染组;采用1 MOI PCV2感染PAMs 12 h作为PCV2感染组;采用0.1 MOI PRRSV HuN4株感染 PAMs 12 h,再用 1 MOI PCV2感染 12 h作为PRRSV-PCV2共感染组;采用等量1640培养基处理PAMs作为对照组。感染一定时间后固定细胞用做后续实验。
1.3.3 PRRSV和PCV2感染PAMs的探针杂交、信号放大以及检测探针的杂交、信号放大及检测参照RNAscope荧光检测试剂盒说明书以及本实验室前期的RNAscope检测方法[8]进行。用ImmedgeTM疏水性屏障笔在1.3.2固定的细胞外周建立疏水圈,在疏水圈内滴加蛋白酶III室温处理细胞15 min,去除多余液体后用PBS洗涤载玻片,向载玻片疏水圈内的组织或细胞样品滴加探针溶液,在Hybez杂交炉中40℃恒温恒湿孵育2 h,去除多余液体,缓冲液冲洗载玻片;在同样恒温恒湿条件下,依次通过RNAscopeR二代荧光检测试剂盒中AMP1-FL、AMP2-FL、AMP3-FL和AMP4-FL-A等处理使信号逐级放大;加入DAPI,避光复染30 s后封片。在激光共聚焦显微镜下观察并记录结果。
1.3.4 间接免疫荧光(IFA)检测以及与RNAscope联和使用检测PRRSV-PCV2共感染将PRRSV和PCV2单独感染或PRRSV-PCV2共感染的PAMs固定后,加入 0.3%TritonX-100处理 15 min;10%FBS封闭 30 min;以兔抗PRRSV Nsp9多克隆抗体(1∶100)或鼠抗 PCV2 Cap MAb(1∶100)为一抗室温孵育 2 h,以山羊抗兔 IgG-TRITC(1∶200)或山羊抗鼠IgG-FITC(1∶200)为二抗室温孵育 1 h;分别以 IFA检测PRRSV、PCV2以及 PRRSV-PCV2的共感染。同时以RNAscope-IFA二者联和检测PRRSV-PCV2共感染的PAMs,样品先经过RNAscope信号放大步骤,再经同样的IFA方法检测。
1.4 RNAscope方法检测PRRSV-PCV2共感染的临床样品临床PRRSV-PCV2共感染猪的肺脏、脾脏、淋巴结和肾脏石蜡包埋组织经切片后,使用二甲苯透明、脱蜡,然后利用PRRSV-N-probes和PCV2-Rep-probes同时进行标记(Label)或不使用探针标记(Mock),后续信号放大和检测过程与1.3.3相同。
2 结果
2.1 RNAscope原位杂交方法检测PRRSV-PCV2共感染利用RNAscope原位杂交方法检测PRRSV、PCV2单独感染或PRRSV-PCV2共感染PAMs中的病毒RNA。激光共聚焦结果显示,在PRRSV单独感染的PAMs中,PRRSV-N-probes可以识别PRRSVN基因,出现绿色荧光;在PCV2单独感染的PAMs中,PCV2-Rep-probes可以识别PCV2Rep基因,出现红色荧光;在PRRSV-PCV2共感染的PAMs中,能在同一细胞内检测到PRRSVN基因和PCV2Rep基因,在同一细胞内同时出现红色和绿色荧光(图1A)。结果表明,RNAscope原位杂交方法可以从基因水平检测到PRRSV-PCV2的共感染。
利用IFA试验检测 PRRSV、PCV2单独感染或PRRSV-PCV2共感染的PAMs。结果显示, PRRSV单独感染的PAMs出现绿色荧光(Nsp9蛋白);PCV2单独感染的PAMs细胞质中出现红色荧光(Cap蛋白);在PRRSV-PCV2共感染的同一PAMs的细胞质中同时观察到绿色荧光和红色荧光(图1B)。结果表明,IFA可以从蛋白水平检测到PRRSV-PCV2的共感染。
RNAscope原位杂交技术可以在细胞水平上直观地检测病毒RNA,IFA则常用于检测目的蛋白的亚细胞定位,本研究利用IFA和RNAscope原位杂交同时检测PRRSV-PCV2共感染的 PAMs,结果显示在PRRSV-PCV2共感染的PAMs中,PRRSVN基因和PCV2的Cap蛋白在同一个PAM内分别被PRRSV-N-probes和anti-Cap抗体识别,同时出现绿色和红色荧光(图 1C); PRRSV的 Nsp9蛋白和PCV2Rep基因在同一个PAM细胞内分别被PCV2-Rep-probes和anti-Nsp9抗体识别,同时出现绿色和红色荧光(图1D)。这些研究结果表明,RNAscope原位杂交与IFA方法联和使用可以用于检测单个细胞中的PRRSV-PCV2的共感染,并能同时对细胞中病毒RNA和病毒蛋白进行亚细胞定位。
2.2 RNAscope原位杂交检测PRRSV-PCV2共感染的临床样品将来源于临床PRRSV-PCV2共感染猪的组织经石蜡包埋、组织切片和脱蜡处理,再利用PRRSV-N-probes和PCV2-Rep-probes对其进行RNAscope原位杂交检测。结果显示,在PRRSVPCV2共感染猪的肾脏组织中仅检测到PCV2感染的阳性细胞(红色荧光)。在PRRSV-PCV2感染猪的肺脏、脾脏和淋巴结的组织切片中同时检测到PRRSV(绿色荧光)和 PCV2感染的细胞(红色荧光)(图 2)。结果表明,RNAscope原位杂交可用于PRRSV-PCV2共感染的临床样品的检测,但需对多个组织样品进行检测才能得到准确的结果。

图1 RNAscope方法检测PRRSV-PCV2的共感染Fig.1 Detection of PRRSV and PCV2 co-infection in PAMs by RNAscope
3 讨论
临床上常用PCR、RT-PCR、免疫组化和ELISA等方法检测PRRSV-PCV2共感染[10-12],但是这些方法无法直接观察到两种病毒感染的同一个细胞。传统的基于核酸探针杂交的原位杂交技术由于病毒RNA丰度低、易降解等问题导致假阴性、背景高的原因没有得到推广。RNAscope原位杂交技术采用独特的双Z结构探针设计保证了探针识别序列的特异性,其特殊的信号级联放大策略可以在样品中标记低拷贝数甚至降解成小片段的RNA。因此,该技术被用于检测HPV的感染[13],但用于多病原混合感染的检测鲜有报道。
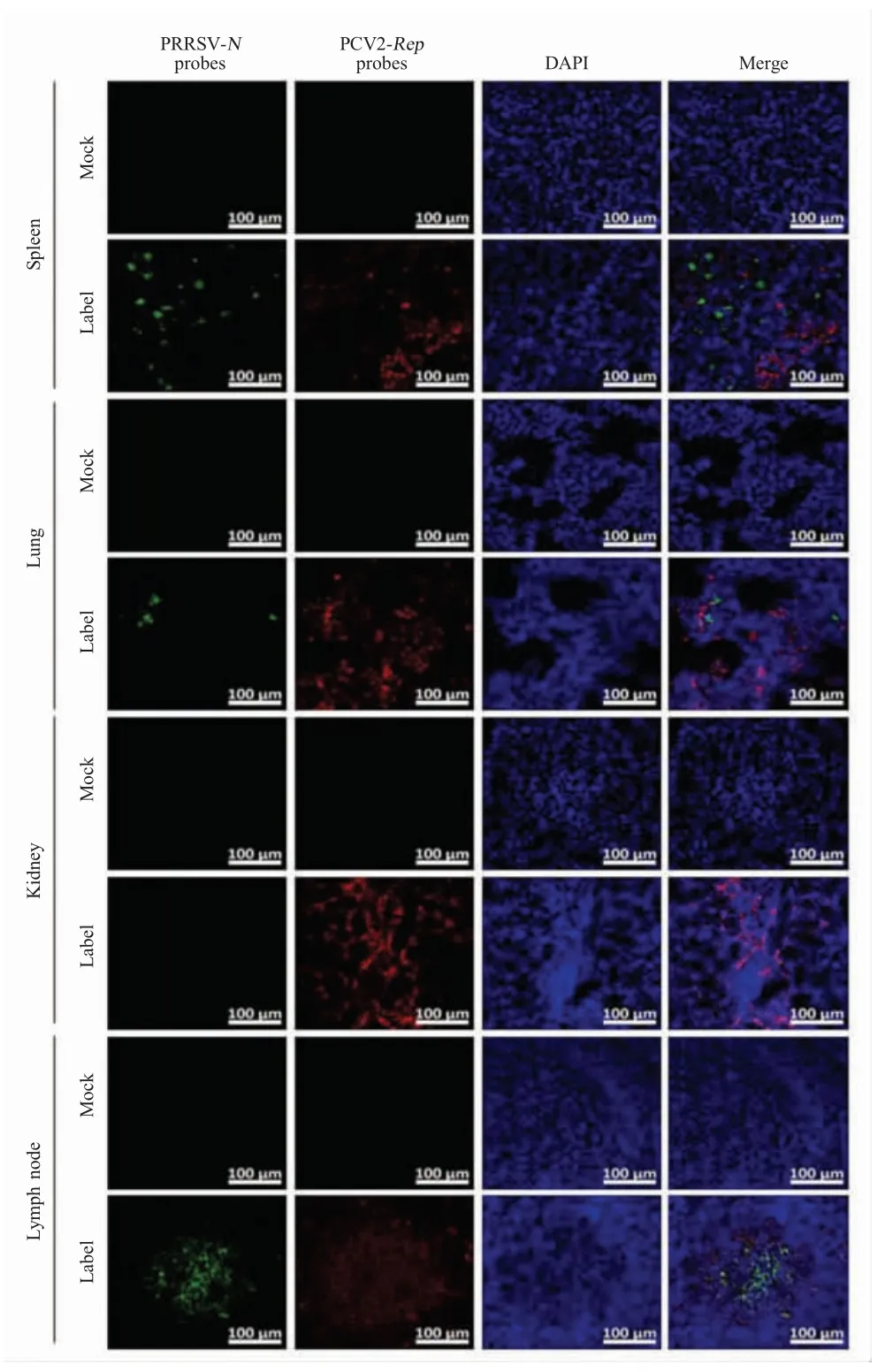
图2 RNAscope方法检测PRRSV-PCV2共感染猪的组织Fig.2 Detection of PRRSV and PCV2 infection in the paraffin-embedded tissues from piglets infected with PRRSV and PCV2 using RNAscope probes
PRRSV-PCV2共感染在临床上普遍存在。有研究表明,相对于PRRSV和PCV2单独感染,PRRSV-PCV2共感染对彼此的增殖具有促进作用,病毒血症持续时间增长[14],这可能与PRRSV感染能够降低巨噬细胞、DC细胞等抗原递呈细胞的吞噬能力[15]和PRRSV-PCV2共感染时明显降低具有抗病毒活性的IFN-γ的表达水平[16]等特性有关,但其中具体分子机制仍不清楚。因此,通过RNAscope技术研究PRRSV-PCV2共感染将为阐明其协同致病的分子机制奠定基础。
本研究设计了两组特异的探针,采用RNAscope原位杂交技术,检测了PRRSV与PCV2共感染的PAM。实验结果表明该方法可以检测PRRSV-PCV2共感染的PAM。这与IFA检测结果一致。但前者是从基因水平检测PRRSV-PCV2共感染的单个PAM,后者是从蛋白水平检测PRRSV-PCV2共感染的单个PAM,二者可以对检测结果互相印证。
本研究还用RNAscope原位杂交技术检测了来自临床PRRSV-PCV2共感染猪的不同组织切片。结果显示,在PRRSV-PCV2共感染猪的脾脏、肺脏和淋巴结中可以检测到PRRSV和PCV2感染的细胞,但不同组织中PRRSV和PCV2检出阳性细胞数量差异较大,在淋巴结的生发中心区域有大量PRRSVPCV2共感染细胞。肾脏组织并未检测到PRRSV感染的细胞,造成上述差异的原因可能是由于病毒组织嗜性的差异或病毒感染程度不同造成的。因此,在利用RNAscope原位杂交方法检测PRRSV-PCV2共感染的临床样品时建议综合考量多个组织的检测结果。RNAscope原位杂交技术可以从基因水平直观地检测单个细胞中的病毒感染,IFA常用于检测病毒蛋白的亚细胞定位。本研究首次利用RNAscope探针检测PRRSVN基因,同时利用IFA方法检测PCV2 Cap蛋白;或用RNAscope探针检测PCV2Rep基因,同时利用IFA方法检测PRRSV Nsp9蛋白来检测PRRSV-PCV2共感染。结果表明,RNAscope原位杂交技术能够与传统的IFA方法联和使用,对细胞中的病毒RNA和病毒蛋白进行鉴定和亚细胞定位。在PRRSV-PCV2共感染过程中,该方法可为探究细胞水平上PRRSV和PCV2的复制规律以及病毒RNA与蛋白相互作用提供可靠的可视化证据。综上所述,相对于PCR和ELISA方法,RNAscope原位杂交方法能够直观地检测病毒核酸的亚细胞定位;RNAscope-IFA联和使用能够检测到单个细胞中两种病毒的共感染。由此表明,利用RNAscope原位杂交方法对PRRSV-PCV2共感染的检测及其协同致病机制的研究具有重要意义。

