肺炎克雷伯菌ST23流行株皮肤脓肿感染及肥大细胞动态变化观察
雷志强,刘冰靥, 张 丁,鲁波勇,韩 莉,王德成,6*
(1.三峡大学 医学院,湖北 宜昌 443002;2.三峡大学 感染与炎症损伤研究所,湖北 宜昌 443002;3.武穴市第一人民医院,湖北 武穴 435400;4.三峡大学 第一临床医学院 & 宜昌市中心人民医院病理科,湖北 宜昌 443003;5.宜昌市第三人民医院,湖北 宜昌 443003;6.天然产物研究与利用湖北省重点实验室(三峡大学),湖北 宜昌 443002)
肺炎克雷伯菌(Klebsiella pneumonia,KP)广泛分布于自然界,是主要定居在人和动物呼吸道、肠道等部位及环境中的一种重要机会致病菌,可以引起人和动物的多种感染。作为一种人兽共患病原菌,KP不仅是医院与社区感染的重要致病菌之一,而且也能造成免疫功能低下或免疫抑制动物的各种炎症,如肺炎、子宫炎、乳腺炎及其它化脓性炎症,对养殖业造成较大的经济损失[1]。此外,杨帆等研究发现,从猪、鸡、犬和兔子等动物分离的KP菌株有较强的生物膜形成能力,并且该生物膜与其毒力有关[2]。随着广谱抗菌素大量使用,KP耐药菌株不断增加,严重威胁人类健康和养殖业发展[3]。KP不仅可以引起呼吸系统感染,还可导致各种外周组织感染,如手术感染、外伤及皮肤感染[4-6]。有研究发现KP引起的皮肤感染率比较高,Saaiq等报道巴基斯坦医学院烧伤中心细菌感染病例中KP感染率为20.58%,位居第二[6]。前期通过收集临床医院的KP菌株,并进行MLST分型,鉴定到该菌ST23型是宜昌地区的主要流行菌株[7]。为研究ST23菌株对皮肤的感染能力及其导致的皮肤脓肿过程中肥大细胞及其主要介质的动态变化,为全面认识本地区ST23型KP菌株导致的皮肤感染提供实验依据。
1 材料与方法
1.1 主要实验材料浓度为 1×109cfu/100 μL或5×108cfu/50 μL的KP ST23型菌株由本实验室分离并保存。甲苯胺蓝购自Sigma公司;抗肥大细胞类胰蛋白酶(Tryptase)一抗(ab2378)购自Abcam公司;HRP标记的羊抗鼠IgG抗体购自北京中杉金桥生物技术有限公司。SPF级C57BL/6小鼠由三峡大学实验动物中心提供;MyD88KO小鼠购自南京大学模式动物研究所。
1.2 动物分组及感染实验将60只SPF级C57BL/6小鼠随机分为 3组:PBS对照组(20只)、KP常规感染组(20只)和免疫抑制 KP感染组(20只),20只MyD88KO小鼠接种KP作为免疫功能缺失感染组。所有C57BL/6和MyD88小鼠又分为两个小组(10只/组):其中一个小组用于接种后脓肿体积变化观察,另一小组用于接种后1 d、5 d和10 d的皮肤采样。免疫抑制KP感染组小鼠在KP感染前3 d按体质量20 mg/kg连续注射环磷酰胺,然后再接种KP。所有小鼠均预饲养3 d后在其右侧腹部皮下脱毛处理,再饲养5 d后进行后续实验。对照组小鼠皮下接种50 μL无菌PBS,而所有感染组小鼠均接种 50 μL KP 菌液(5×108cfu/小鼠)。接种后每天观察小鼠两次,主要观察接种处皮肤变化,并做好记录。实验过程中供给专用饲料及饮水,并遵循实验动物的 3R(Reduction、Replacement、Refinement、3R)原则给予人道关怀。
1.3 感染后小鼠皮肤脓肿的组织病理学变化对KP感染组和PBS对照组小鼠各随机选取10只,观察并记录脓肿部位皮肤颜色变化、是否有溃疡和结痂等状况,并做好详细记录。每天两次,分别用游标卡尺测定脓肿的长径与宽径,按照公式[V=(π/6)L·W2]计算脓肿体积(L-脓肿长径,W-脓肿宽径),直至实验结束。
各组剩余10只小鼠在接种后1 d、5 d和 10 d时,分别随机取3只小鼠断颈迫杀,取脓肿处皮肤置于4%多聚甲醛溶液固定。常规包埋切片后进行H.E染色,比较各组小鼠皮肤病理组织学变化。
1.4 感染后小鼠肥大细胞及其主要介质的动态变化与观察参照文献[8]中改进的甲苯胺蓝染色方法,对上述皮肤组织制备5 μm镜检切片,显微镜下观察不同组别小鼠肥大细胞的分布与形态,并分别计数肥大细胞数量。
以抗肥大细胞 Tryptase抗体为一抗(1∶200),羊抗鼠HRP-IgG为二抗(商业化Kit不需要稀释,直接使用),进行免疫组化试验。利用cellSens Entry图像分析软件采集照片,进行IPP图像分析。每张切片随机选择10个视野,分析每个视野中Tryptase含量(面密度),以Tryptase表达阳性区域占全视野面积的百分比表示,取其平均值,分别统计不同组别中Tryptase阳性物质表达与分布变化。
1.5 数据处理使用统计学软件SPSS 19.0分析数据,采用析因设计进行方差分析,两组数据之间的差异采用q检验,p<0.05为组间比较差异显著,认为有统计学意义。
2 结果
2.1 感染后小鼠皮肤脓肿体积变化所有接种KP的小鼠在感染第1 d时,皮肤出现红肿,随着感染时间延长,感染处脓肿也发生有规律的变化,在感染后5 d时,部分小鼠感染处皮肤开始出现溃疡和破溃;到第10 d时,有些小鼠溃疡处的皮肤开始结痂,呈现自动愈合过程。尤其是MyD88KO小鼠感染KP后有明显的皮肤脓肿形成。在整个实验过程中,所有感染KP小鼠的皮肤脓肿体积与PBS对照组相比差异极显著(p<0.001),免疫抑制感染组小鼠皮肤脓肿体积和常规感染组相比差异显著(p<0.01)。所有KP感染组小鼠的皮肤脓肿体积均呈现动态变化规律,在感染早期呈现逐渐增加趋势,后期逐步降低(图 1),并且体积变化与脓肿的动态发展过程相一致。表明KP ST23型菌株能够造成皮肤感染。

图1 各组小鼠皮肤脓肿体积变化曲线Fig.1 The dynamics of skin abscess in KP-infected mice during the experimental period
2.2 感染后小鼠皮肤组织病理学变化分别于接种后1 d、5 d和10 d时观察小鼠感染处皮肤组织,显示在不同时间点PBS组小鼠皮肤结构均较完整,显微镜下无炎性细胞浸润(图2A、2E);常规KP感染组小鼠有较明显的皮肤组织病理变化,感染后1 d时皮下区域有明显可见的炎性细胞分布,第5 d时皮肤纤维结构破坏(图 2B、2F);免疫抑制组感染KP后皮肤炎症反应明显(图2D、2H);MyD88KO组小鼠感染KP后第1d炎性细胞浸润不明显,第5 d时表皮细胞层遭到不同程度的破坏,结构模糊不清,真皮乳头层内的皮脂腺结构完全遭到破坏,皮下组织炎症区域大量炎症细胞浸润。真皮胶原结构遭到不同程度的破坏,凝聚成片状或条索状,在其中有大量炎性细胞浸润(图2C、2G)。表明本研究中的KP ST23型菌株能够造成小鼠的皮肤炎症,尤其是对环磷酰胺造成的免疫功能抑制小鼠及免疫功能缺陷的MyD88KO小鼠具有较强的皮肤损伤。

图2 各组小鼠皮肤组织病理变化观察(HE染色)Fig.2 Histopathologic examination of the skin in mice after infection with KP
2.3 感染后小鼠皮肤肥大细胞观察采集各组小鼠皮肤组织,甲苯胺蓝染色后观察肥大细胞。结果显示,对照组小鼠接种PBS后1 d与5 d时小鼠皮肤组织中肥大细胞很少且形态较小,并且主要分布在表皮层区域(图3A、3 E);常规感染组小鼠接种KP 1 d和5 d后皮肤表皮层与真皮层均可见肥大细胞分布(图 3B、3F);MyD88KO组小鼠接种KP 1 d和 5 d时可见其表皮层与真皮层均有大量肥大细胞分布(3C、3G);免疫抑制组小鼠感染KP 1 d和5 d时可见大量的肥大细胞弥散分布表皮和真皮层(3D、3H)。对不同组感染 KP后 1 d、5 d和 10 d小鼠皮肤肥大细胞的数量统计显示,与PBS对照组相比,KP各感染组小鼠肥大细胞数量均差异显著(p<0.001)。整个实验周期内,除了PBS对照组,随着感染时间延长,接种KP菌株的各组小鼠皮肤组织中肥大细胞数量均明显增加,但各感染组小鼠之间肥大细胞无显著差异(3I)。接种KP后5 d时各组小鼠肥大细胞数目达到峰值,而后呈现逐渐降低趋势,表明KP ST23型菌株能够诱导小鼠皮肤组织中肥大细胞的活化。
2.4 感染后小鼠皮肤Tryptase的表达变化采集各组小鼠皮肤组织进行免疫组化检测其Tryptase的表达。结果显示,PBS对照组小鼠皮肤中几乎检测不到tryptase(图4A),而各KP感染组小鼠皮肤组织中均能检测到tryptase的表达与分布,尤其是炎症区域中明显可见,且在皮肤各层结构中均检测到tryptase阳性信号(图4B~图4D)。Tryptase阳性物质面密度统计分析显示,整个实验周期内,各KP感染组小鼠皮肤中tryptase的表达均呈明显增加趋势,与 PBS对照组相比差异显著(图 4E,p<0.001),但其余感染组之间无显著差异。各感染组小鼠在感染KP 5 d时tryptase的表达达到峰值,然后逐渐降低。表明KP感染后能够诱导小鼠皮肤组织中Tryptase的活化,并且Tryptase的表达呈现先增加后降低的趋势。

图3 各组小鼠皮肤肥大细胞动态分布与数量统计Fig.3 Dynamics of mast cells during the skin abscess in mice
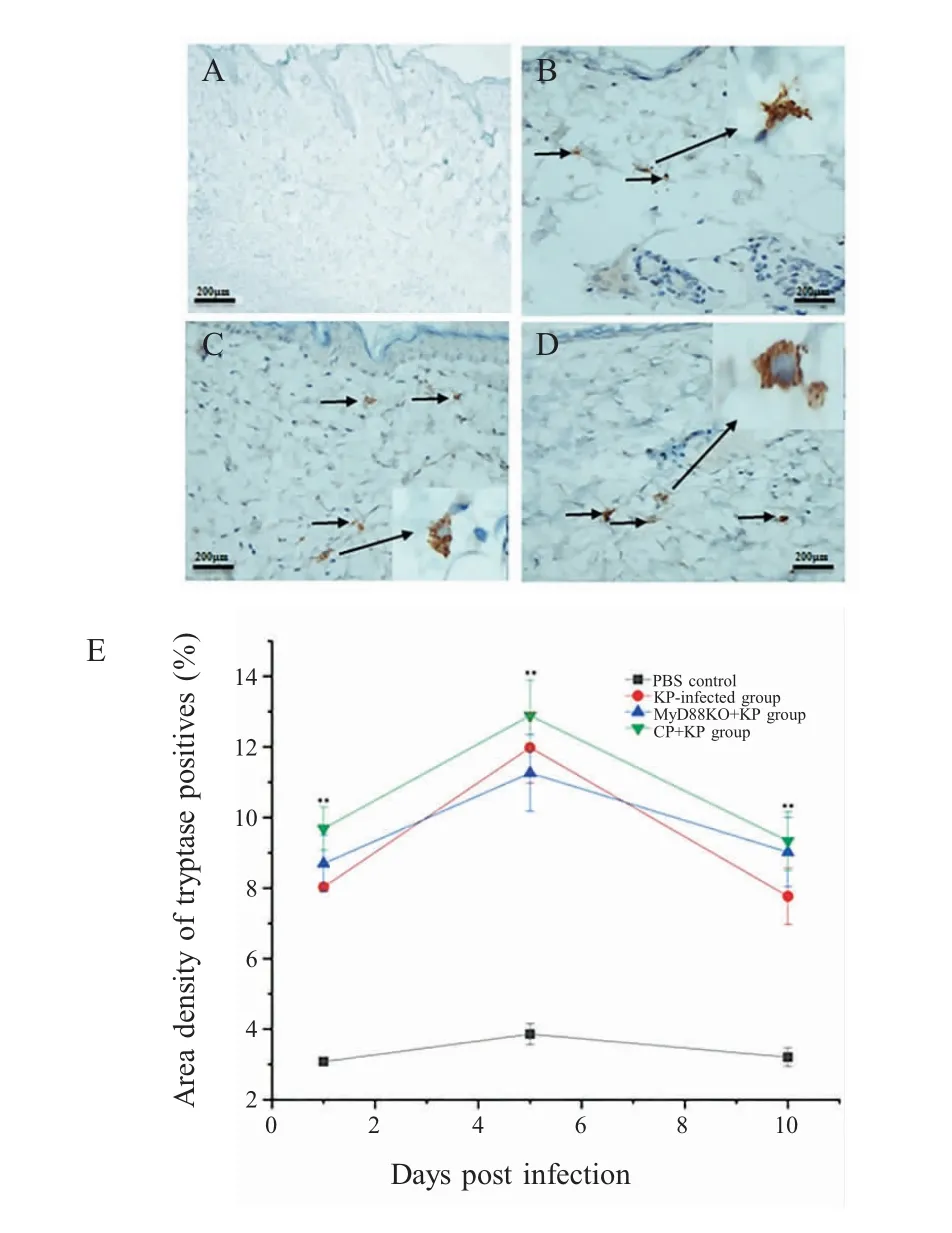
图4 Tryptase在各组小鼠皮肤中的表达分布与统计分析Fig.4 Expression and dynamics of tryptase in the skin abscess of mice
3 讨论
KP可以通过皮肤接触传染,因此容易造成皮肤受伤后的术后感染或皮肤感染形成脓肿[4,6,9-10]。Guo等发现ST23型是温州地区临床KP的主要流行克隆[11]。Siu等通过收集临床分离克雷伯菌株并经MLST分型,显示ST23型是香港、台湾和新加坡等地区的主要流行株,进一步研究显示相对非ST23型菌株,ST23型菌株具有较强的抗吞噬效应和对小鼠的致死能力[12]。本研究显示ST23菌株能够导致小鼠皮肤脓肿形成,主要表现为小鼠表皮或真皮层有明显可见的炎性细胞浸润,正常结构破坏。本研究结果表明本地区ST23型菌株具有较强的致病性。
MyD88是 Toll样受体(Toll-like receptors,TLRs)信号通路中重要的接头蛋白,van Lieshout和Cai等团队分别研究发现MyD88对宿主抗克雷伯菌感染至关重要[13-14],MyD88KO小鼠感染克雷伯菌后易死亡,且机体清除细菌的能力显著降低。Feuerstein等发现真皮层巨噬细胞MyD88分子在宿主抗耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA)过程中能快速传递信号[15]。本研究显示相较于正常C57BL/6小鼠,MyD88KO小鼠感染KP后形成脓肿的体积较大,皮肤脓肿自愈时间较晚,并且该表型小鼠与用环磷酰胺预处理的小鼠类似。
肥大细胞广泛分布于皮肤、呼吸道等组织中,在抗皮肤感染等中发挥重要作用[16],但KP皮肤感染及脓肿形成过程中肥大细胞动态变化的研究少有报道。本研究中与PBS对照组相比,各KP感染组小鼠中肥大细胞数量明显增加,并且部分表现为脱颗粒状态,提示肥大细胞在KP介导脓肿形成过程中激活并释放介质参与发病进程。但统计结果显示在各KP感染组小鼠之间肥大细胞数目与Tryptase表达无明显差异,表明ST23型菌株对免疫抑制或免疫缺陷动物造成的皮肤损伤效应可能还依赖于其它通路或关键分子。
Tryptase为肥大细胞激活的标志[8,17],本研究结合免疫组化染色与图像分析技术,比较了Tryptase在PBS对照组与各KP感染组中的表达与变化趋势,结果显示在KP感染早期,Tryptase表达逐渐增加,在第感染KP第5 d时表达量最高,然后逐渐降低,其表达量与肥大细胞变化趋势相一致,表明KP感染后能够诱导Tryptase表达。Lei等通过ST239型MRSA菌株建立小鼠皮肤感染模型,结果显示随着感染时间延长,小鼠感染处皮肤组织有明显活化的肥大细胞并能释放 Tryptase[16]。Hodille等通过细胞模型研究MRSA诱导肥大细胞活性时,显示MRSA菌株的delta-溶血素(Hld)和酚可溶性调节肽 (Phenol soluble modulins,PSMs)等可通过剂量依赖方式诱导HMC-1人肥大细胞释放类蛋白酶[18]。本实验再次印证了以上研究结果。表明ST23型KP菌株能够诱导小鼠皮肤组织释放Tryptase参与到皮肤炎症反应和组织损伤过程,但其具体机制还有待深入研究。
本研究利用ST23型KP流行株皮下接种SPF级C57BL/6小鼠,对皮肤脓肿形成过程进行了时相性观察,记录其皮肤脓肿体积变化,并进一步比较了其皮肤组织病理学变化。本研究结果稳定、再现性好、为进一步研究KP临床分离株的病原特性、致病机制等小动物感染模型提供依据。另外由于ST23型KP是在宜昌地区首次分离鉴定,提示该型细菌在该地区具有重要临床意义。

