澳洲龙纹斑源致病菌嗜水气单胞菌TPF-2的分离鉴定及药敏特性研究
罗土炎,饶秋华,刘 洋,张志灯,罗 钦,陈美珍,任丽花,黄敏敏,翁伯琦
(1.福建省农业科学院 农业质量标准与检测技术研究所,福建 福州350003;2.福建出入境检验检疫局检验检疫技术中心,福建 福州 350003;3.福建省农业科学院 农业生态研究所,福建 福州 350003)
嗜水气单胞菌(Aeromonas hydrophila)隶属弧菌科气单胞菌属,广泛存在于淡水、海水、土壤、鱼类和脊椎动物肠道中,是一种典型的人兽共患条件致病菌,尤其是水生动物常见的致病菌之一[1]。其可导致多种水生动物表现出不同临床症状,如肌肉和内脏出血、烂鳃、坏死、腹部膨胀、水肿等[2-3];另外,因其常与其它致病菌混合感染使得病情加重,从而给水产养殖业造成严重危害,已引起人们的广泛关注[4]。
澳洲龙纹斑(Maccullochella peelii peelii)又名墨瑞鳕(murray cod)、鳕鲈、澳洲淡水鳕鲈等, 2001年开始引进中国大陆进行人工繁育和高密度养殖,然而2015年9月浙江省衢州市某设施养殖场内澳洲龙纹斑出现腹部肿大,烂尾,部分养殖池出现大量死亡,死亡率达65%。剖检发现鱼腹中有淡红色腹水,肝脏、肾脏等实质性器官出现充血、肿大,后肠充血糜烂,肌肉有针尖状出血点。本研究从患病澳洲龙纹斑中分离到1优势菌株,命名为TPF-2,通过回归试验确定其为病原菌,经形态学、生理生化特征和基于16S rRNA基因序列的系统进化分析对该菌进行了分类鉴定,并通过药敏试验检测了该菌株对各类药物的敏感性,为澳洲龙纹斑源嗜水气单胞菌病的流行病学和耐药性等研究提供依据,同时为该病的防控提供科学指导。
1 材料与方法
1.1 主要实验材料患病澳洲龙纹斑来源于浙江衢州某澳洲龙纹斑设施养殖场,体质量1.0 kg~1.5 kg,体长22 cm~29 cm。健康澳洲龙纹斑来源于同一养殖基地,体质量0.5 kg~1.0 kg,体长15 cm~22 cm,在水温20℃~22℃、溶氧8.23 mg/L的塑料圆桶内(直径为5 m,水深为0.6 m)暂养10 d,观察期间无发病和死亡后用于感染试验。
BHI(BD,BectoTMBrain Heart Infusion)购自 BD中国代理机构;LB液体培养基,哥伦比亚血琼脂培养基(5%脱脂绵羊血)购自广州环凯微生物科技有限公司;API全自动细菌鉴定仪(型号:VITEK 2 COMPACT 30)及相关试剂均购自法国梅里埃公司;细菌基因组DNA提取试剂盒、TaqDNA聚合酶均购自生工生物工程(上海)股份有限公司;药敏纸片购自杭州微生物试剂有限公司。实验中所用引物均由上海生工生物工程技术服务有限公司合成。
1.2 病原菌的分离和培养选取具有典型症状的患病澳洲龙纹斑,用75%的酒精对病鱼进行体表消毒,在生物安全柜无菌取其肝脏、肾脏和腹水等病灶组织,经匀浆粉碎后涂布于BHI琼脂培养基,于28℃培养48 h后,选取平板上形态颜色一致且最多的菌落,挑取单菌落划线纯化培养,最后转移到LB液体培养基中培养至对数期后于16%的甘油中(-80℃)保存,菌株命名为TPF-2。同时对该菌进行溶血试验和电镜观察。
1.3 分离菌16S rRNA基因扩增和系统发育树构建将纯化后的菌株TPF-2接种于BHI液体培养基中,28℃、180 r/min振荡培养18 h后12 000 r/min离心收集菌体,参照试剂盒说明书提取其基因组DNA。利用细菌通用引物扩增16S rRNA基因序列,PCR产物经1%琼脂糖凝胶电泳检测后对目的条带回收纯化,送由铂尚生物技术(上海)有限公司(福州测序部)进行基因序列测定。
从Ezbiocloud数据库中选取30个与菌株TPF-2最相似菌株的16S rRNA基因序列,利用cluster W进行比对,用MEGA7软件包中的Neighbor-Joining法构建其系统进化树,通过1000次Bootstrap检验置信度。
1.4 分离菌的形态学及生理生化鉴定参照KOH拉丝法对菌株TPF-2进行革兰氏鉴定,同时利用API全自动细菌鉴定仪对分离菌株进行生理生化鉴定。
1.5 分离菌的人工感染试验为确定该菌株是否对澳洲龙纹斑具有致病性,选取同一养殖基地的健康澳洲龙纹斑作为感染对象,设1个实验组和1个对照组,每组30尾。经腹鳍基部每尾注射0.2 mL(4.0×109cfu/mL)菌悬液,对照组注射相同剂量的无菌PBS。每天观察其发病症状并记录死亡情况,连续观察10 d。在澳洲龙纹斑出现濒死症状时取其内脏组织进行病原菌的分离培养与鉴定,以确定菌株TPF-2的致病性。
1.6 分离菌的药物敏感试验药敏试验采用纸片扩散法(K-B法)进行检测,并根据美国临床实验室标准研究所的药敏试验指南[5]的标准对实验数据进行分析。
2 结果
2.1 病原菌分离及形态观察从患病澳洲龙纹斑肝、脾脏和腹水中分离到同一株优势菌TPF-2。该菌在BHI固体培养基中生长良好,经过28℃培养24 h后形成直径为1 mm~2 mm、光滑、不规则圆形、隆起、淡黄色菌落。电镜观察可见菌株TPF-2长 0.98 μm~2.96 μm,宽 0.79 μm~0.86 μm,极生单鞭毛(图 1)。在哥伦比亚血琼脂培养基(5%脱脂绵羊血)上可产生明显的β-溶血圈(图 2)。

图1 菌株TPF-2在透射电子显微镜(A)和扫描电子显微镜(B)下的形态特征Fig.1 The morphology of strain TPF-2 under transmission electron micrograph(A)and scanning electron microscope(B)
图2 菌株TPF-2在哥伦比亚血琼脂培养基上产生β-溶血圈Fig.2 β-Hemolysis of strain TPF-2 on the Columbia blood agar medium
2.2 16S rRNA基因序列分析及系统发育树构建利用Sanger法对从菌株TPF-2 PCR扩增的16S rRNA基因序列进行测序,得到1 412 bp DNA序列(GenBank序列号为MH133035)。将该基因序列进行同源性比对分析,显示其属于气单胞菌属(Aeromonas),16S rRNA基因序列与Aeromonas hydrophilasubsp.hydrophilaATCC 7966T和Aeromonas hydrophilasubsp.RanaeLMG 19707T相似度最高,分别为99.9%和99.8%。基于16S rRNA基因系统发育树显示菌株TPF-2与Aeromonas hydrophilasubsp.hydrophilaATCC 7966T,Aeromonas hydrophilasubsp.RanaeLMG 19707T和Aeromonas mediaCECT 4232T聚集到同一分支(图3)。进一步表明该菌株隶属于气单胞菌属,与Aeromonas hydrophila和Aeromonas media具有较近的亲缘关系。
2.3 分离菌的形态学生理生化特征KOH拉丝法鉴定结果显示,TPF-2菌悬液无拉丝现象,表明TPF-2菌株为革兰氏阴性菌。 API全自动细菌鉴定仪进行鉴定结果显示,菌株TPF-2为氧化酶试验阳性,其它生化谱如表1所示,置信度极好。以上结果进一步表明该菌为气单胞菌。
2.4 人工感染试验实验组澳洲龙纹斑在腹鳍基部接种感染初期,表现为食欲废绝,无力游动,腹部贴于池底,24 h后鱼群发病占实验组总数30%且出现死亡,10 d内累计死亡率为56.7%,PBS对照组试验期间未出现死亡,存活曲线结果如图4所示。剖检患病或死亡病鱼肝脏、肾脏肿胀充血,肠壁充血,与自然发病澳洲龙纹斑病变相似。同时,从感染死亡鱼体的肝脏内再次分离到嗜水气单胞菌,其形态、生理生化特征与菌株TPF-2一致,表明菌株TPF-2是澳洲龙纹斑患病的病原菌。
2.5 药敏试验结果药敏试验结果显示,菌株TPF-2对先锋必素、菌必治、硫酸锌霉素、氟苯尼考、诺氟沙星、恩诺沙星6种药物敏感;对红霉素1种药物中度敏感;对卡那霉素、庆大霉素、复方新诺明3种药物介于敏感和中度敏感之间;对利福平1种药物介于中度敏感和耐药之间;对氨苄青霉素、多西环素、磺胺异恶唑等10种药物耐药(表2)。
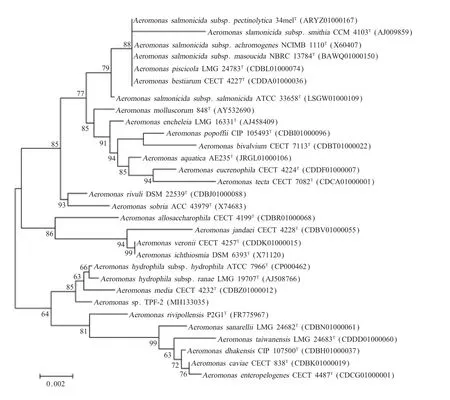
图3 分离菌的形态学基于16S rRNA基因序列的系统发育树、(邻近法)Fig.3 Neighbour-joining phylogenetic tree based on 16S rRNA gene sequences of strain TPF-2

表1 分离菌生理生化鉴定结果(GN卡)Table 1 Identification of the isolate by API automatic Microbial Identification System(GN card)
3 讨论
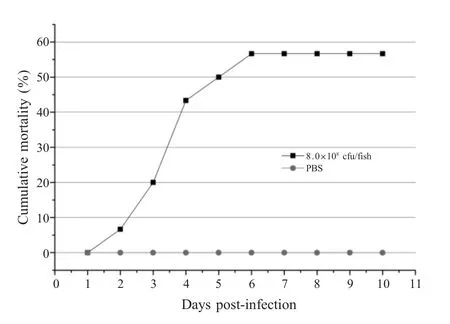
图4 菌株TPF-2的人工感染试验Fig.4 Pathogenicity test of the isolate in fish by artificial infection
澳洲龙纹斑是一种大型肉食性鱼类,原产于澳大利亚墨瑞河(Murray-Darling)流域,由于过度捕捞,河道治理以及生境退化等原因,现澳洲龙纹斑在国际自然保护联盟濒危物种红色名录中,被列为极度濒危(IUCN 2.3)物种,排名前于中国大熊猫。随着澳洲龙纹斑野外种群数量急剧下降,人工养殖已经成为物种延续最为重要的途径。澳洲龙纹斑被引入国内之后,先后取得了人工繁育、规模化培育技术、高密度工厂化养殖技术等的突破,人工种群蓄养形成了一定的规模。对开展澳洲龙纹斑规模化养殖,增加人们的健康营养的餐桌食品以及物种延续具有重要意义。然而在澳洲龙纹斑人工养殖的过程中,存在养殖密度大、人工饵料营养不平衡、饵料中致病菌等影响因素。由于澳洲龙纹斑在国内人工养殖历史较短,对其细菌性病害的研究尚未见报道。本研究从患病澳洲龙纹斑病灶组织中分离到一株优势菌,可复制与其自然发病相似的症状,死亡率为56.7%,且从人工感染患病的澳洲龙纹斑病灶中再次分离到相同的病原菌,证实其为导致澳洲龙纹斑发病的病原菌。经过形态学观察、生理生化特征以及16S rRNA基因序列分析,确定该菌株为嗜水气单胞菌。
嗜水气单胞菌的致病范围极其广泛,可以感染淡水鱼类、蛙类、鳖类及包括人在内的多种哺乳动物[6-7]。被感染的淡水鱼类由于种类不同临床表现也略有不同,例如鲟鱼出现眼周、硬鳞基部等体表出血,肝脏、肾脏等实质性器官出现不同程度的出血、充血[8-9];罗非鱼病鱼鱼体发黑,体侧部分鳞片脱落,背部及尾部鳍条腐烂,肝脏充血糜烂[10];团头鲂病鱼体表出血,肝脏和胆囊肿大,体腔伴有黄色粘液[11]。受感染的中华鳖可发生红脖子病、白底病、腐皮病等多种细菌性疾病[12]。人类感染食源性嗜水气单胞菌出现腹痛、腹泻,并伴有呕吐等症状[13]。本研究中患病澳洲龙纹斑肝脏、肾脏等多个器官出现肿大充血等症状,与嗜水气单胞菌引起的水产动物疾病症状相近,充血后导致器官功能发生障碍,这可能是引起病鱼死亡的主要原因。菌株TPF-2具有溶血现象,可能含有相关的溶血毒素,与观察到的症状相符。

表2 菌株TPF-2对药物敏感性试验结果Table 2 Antibiotic susceptibility test of the strain TPF-2
有效、合理使用抗生素是防治鱼类细菌性疾病的重要措施之一。药敏试验显示,菌株TPF-2对先锋必素、菌必治、硫酸锌霉素、氟苯尼考、诺氟沙星、恩诺沙星6种药物敏感,与夏飞[11]等对团头鲂分离的嗜水气单胞菌药敏结果相似。但对四环素类、除复方新诺明外的多种磺胺类、多粘菌素、青霉素等抗生素耐药,表现出多重耐药性。对四环素类及除复方新诺明外的多种磺胺类耐药与隋慧[14]等报道的嗜水气单胞菌对四环素类和磺胺类药物敏感不相符,表明其对四环素类及磺胺类药物产生了明显的耐药性。造成该现象的原因包括两方面,一方面可能是在养殖过程中长期或大量使用该类药物所造成的耐药,另一方面是该菌株对这些药物本身就耐药[15];同时,产生药敏差异也可能是由于不同区域、不同水域环境中的菌株受不同药物环境作用影响而产生耐药性变异[16],因此在实际生产中要使用敏感性抗菌药物进行治疗,预防耐药性菌株的产生,同时积极改善养殖水体环境,增强鱼体抵抗力。
澳洲龙纹斑作为新兴产业刚刚起步,还未见关于其感染嗜水气单胞菌的报道,但随着工厂化养殖的发展,其养殖过程中产生的发病也呈不断上升趋势,主要疾病的发现及防治已成为产业发展的关键。本研究为澳洲龙纹斑嗜水气单胞菌病害的防治和其高密度循环水健康养殖产业化奠定了基础。

