巴伦葛兹类芽孢杆菌β-葡萄糖苷酶的表达、酶学性质及结构解析
黄 平, 吴世旺, 江正强, 杨绍青
(中国农业大学 食品科学与营养工程学院, 北京 100083)
纤维素是由β-D-葡萄糖残基通过β-1,4-糖苷键连接而成的直链多糖,一般含有3 000~10 000个葡萄糖残基。通常将能水解裂纤维素的β-1,4-糖苷键的酶称为纤维素酶。纤维素酶按其催化作用特点分为三类:内切-1,4-β-D-葡聚糖酶(EC 3.2.1.4)、外切-β-1,4-D-葡聚糖酶(EC 3.4.1.91)、β-葡萄糖苷酶(EC 3.2.1.21)。内切-β-1,4-D-葡聚糖酶也称为内切葡聚糖酶、内切-1,4-β-葡聚糖酶,在纤维素的内部无定形位点随机切割β-1,4-糖苷键,产生各种长度的低聚糖;外切-β-1,4-葡聚糖酶也称外切葡聚糖酶、外切纤维二糖水解酶、1,4-β-纤维二糖水解酶,水解纤维素或纤维四糖的β-1,4-糖苷键,从非还原性末端依次切下纤维二糖分子;β-葡萄糖苷酶也称龙胆二糖酶、纤维二糖酶、苦杏仁酶,可以将纤维二糖等纤维寡糖末端非还原端的β-D-葡萄糖残基水解,释放β-D-葡萄糖[1]。若将纤维素降解成最终产物β-D-葡萄糖,至少需要3种纤维素酶的共同作用。内切葡聚糖酶作用于纤维素的非结晶区,通过外切葡聚糖酶将其水解成纤维二糖和三糖,最后通过β-葡萄糖苷酶将纤维二糖水解成β-D-葡萄糖。纤维二糖是内切酶和外切酶的抑制剂,通过加入β-葡萄糖苷酶可以有效降低抑制作用,提高纤维素降解率。
本研究克隆了巴伦葛兹类芽孢杆菌(Paenibacillusbarengoltzii) CAU904 GH3家族的β-葡萄糖苷酶基因并在大肠杆菌中表达,研究了重组β-葡萄糖苷酶(PbBglu3)的酶学性质,进一步解析了其晶体结构,初步阐明了其催化机制,希望为后续该酶的理性设计提供一定的理论基础。
1 材料与方法
1.1 主要试剂和材料
ExTaq DNA Polymerase、PrimeSTAR HS DNA polymerase、限制性内切酶、低分子量标准蛋白质、DNA Marker、PrimeScript Reverse Transcriptase(RNase H-),购自TaKaRa公司;T4 DNA ligase,购自NEB公司;琼脂糖凝胶纯化回收试剂盒,购自北京博迈德公司;高纯质粒小量制备试剂盒,购自北京天根生化公司;Ni-IDA agarose,购自GE公司;薄层层析Gel Plate F254,购自Merck公司;大麦β-葡聚糖、地衣多糖、昆布多糖、桦木木聚糖、微晶纤维素、CMC、pNP-β-Xylopyranoside、pNP-α-Galactopyranoside、pNP-β-Galactopyranoside、pNP-β-Glucopyranoside、 pNP-α- Glucopyranoside,购自Sigma公司;纤维寡糖、昆布寡糖,购自Megazyme公司;结晶筛选试剂盒,购自Hampton公司。
巴伦葛兹类芽孢杆菌CAU904为本实验室筛选保藏;大肠杆菌(Escherichiacoli)DH5α、BL21(DE3),购自北京博迈德公司;pET-28a(+),购自Novagen公司。
1.2 实验方法
1.2.1菌株培养和基因组DNA的提取
斜面培养基上活化的单菌落接入液体培养基,45 ℃摇瓶培养3 d,离心收集适量菌体(12 000 r/min,3 min)。基因组DNA 的提取采用CTAB法。
1.2.2β-葡萄糖苷酶基因克隆
根据巴伦葛兹类芽孢杆菌基因组(NZ_KE159654.1)中β-葡萄糖苷酶基因序列和表达载体pET-28a(+)的多克隆位点,设计正向引物BgluF:5’-TGACTGCTAGCATGAGCAAATCGATGTTAGGTG TT-3’(下划线处为NheⅠ酶切位点);反向引物BgluR:5’-TGACTCTCGAGTTAAA TAAACTCGATCCACTCAATCTCC-3’ (下划线处为XhoⅠ酶切位点)。以基因组DNA为模板,PCR条件为94 ℃ 5 min; 94 ℃ 30 s;55 ℃ 30 s ;72 ℃ 3 min,34个循环后72 ℃延伸10 min。经1%琼脂糖凝胶电泳检测并回收PCR产物。将目的片段连接至pMD-19T载体,热激转化E.coliDH5α,筛选阳性菌落,提取T/A克隆质粒,经酶切鉴定后,测序验证。将测序正确的重组质粒用NheⅠ和XhoⅠ酶切后,回收目的片段,连接至pET-28a(+)载体,转化E.coliBL21,在含卡那霉素(50 μg/mL)的LB平板筛选阳性转化子。
1.2.3PbBglu3的诱导表达及纯化
挑取阳性转化子于10 mL LB(含50 μg/mL卡那霉素)培养基中,37 ℃振荡培养至对数生长期。以体积分数1%的接种量转接到300 mL相同培养基中,37 ℃振荡培养至OD600达到0.6~0.8时,加入终浓度为1 mmol/L的IPTG,16 ℃诱导培养20 h后,离心收集菌体。菌体用20 mL的缓冲液A(20 mmol/L Tris-HCl,500 mmol/L NaCl,20 mmol/L咪唑)悬浮,超声破碎(200 W,破碎3 s,间歇4 s,破碎90次)3个循环。将破碎后的菌体离心(10 000 r/min,10 min),收集上清液,即粗酶液。
PbBglu3采用Ni-IDA亲和层析进行纯化,将粗酶液以0.5 mL/min流速上样于经过缓冲液A预平衡的Ni-IDA层析柱。用缓冲液A以1 mL/min洗涤柱子至流穿液OD280小于0.05时,用缓冲液B液(20 mmol/L Tris-HCl,500 mmol/L NaCl,50 mmol/L咪唑,pH值8.0)进行洗脱,SDS-PAGE检测蛋白质纯度。
1.2.4酶活力和蛋白浓度测定
酶活力测定:75 μL 15 mmol/L底物pNPG(蒸馏水配制),加150 μL MOPS(morpholino propanesulfonic acid)(pH值6.5~8.0)缓冲液(50 mmol/L,pH值7.5),50 ℃预热4 min后,加入25 μL适当稀释的酶液,50 ℃反应10 min,加750 μL的饱和硼酸钠溶液终止反应,冷却后测定OD405。
1个酶活力单位(U)定义:在实验条件下,每分钟生成的1 μmol pNP所需要的酶量。
蛋白含量的测定采用Lowry法,以牛血清白蛋白作为标准蛋白绘制标准曲线。
1.2.5PbBglu3的最适pH值和pH值稳定性测定
最适pH值测定:50 ℃条件下,在pH值4.0~10.5的不同缓冲体系中测定酶活力。缓冲体系分别为Citrate(pH值4.0~6.0)、Acetate(pH值4.0~4.5)、Bis-Tris(bis-(2-hydroxyethyl)amino-tris(hydroxymethyl) methane)(pH值5.5~7.5)、MOPS、HEPES(z-[4-(2-hydroxyethyl)-1-piperazinyl]ethanesulfonic acid)(pH值6.5~8.5)、Tris-HCl(pH值7.0~9.0)、CHES(N-cyclohexyl-2-aminoethanesulfonic acid)(pH值8~10.5),以酶活力最高点为100%。pH值稳定性测定是用不同缓冲体系将纯酶稀释适当倍数,50 ℃保温30 min,冰水浴中冷却30 min后, 按照标准方法测定残余酶活力,以未经处理的酶液为对照,计算残余酶活力占对照酶活力的百分比。
1.2.6PbBglu3的最适温度及温度稳定性测定
最适温度的测定是以50 mmol/L,pH值7.5 MOPS缓冲液将PbBglu3稀释适当倍数后,分别在不同温度下(30~80 ℃)测定酶活力,以酶活力最高点为100%。温度稳定性的测定是用同样的缓冲液将PbBglu3稀释适当倍数后,分别置于不同温度下处理30 min,冰水浴冷却30 min后,按照标准方法测定残余酶活力,以未经处理的酶液为对照,计算残余酶活力占对照酶活力的百分比。
1.2.7PbBglu3底物特异性测定
PbBglu3的底物特异性测定是以pNP-糖苷(pNP-α-D-galactoopyranoside、pNP-β-D-galactoopyranoside、 pNP-α-D-glucopyranoside、pNP-β-D-glucopyranoside、pNP-β-D-xylopyranoside)、低聚糖及糖苷类化合物(纤维寡糖、昆布寡糖、龙胆二糖、槐糖、乳糖、苦杏仁苷和水杨苷)和聚糖(桦木木聚糖、昆布多糖、地衣多糖、大麦葡聚糖、几丁质、羧甲基纤维素钠和结晶纤维素)为反应底物测定酶活力。酶活力测定方法为225 μL 5 mmol/L pNP-糖苷类底物,或10 mg/mL低聚糖及糖苷类化合物底物,或10 mg/mL聚糖类底物(均用50 mmol/L,pH值7.5 MOPS缓冲液配制),50 ℃预热4 min后,加入25 μL适当稀释的酶液,50 ℃反应10 min,加750 μL的饱和硼酸钠溶液终止反应,冷却后分别测定OD410、葡萄糖(使用葡萄糖氧化酶试剂盒测定)和还原糖(采用DNS法)。对于纤维二糖、龙胆二糖、昆布二糖和槐糖等二糖,1个酶活力单位(U)为,在测定条件下每分钟生成的2 μmol葡萄糖所需的酶量。
1.2.8PbBglu3的水解特性测定
采用TLC(薄层层析法)对PbBglu3水解纤维寡糖、昆布寡糖和昆布多糖生成的水解产物进行分析。在10 mg/mL水解底物 (用50 mmol/L,pH值7.5 MOPS缓冲液配制)中加入5 U/mL的PbBglu3,50 ℃反应2 h,定时取样,沸水浴煮沸5 min,终止反应。冷却后离心取上清液分析水解情况,展层剂为正丁醇∶水∶乙酸,三者体积比为2∶1∶1;显色剂为甲醇∶硫酸,体积比为95∶5。
1.2.9PbBglu3的晶体筛选及结构解析
PbBglu3结晶初筛质量浓度为18 mg/mL,缓冲液为20 mmol/L Tris-HCl,100 mmol/L NaCl,pH值8.0。结晶试剂盒为Hampton Research公司的Crystal ScreenTM、IndexTM、PEG/IonTM和SaltRxTM以及北京博亚结晶公司的BCR。采用坐滴气相扩散法进行结晶条件筛选和优化。
于上海同步辐射光源生物大分子线站收集X-射线衍射数据,使用HKL2000软件对数据进行前期处理。以Thermotoganeapolitana来源的GH3家族β-葡萄糖苷酶TnBgl3B(PDB:2X40)为模板[2],利用Phenix软件包进行分子置换[3],得到PbBglu3初始结构。经Phenix.autobuilding重建,多轮COOT[4]手工调整与Phenix.Refine精修完善后获得最终的结构模型。
2 结果与讨论
2.1 β-葡萄糖苷酶基因的克隆和表达结果分析
利用引物BgluF和BgluR,扩增得到一条2 799 bp的片段。该基因编码932个氨基酸,预测无信号肽序列及理论分子量和等电点分别为102.2 kDa和5.02。经NCBI BLAST比对分析,该酶的氨基酸序列与来源于坎氏弧菌(Vibriocampbellii)的GH3家族β-葡萄糖苷酶(AJK27091.1)相似性最高,为59%。结构域分析显示,该PbBglu3含有GH3家族的特征结构域、一个FnⅢ型纤连蛋白结构域和一个CBM6结构域。
将该基因插入到pET-28a(+)载体NheⅠ和XhoⅠ酶切位点之间,构建重组表达载体pET28-PbBglu3。重组载体转化入E.coilBL21(DE3)进行IPTG诱导表达,经SDS-PAGE检测能够可溶性表达。
2.2 PbBglu3的纯化结果分析
粗酶液经亲和层析得到电泳级纯酶,PbBglu3纯化结果见表1。由表1可知,PbBglu3纯化了15.9倍,回收率为57%,比酶活力为119.6 U/mg。该酶的比酶活力高于来源于AspergillusochraceusMTCC 1810[5](4.60 U/mg)、Aspergillusterreus[6](42.37 U/mg)、AspergillusfumigatusZ5[7](101.7 U/mg)和Myceliophthorathermophila[8](97.7 U/mg)的β-葡萄糖苷酶的比酶活力,但低于来源于ThermotoganaphthophilaRUK-10[9](2 851.7 U/mg)、TalaromycesleycettanusJCM 12802[10](905 U/mg)、PenicilliumpurpurogenumKJS506[11](857 U/mg)和Neurosporacrassa[12](143.27 U/mg)的β-葡萄糖苷酶的比酶活力。

表1 PbBglu3纯化结果
2.3 pH值对PbBglu3酶活力和稳定性的影响
pH值对PbBglu3的酶活力和稳定性影响结果见图1。图1(a)中,PbBglu3的最适pH值为7.5,在pH值4.5~9.0范围内处理30 min,可以保持80%以上的酶活力(图1(b)),表现出良好的pH值稳定性。大多β-葡萄糖苷酶的最适pH值偏酸性,而本研究中β-葡萄糖苷酶与Paenibacillussp. C7[13]和Bacillussp.[14]的β-葡萄糖苷酶特性相似,具有偏碱性的最适pH值。这一特性使其在洗涤剂、化妆品和酿酒等行业中具有潜在应用价值。
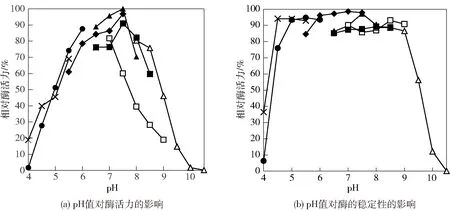
柠檬酸缓冲液(●),乙酸缓冲液(×),Bis-Tris缓冲液(◆),MOPS缓冲液(▲),Tris-HCl 缓冲液(□),HEPES缓冲液(■),CHES缓冲液(△)。图1 pH值与PbBglu3的酶活力及稳定性的关系Fig.1 Effect of pH on activity and stability of PbBglu3
2.4 温度对PbBglu3酶活力和稳定性的影响
温度对PbBglu3酶活力和稳定性影响结果见图2。图2(a)中,PbBglu3的最适温度为50 ℃。在温度不高于50 ℃条件下均很稳定,残余酶活在95%以上,当温度高于50 ℃时酶活力迅速下降(图2(b))。大多β-葡萄糖苷酶的最适温度和温度稳定性普遍在40~100 ℃。该酶的最适温度与来源于MucorcircinelloidesNBRC 4572的β-葡萄糖苷酶(50 ℃)一致[15],但是显著低于Thermofilumpendensβ-葡萄糖苷酶(90 ℃)[16]。PbBglu3的最适温度处于中等水平,温度稳定性并不突出。
2.5 PbBglu3的底物特异性分析
PbBglu3底物特异性分析结果见表2。表2表明,对于pNP糖苷类底物,PbBglu3对pNP-β-D-glucopyranoside表现出很高的活性,同时对pNP-β-D-xylopyranoside有较弱的水解活性,但对pNP-α-D-glucopyranoside、pNP-α-D-galactopyranoside和pNP-β-D-galactopyranoside没有水解活性。对于低聚糖及糖苷类化合物底物,该酶对纤维二糖(β-1,4-糖苷键连接)、纤维三糖(β-1,4-糖苷键连接)、纤维四糖(β-1,4-糖苷键连接)、昆布二糖(β-1,3-糖苷键连接)、昆布三糖(β-1,3-糖苷键连接)、龙胆二糖(β-1,6-糖苷键连接)、槐糖(β-1,2-糖苷键连接)、苦杏仁苷(β-1,6-糖苷键连接)和水杨苷(β-1,4-糖苷键连接)均具有活性,但没有乳糖水解活性。对于聚糖类底物,该酶对昆布多糖、大麦葡聚糖和地衣多糖均具有一定的水解活性,对木聚糖、几丁质、羧甲基纤维素钠和结晶纤维素没有水解活性。大麦葡聚糖是由纤维三糖或纤维四糖通过β-1,3-糖苷键连接成的分支多糖,地衣多糖是由纤维三糖分子以β-1,3-糖苷键连接成的直链多糖,而昆布多糖则是通过β-1,3和β-1,6-糖苷键连接形成的分支多糖。由此可知,PbBglu3能够作用于β-1,2、β-1,3、β-1,4和β-1,6等多种糖苷键,因此PbBglu3属于第三类底物特异性较宽的β-葡萄糖苷酶。
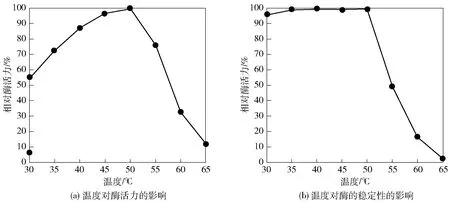
图2 温度与PbBglu3的酶活力及稳定性的关系Fig.2 Effect of temperature on activity and stability of PbBglu3
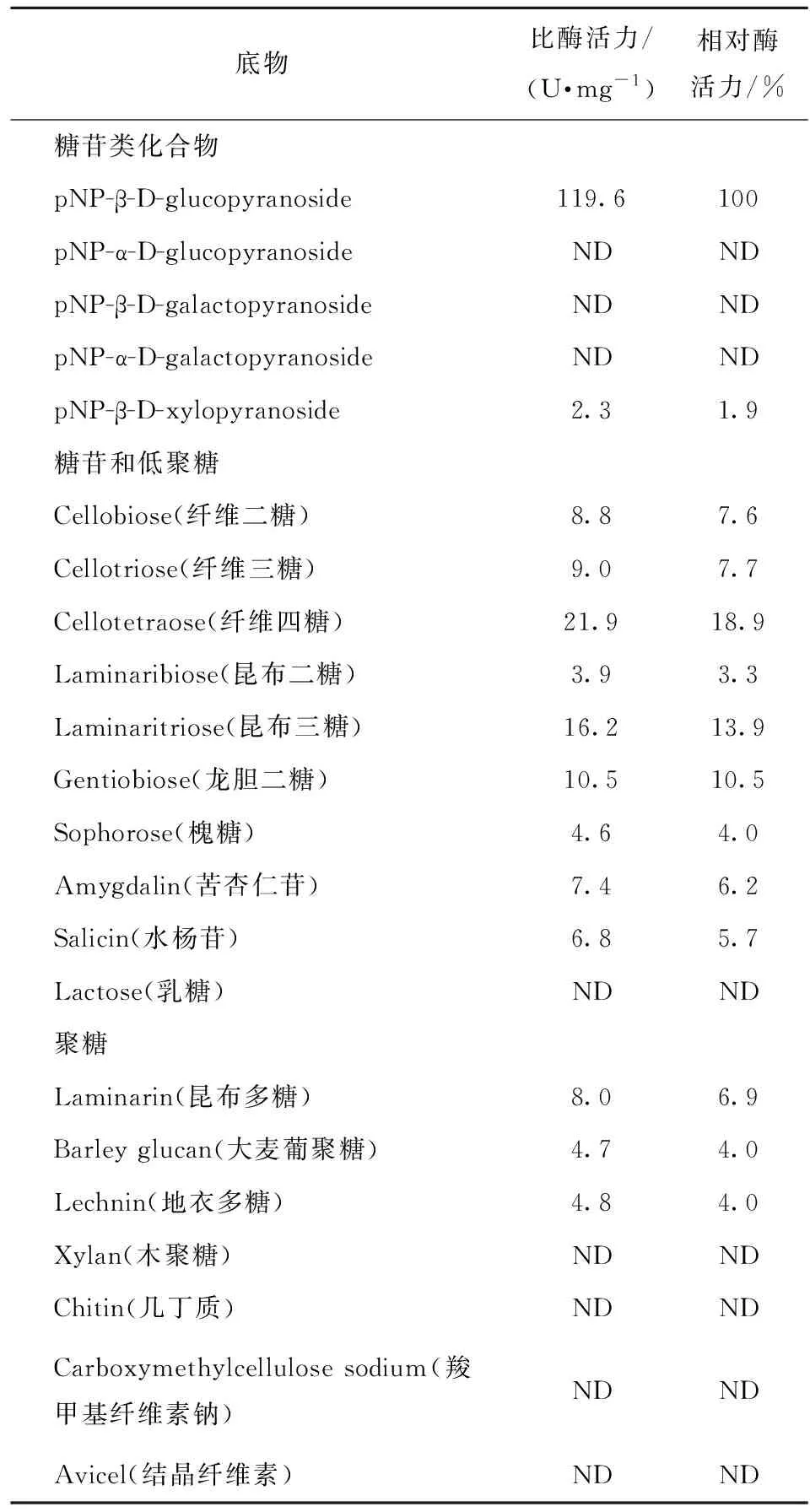
底物比酶活力/(U·mg-1)相对酶活力/%糖苷类化合物pNP-β-D-glucopyranoside119.6100pNP-α-D-glucopyranosideNDNDpNP-β-D-galactopyranosideNDNDpNP-α-D-galactopyranosideNDNDpNP-β-D-xylopyranoside2.31.9糖苷和低聚糖Cellobiose(纤维二糖)8.87.6Cellotriose(纤维三糖)9.07.7Cellotetraose(纤维四糖)21.918.9Laminaribiose(昆布二糖)3.93.3Laminaritriose(昆布三糖)16.213.9Gentiobiose(龙胆二糖)10.510.5Sophorose(槐糖)4.64.0Amygdalin(苦杏仁苷)7.46.2Salicin(水杨苷)6.85.7Lactose(乳糖)NDND聚糖Laminarin(昆布多糖)8.06.9Barley glucan(大麦葡聚糖)4.74.0Lechnin(地衣多糖)4.84.0Xylan(木聚糖)NDNDChitin(几丁质)NDNDCarboxymethylcellulose sodium(羧甲基纤维素钠)NDNDAvicel(结晶纤维素)NDND
2.6 PbBglu3的水解特性分析
PbBglu3水解特性分析结果见图3。图3表明,PbBglu3对纤维寡糖(聚合度2- 4)、昆布寡糖(聚合度2- 4)、地衣多糖、大麦葡聚糖和昆布多糖的最终产物都是葡萄糖。PbBglu3水解多糖的过程中只有单糖生成,说明其具有外切β-1,3-葡聚糖酶和β-1,3-1,4-葡聚糖酶的活性。
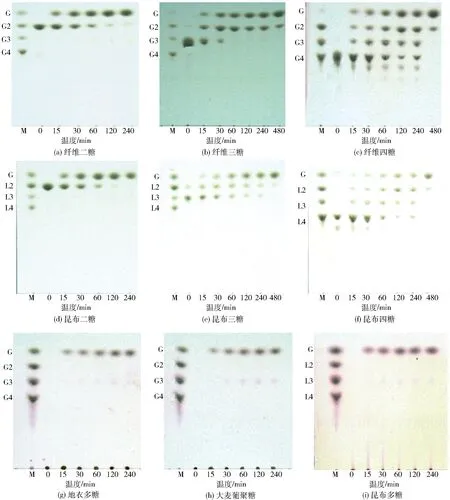
M:标准;G:葡萄糖;G2:纤维二糖;G3:纤维三糖;G4:纤维四糖;L2:昆布二糖;L3:昆布三糖;L4:昆布四糖。图3 PbBglu3水解产物分析Fig.3 TLC analysis of hydrolysis products by PbBglu3
2.7 PbBglu3的晶体结构分析
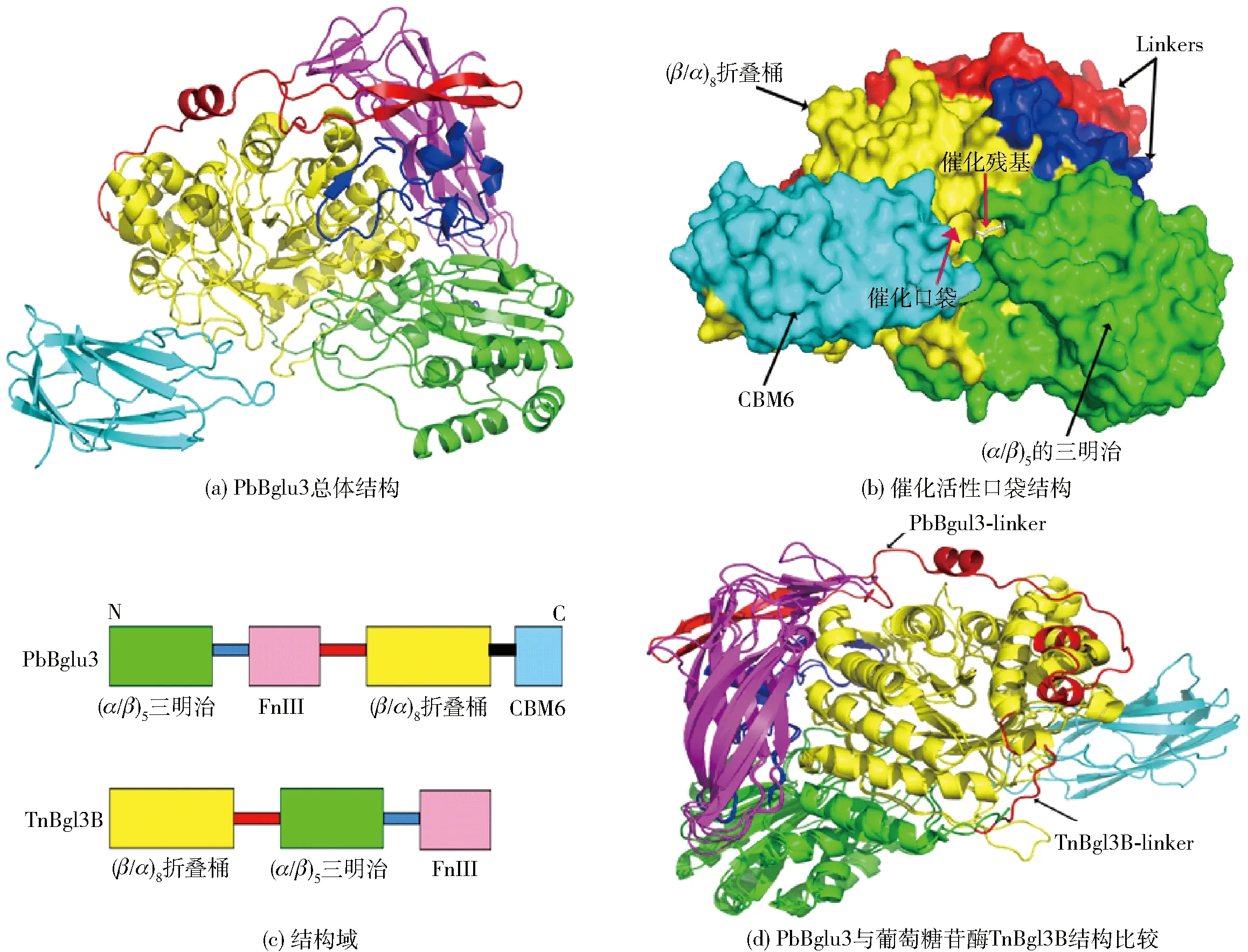
图4 PbBglu3的总体结构、结构域分析及其比较Fig.4 Analysis of overal structure and structure domain of PbBglu3, and structure comparison with other β-glucosidase
PbBglu3晶体结构解析结果见图4。PbBglu3晶体空间群为P212121,衍射数据最终分辨率为1.73 Å。 PbBglu3的总体结构如图4(a)。图4(a)中,每个不对称单元(ASU)中含有一个蛋白分子,呈现GH3家族典型的多结构域结构,类似 (α/β)5的三明治结构域、FnⅢ结构域、(β/α)8折叠桶结构域和CBM6结构域。该酶的结合位点位于折叠桶结构域和三明治结构域的中间,其催化氨基酸E168和D747分别位于这两个结构域。该酶形成一个催化口袋(图4(b)),能够特异性地结合糖链的非还原端。与GH3家族的另一个结构已经解析的β-葡萄糖苷酶TnBgl3B[2]不同的是,该酶的(β/α)8折叠桶结构域被移到了C端,紧接着CBM6结构域(图4(c))。该CBM6结构域的存在对底物的结合具有一定的影响,它们的空间相对位置依然保守,只是形成了一段较大的linker,由两个反向平行的β-折叠卷构成(图4(d))。相对于其他β-葡萄糖苷酶较短的linker,该酶在此对应区域具有较大的柔性,有利于酶催化过程中(α/β)5的三明治结构域和FnⅢ结构域之间发生移动,使酶能够与底物更好结合在一起。分析发现,芳香氨基酸残基Trp748侧链提供-1位结合位点,Trp749提供+1位结合位点,Trp131提供+2位结合位点,这些位点的存在形成了一个小的口袋和疏水环境,不利于转糖苷反应的进行,这在结构上也解释了PbBglu3转糖苷作用弱的原因。
3 结 论
从巴伦葛兹类芽孢杆菌CAU904中克隆表达得到一个GH3家族β-葡萄糖苷酶(PbBglu3),该酶与来源于VibriocampbelliiGH3家族β-葡萄糖苷酶的同源性最高,为59%。PbBglu3的最适pH值为7.5,最适温度为50 ℃。该酶具有较宽的底物特异性范围,能够水解β-1,2、β-1,3、β-1,4、β-1,6-糖苷键等多种类型糖苷键。PbBglu3还能够水解昆布多糖、大麦β-葡聚糖和地衣多糖,产物均为β-D-葡萄糖。通过X-射线晶体衍射法解析了PbBglu3的晶体结构,结构信息显示其含有4个结构域,同时解释了该酶转糖苷作用弱的结构基础。

