戊糖片球菌表面蛋白性质及抑菌作用研究
孙艳菲, 陈 瑞,2, 王 露, 江 睿, 邓 淳, 胡 源,2, 饶胜其,2,*
(1.扬州大学 食品科学与工程学院, 江苏 扬州 225127;2.江苏省乳品生物技术与安全控制重点实验室, 江苏 扬州 225127)
益生菌(probiotics)又称微生态调节剂、活菌制剂,是一类能够对宿主生理功能产生有益作用的活性微生物,具有调节肠道微生态、改善肠道内环境、调节肠道菌群、抑制致病性菌等作用,主要包括双歧杆菌、乳酸菌和酵母菌[1-2]。戊糖片球菌(Pediococcuspentosaceus)隶属链球菌科片球菌属,为革兰氏阳性菌,因其能发酵葡萄糖产生乳酸而属于乳酸菌的一种。戊糖片球菌广泛分布于泡菜、干酪、香肠等传统发酵食品中,对提高发酵食品的风味、营养及安全性具有重要作用,同时具有免疫调节、促进健康以及抵抗病原菌侵袭等多种益生功能[3-4]。
乳酸菌的多种益生功能与其表面活性因子的存在密不可分。黏附是乳酸菌发挥益生作用的第一步,乳酸菌依靠其表面的蛋白、多糖等黏附宿主肠上皮细胞并定植,分泌代谢产物等,进而发挥抑制致病菌黏附和抑制致病菌生长等重要生理作用。在乳酸菌表面的众多黏附因子当中,乳酸菌表面蛋白是其主要黏附因子,与黏附相关的表面蛋白主要包括s-层蛋白、引物酶Sortase依赖蛋白、黏膜结合蛋白、黏附胞外间质的表面蛋白等[5-6]。目前有关乳酸菌表面蛋白的结构与功能研究主要集中在乳酸杆菌中,包括罗伊氏乳杆菌的黏液结合蛋白(Mub)[7]、卷曲乳杆菌的胶原结合表层蛋白(CbsA)[8]和S-层蛋白(Slp B)[9]、植物乳杆菌NL42 的细胞壁固定蛋白(CwaA)[10]等, 而有关乳酸球菌表面蛋白的研究报道相对较少。
本研究室前期从臭豆腐发酵卤水中筛选到一株高黏附性戊糖片球菌F28-8,为进一步探究其益生功能,通过LiCl提取其表面蛋白,研究其对菌株表面性质的影响;同时研究其对沙门氏菌和金黄色葡萄球菌黏附胶原蛋白的抑制作用以及抑菌作用,希望为戊糖片球菌及其表面蛋白在食品、生物和医药领域的实际应用提供信息参考。
1 实验部分
1.1 材料与试剂
P.pentosaceusF28-8,扬州大学食品科学与工程学院食品微生物实验室专利保藏菌株(中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.9956);StaphylococcusaureusCICC 21600、Salmonellaentericasubsp. CICC 21513(低毒力),购置于中国工业微生物菌种保藏管理中心。
LB液体培养基的配制:胰蛋白胨10 g·L-1、酵母提取物5 g·L-1、氯化钠10 g·L-1、蒸馏水1 L,121 ℃湿热灭菌15 min。
1.2 仪器与设备
SX-500型高压蒸汽灭菌锅,日本Tommy公司;Tecnai-12型透射电镜,荷兰Phlilps公司;ALPHAI-2LD PLUS型冷冻干燥机,德国 Christ 公司;5800型超高分辨飞行时间生物质谱仪,美国 AB SCIEX公司。
1.3 实验方法
1.3.1菌株活化
取-20 ℃甘油管保存的戊糖片球菌按体积分数2%的接种量接种于MRS液体培养基中,37 ℃恒温培养20 h后,再按2%的接种量活化于MRS液体培养基中,37 ℃恒温培养20 h,备用。
取-20 ℃甘油管保存的金黄色葡萄球菌和沙门氏菌按体积分数2%的接种量接种于LB液体培养基中,37 ℃恒温摇床培养14 h后,再按2%的接种量活化于LB 液体培养基中,37 ℃恒温摇床培养14 h,备用。
1.3.2戊糖片球菌的生长及产酸能力测定
以2%接种量取-70 ℃甘油贮存液接种于MRS培养基中,37 ℃恒温培养24 h,每隔2 h测其OD600值与pH值并绘制生长情况与产酸能力曲线图。
1.3.3戊糖片球菌表面蛋白的提取与分析
表面蛋白提取方法参考Johnson-Henry等[11]的研究并稍作修改。菌株接种MRS培养基,37 ℃恒温培养18 h,8 000 r/min离心收集菌体,PBS洗涤2次离心。对照组将菌体重悬于PBS(phosphate buffered saline),处理组菌体加5 mol/L,LiCl 37 ℃作用0.5 h,离心(8 000 r/min,15 min) ,弃上清液,4 mol/L盐酸胍溶液重悬混匀,于37 ℃恒温培养箱中处理1 h,离心(8 000 r/min,15 min),收集上清液。将上清液移入14 kDa分子截留量的透析袋中,4 ℃去离子水中透析48 h后,离心(12 000r/min,15 min)取上清液,即为戊糖片球菌表面蛋白。
将LiCl处理前后的菌体重悬于PBS,分别滴至专用铜网上,自然晾干10 min后,滴加体积分数为2%的磷钨酸染色2 min,滤纸吸除多余染液,用灯烘干。将样品装入样品台,放入样品室进行透射电子显微镜(TEM)观察。同时将LiCl提取物采用12%分离胶的SDS-PAGE进行电泳分析。将电泳胶上的条带进行割胶后,采用PBS洗净,经胰蛋白酶酶解后进行MALDI-TOF-MS质谱分析,并应用MASCOT软件搜索NCBI数据库以获得蛋白信息。
1.3.4戊糖片球菌表面性质测定
1.3.4.1 表面疏水性测定
参考Rahman等[12]的方法并加以适当修改。采用0.1 mol/L KNO3溶液(pH值6.2)调整戊糖片球菌悬液菌体浓度至约108CFU/mL,记录其OD600值为A0。取1 mL二甲苯加到3 mL戊糖片球菌悬液中,室温静置10 min后振荡2 min,再静置20 min。取水相测定其OD600值记为A1,KNO3溶液为空白对照。表面疏水率计算公式为(1-A1/A0)×100%,公式中A1代表二甲苯处理后戊糖片球菌悬液在600 nm波长下的吸光值,A0代表二甲苯处理前戊糖片球菌悬液在600 nm波长下的吸光值。对照组为未经LiCl处理的乳杆菌,处理组为经过LiCl处理的乳杆菌。
1.3.4.2 自动聚集能力测定
参考杨振泉等[4]的方法加以适当修改。戊糖片球菌悬液用PBS调整菌体浓度至约108CFU/mL。菌悬液混匀10 s后,记录其OD600为A0。室温静置4 h,取上清液测定其OD600为A4,PBS溶液作为空白对照。自动聚集率计算公式为(1-A4/A0)×100%,公式中A4代表戊糖片球菌菌悬液静置4 h后在600 nm波长下的吸光值,A0代表初始戊糖片球菌悬液在600 nm波长下吸光值。对照组为未经LiCl处理的乳杆菌,处理组为经过LiCl处理的乳杆菌。
1.3.4.3 表面电荷测定
表面电荷测定,参考Kos等[13]的研究方法,稍作修改。取1 mL三氯甲烷或乙酸乙酯加到3 mL戊糖片球菌悬液中,室温静置10 min后振荡2 min,再静置20 min。取水相测定其OD600值记为A1, KNO3溶液为空白对照。溶剂吸附率计算公式为(1-A1/A0)×100%。公式中A1代表三氯甲烷或乙酸乙酯处理后的菌悬液在600 nm波长下的吸光值,A0代表三氯甲烷或乙酸乙酯处理前菌悬液在600 nm波长下的吸光值。对照组为未经LiCl处理的乳杆菌,处理组为经过LiCl处理的乳杆菌。
1.3.5菌株细胞黏附能力测定
参考Horie等[14]实验方法并做适当修改。将玻片置于12孔培养板,每孔加入胶原蛋白液(25 μg/mL)2 mL,室温下包被12 h。弃去蛋白液,无菌PBS(pH值7.2)洗涤3次。分别加入2 mL1.3.3中LiCl处理前后的戊糖片球菌F28-8菌悬液(108CPU/mL),放在37 ℃培养箱孵育3 h,每组做两个复孔。弃去未黏附乳杆菌菌体后,用无菌PBS冲洗3次,用质量分数为10%甲醇固定5 min左右,用结晶紫染色2 min后洗涤脱色烘干。使用光学显微镜,于10×100倍油镜下观察,随机挑选10个视野,计算玻片表面黏附的戊糖片球菌数量并取3次实验的平均值表示菌体的黏附能力。
待胶原蛋白贴壁完全后,于培养板中加入2 mL1.3.3中提取的表面蛋白(100 μg/mL),37 ℃孵育3 h。吸掉未结合的蛋白,无菌PBS洗涤3次。加入2 mLStaphylococcusaureusCICC 21600、或Salmonellaentericasubsp. CICC 21513(108CFU/mL),放在37 ℃培养箱孵育3 h,每组做两个复孔。弃去未黏附菌体细胞后,进一步采用甲醇固定、结晶紫染色和显微镜观察,计算玻片表面黏附的菌体细胞数量。
1.3.6戊糖片球菌表面蛋白抑菌能力测定
参照Pradoacosta等[15]的研究方法加以修改。取活化好的S.aureusCICC 21600和S.entericasubsp. CICC 21513菌悬液接种入LB液体培养基中,接种量(体积分数)为2%。实验组同时加入戊糖片球菌表面蛋白(终质量浓度为10 μg/mL),而对照组只接种S.aureusCICC 21600和S.entericasubsp. CICC 21513,37 ℃摇床振荡培养10 h,每2 h测一次OD600值。绘制生长曲线图。同一培养时间,实验组的吸光度值记为AT,对照组的吸光度值记为AC,按照式(1)计算S.aureusCICC 21600和S.entericasubsp. CICC 21513的生长抑制率。
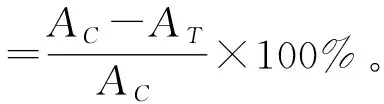
(1)
1.3.7数据统计分析
采用SPSS 13.0软件对数据进行统计分析,用Duncan’s多重分析进行组间显著性检验,显著水平为P<0.05。
2 结果与分析
2.1 戊糖片球菌的生长及产酸情况分析
将活化好的戊糖片球菌培养液接种至MRS液体培养基中,37 ℃恒温培养24 h,每2 h测一次OD600值,绘制一定培养条件下戊糖片球菌的生长曲线图,如图1。图1中,随着培养时间的增加,戊糖片球菌的生长速度逐步增快,并在4 h左右开始进入对数生长期,培养12 h后达到稳定期,生长减缓。在戊糖片球菌的适应期和对数期,培养基中的pH值一直在下降,从5.64下降到4.14,并在12 h趋于稳定。在酸性条件下仍然保持生长稳定,说明戊糖片球菌具有较强的酸适应能力,能够在较低pH值条件下存活。
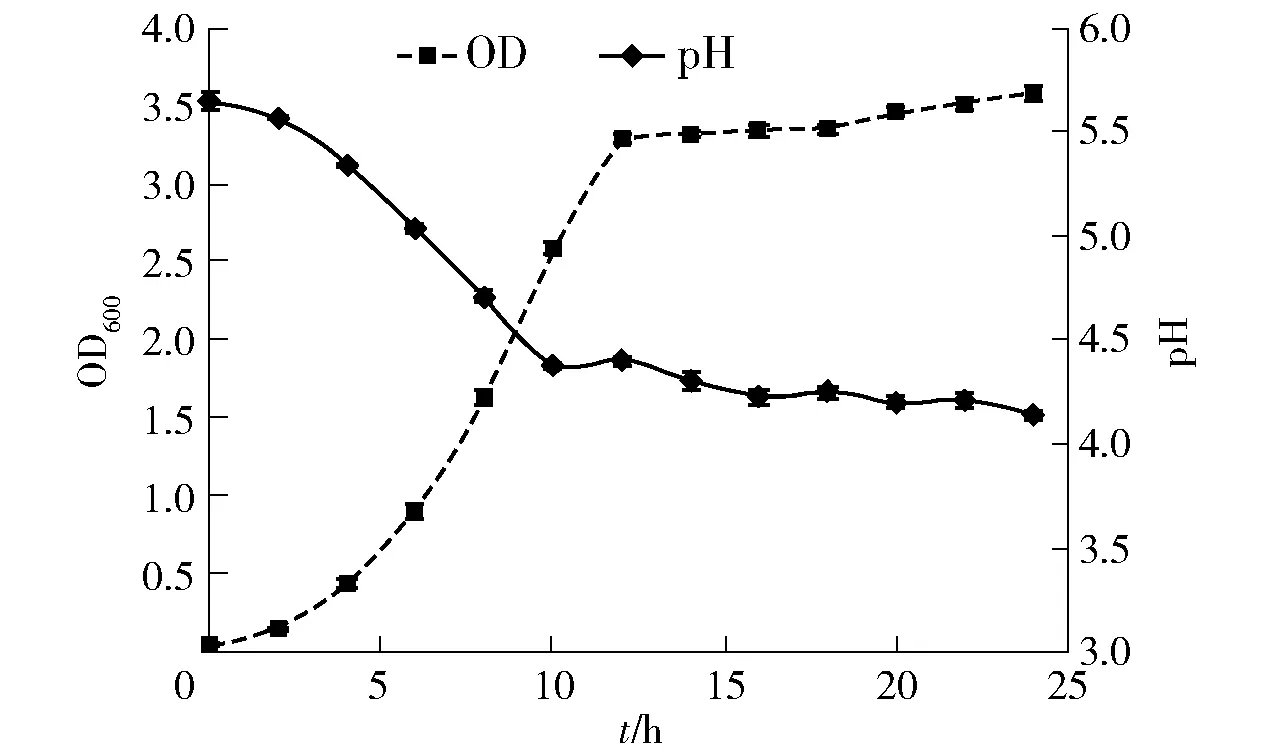
图1 P. pentosaceus F28-8的生长曲线及产酸情况Fig.1 Growth curve and acid production of P. pentosaceus F28-8
2.2 戊糖片球菌表面蛋白的提取及鉴定结果
戊糖片球菌F28-8在37 ℃恒温培养18 h后,透射电镜结果,见图2。图2(a)显示分离株的细胞形态为四联球,并存在表层结构(图2(a)),经LiCl处理之后,菌株表层基本脱落(图2(b))。对LiCl提取的表面蛋白进行了电泳分析,如图3。图3中,戊糖片球菌的LiCl提取物在分子量45~116 kDa存在主要蛋白条带a和b。
将条带a和b分别进行割胶回收,胶内酶解,利用MALDI-TOF-MS进行蛋白鉴定,条带a的一级质谱图及代表母离子1 567.79 m/z的二级质谱见图4。图4中条带b的一级质谱图及代表母离子1 868 m/z的二级质谱见图5。通过MASCOT数据库搜索比对质谱鉴定的多肽序列,结果见表1。条带a被鉴定为N-乙酰基胞壁酰-L-丙氨酸酰胺酶(N-acetylmuramoyl-L-alanine amidase),理论相对分子量为83.5 kDa。条带b被鉴定为含有LysM肽聚糖结合蛋白(LysM peptidoglycan-binding domain-containing protein),理论相对分子量为51.1 kDa。

M:标准蛋白Marker;1:戊糖片球菌表层提取物。图3 P. pentosaceus F28-8 LiCl提取物的 SDS-PAGEFig.3 SDS-PAGE of LiCl extract of P. pentosaceus F28-8

图4 P. pentosaceus F28-8表面蛋白中条带a的质谱分析Fig.4 Mass spectrometric analysis of band a in surface protein of P. pentosaceus F28-8
2.3 表面蛋白对戊糖片球菌表面性质的影响
表面蛋白对戊糖片球菌表面性质的影响见图6。

图5 P. pentosaceus F28-8表面蛋白中条带b的质谱分析Fig.5 Mass spectrometric analysis of band b in surface protein of P. pentosaceus F28-8
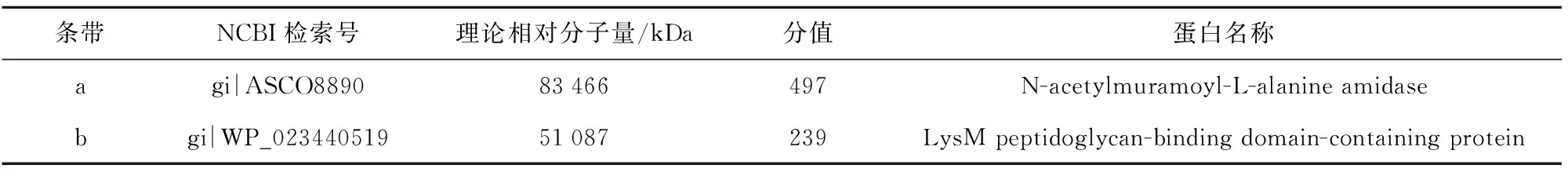
条带NCBI检索号理论相对分子量/kDa分值蛋白名称agi|ASCO889083466497N-acetylmuramoyl-L-alanine amidasebgi|WP_023440519 51087239LysM peptidoglycan-binding domain-containing protein
经LiCl处理失去表面蛋白后,戊糖片球菌的表面疏水性、自动聚集能力、表面电荷(三氯甲烷处理)和表面电荷(乙酸乙酯处理)均显著性降低,降幅分别达到34.4%、19.4%、56.1%、19.0%。由此推断,表面蛋白结构对戊糖片球菌维持表面疏水性、自动聚集能力和表面电荷起重要作用,进而可能对菌株的非特异性黏附能力产生影响。
2.4 戊糖片球菌表层提取物对黏附性的影响
鉴于2.3结果,对去除表面蛋白的戊糖片球菌与未去除表面蛋白的戊糖片球菌的黏附能力进行了研究,结果见图7。图7(a)中,相比正常戊糖片球菌,去除表面蛋白导致戊糖片球菌的黏附力显著降低,对胶原蛋白的黏附率降低了48.2%,说明表面蛋白对戊糖片球菌的黏附能力至关重要。
进一步研究了戊糖片球菌表面蛋白对S.entericasubsp. CICC 21513和S.aureusCICC 21600与胶原蛋白黏附作用的影响。图7(b)和图7(c)中,添加戊糖片球菌表面蛋白导致S.entericasubsp. CICC 21513和S.aureusCICC 21600黏附胶原蛋白的能力显著下降,黏附菌落数均有显著减少。S.entericasubsp. CICC 21513和S.aureusCICC 21600黏附菌落数分别降低了74.59%和81.16%。由此可见,戊糖片球菌的表面蛋白参与了不同菌株黏附胶原蛋白的过程,降低了致病菌的黏附性。
2.5 戊糖片球菌表面蛋白的抑菌性分析
鉴于戊糖片球菌F28-8表面蛋白具有N-乙酰基胞壁酰-L-丙氨酸酰胺酶活性,以及对致病菌黏附能力的负作用,进一步研究了戊糖片球菌表面蛋白对S.entericasubsp. CICC 21513和S.aureusCICC 21600的抑菌活性,结果见图8。图8显示,在培养10 h时,相比对照组,添加表面蛋白的处理组对S.entericasubsp. CICC 21513和S.aureusCICC 21600的抑菌率分别为31.5%和15.6%。结果表明,戊糖片球菌表面蛋白对S.entericasubsp. CICC 21513的抑菌效果稍强于S.aureusCICC 21600,原因可能是LiCl提取物中除了能有效抑制革兰氏阳性菌的抑菌因子外,还存在能抑制革兰氏阴性菌的其他抑菌因子。有关抑菌因子的分离、鉴定及其抑菌谱,有待进一步研究。

表面疏水性:菌体与二甲苯混合后对其的吸附率;自动聚集性:菌体涡旋并静置4 h后的自动聚集能力;表面电荷:菌体与三氯甲烷(乙酸乙酯)混合后对其的吸附率;SLP+:未去除表面蛋白菌株,SLP-:去除表面蛋白菌株;“*”表示实验组和对照组差异显著(P<0.05)。图6 P. pentosaceus F28-8失去表面蛋白前后的表面性质Fig.6 Surface properties of P. pentosaceus F28-8 before and after loss of surface protein
3 结 论
通过透射扫描电镜、SDS-PAGE、MALDI-TOF-MS等手段证实P.pentosaceusF28-8存在表面结构及表面蛋白,经鉴定表面蛋白中含有主要成分N-乙酰基胞壁酰-L-丙氨酸酰胺酶和LysM肽聚糖结合域蛋白。进一步研究表明,戊糖片球菌表面蛋白对菌株的表面性质具有极显著影响(P<0.01),该表面蛋白可竞争性抑制致病菌的黏附作用,并具备一定的抑菌作用。

SLP+:未去除表面蛋白菌株;SLP-:去除表面蛋白菌株;CK:未添加表面蛋白组;+SLP:添加表面蛋白组;“*”表示实验组和对照组有显著性差异(P<0.05)。图7 P. pentosaceus F28-8表面蛋白对菌株黏附的影响Fig.7 Effect of P. pentosaceus F28-8 surface protein on adhesion of strains

图8 P. pentosaceus F28-8表面蛋白对沙门氏菌和金黄色葡萄球菌生长的影响Fig.8 Effect of P. pentosaceus F28-8 surface protein on growth of Salmonella and Staphylococcus aureus

