F2RL3影响肾癌A498细胞增殖、侵袭、转移及糖酵解效应
曹达龙,朱文恺,黄永墙,盛昊悦,施国海,张海梁,叶定伟
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
肾癌是常见的泌尿生殖系统恶性肿瘤之一。最新统计数据显示,2018年全球将有 403 262例新发病例和175 098例死亡病例[1]。与肾癌相关的危险因素包括肥胖、吸烟及高血压等,尤其吸烟目前被认为是肾癌主要的致病因子之一[2]。F2R样凝血酶/胰蛋白酶受体3(F2R like thrombin or trypsin receptor 3,F2RL3)在既往的研究中被发现与吸烟状态密切相关[3],同时还与一些癌症的发生、发展相关[4]。我们的研究同样发现F2RL3的表达状态与肾癌的预后密切相关,即高表达F2RL3的患者预后较差[5]。众所周知,肿瘤细胞的侵袭转移潜能是肿瘤难以被根治的重要原因。肿瘤细胞的基本生命活动需要细胞代谢进行供能,肿瘤代谢被认为在肿瘤的侵袭转移过程中起着至关重要的供能作用[6]。已有研究发现,肿瘤发生、侵袭、转移时细胞的代谢模式会从线粒体的氧化磷酸化转化成糖酵解效应,即瓦伯格效应(Warburg effect)[7]。瓦伯格效应是一种异常的代谢模式,即在氧供充足的条件下肿瘤细胞仍主要依赖糖酵解生成生命活动所需的物质和能量。2011年,Weinberg在总结肿瘤生物学特征的经典论著Hallmarks of Cancer:the Next Generation中,将肿瘤细胞的糖酵解代谢模式归纳为肿瘤的十大特征之一,与肿瘤的多种恶性生物学行为相关[8-9]。因此,深入了解肿瘤代谢、侵袭转移及它们之间的关系,有利于为探索肿瘤的发生、发展机制及干预肿瘤的恶性生物学行为提供重要线索。本研究将在肾癌A498细胞中探讨F2RL3对细胞增殖、侵袭、转移和葡萄糖代谢的影响,了解肿瘤代谢与肿瘤恶性生物学行为之间的关系,为通过干预肿瘤代谢进而阻止肿瘤恶性生物学行为提供重要依据。
1 材料和方法
1.1 细胞系和细胞培养
人肾癌A498细胞系购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);A498细胞系在含有10%胎牛血清的DMEM培养基中于37 ℃、CO2体积分数为5%的条件下进行培养。
1.2 主要试剂
CCK-8试剂盒购自日本同仁化学研究所Dojindo,F2RL3抗体(ab137927)、c-myc抗体(ab32072)和缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)抗体(ab51608)购自英国Abcam公司,β-actin内参抗体购自美国Proteintech公司,葡萄糖吸收和乳酸生成分析试剂盒购自美国Biovision公司。
1.3 载体构建及慢病毒转染
敲减F2RL3基因的慢病毒载体采用pLKO.1 TRC cloning vector,购自美国Addgene公司,针对F2RL3基因的靶序列为TCACTAGCGGAGGTCACTTTG。慢病毒的生产采用HEK-293T细胞,按照4∶3∶1的比例将慢病毒载体、包装质粒sPAX2和pMD2.G转染至 HEK-293T细胞中。转染48 h后收集慢病毒颗粒,于-80 ℃冻存,用于感染目的A498细胞。将待感染A498细胞铺在6孔板中进行培养,细胞贴壁后每孔加入2 mL所收集的慢病毒颗粒,24 h后更换成完全培养基培养。待细胞长满后传入 25 cm2的培养瓶中继续培养,细胞丰度达到80%时加入嘌呤霉素筛选出F2RL3低表达的稳转株。
1.4 细胞增殖实验
实验分成两组,一组为对照组,另一组为F2RL3基因敲低的实验组。将待检测的10 000个/孔(100 μL)实验组或者对照组细胞分别铺于96孔板中,以30%初始丰度为宜,每组设置6个平行孔,重复3次。细胞贴壁后,分别在24、48、72、96和120 h的同一个时间点,按照100 μL培养基加入10 μL CCK-8检测试剂,2 h后测吸光度(D)。将所得D值进行比较和作图。
1.5 克隆形成实验
将每孔400个的处于对数生长期的各组细胞分别铺在6孔板内,轻轻摇匀使细胞分散均匀,在37 ℃细胞培养箱中培养2周左右,期间每3天左右观察细胞生长情况并换液。每组设置3个平行孔,重复3次。待克隆数达到30个左右时,弃去上清液,用PBS小心浸洗2遍。弃PBS,每孔加入4%多聚甲醛1 mL固定30 min,再用结晶紫(0.5%)在室温下固定0.5 h,再用PBS洗3遍,空气中干燥后拍照,计算细胞的克隆形成数并进行比较。
1.6 侵袭、迁移实验
细胞的侵袭、迁移能力可通过transwell小室法进行评价。侵袭能力检测:首先使用60 μL的Matrigel基质胶(加拿大BD Biosciences公司)用无血清培养基按1∶5比例稀释,加入到小室上层,放置8 h后使用。实验分成两组,一组为对照组,另一组为F2RL3基因敲低的实验组,每组设置3个平行孔,重复3次。在每个小室的上层中分别加入在200 μL无血清培养基中稀释的实验组或者对照组A498细胞20 000个。将小室放入含有750 μL完全培养基的24孔板中。在37 ℃培养箱中,将A498细胞培养48 h后,将小室转入新的加入4%多聚甲醛的24孔板中。固定30 min后,再用结晶紫(0.5%)在室温下固定0.5 h。细胞用PBS洗3遍后,擦去上层细胞,在显微镜下拍照。每个孔拍摄5张照片,计数每张相片细胞数,计算平均数进行比较。迁移能力检测:同样分成两组,每组设置3个平行孔,重复3次,然后直接在每个小室的上层中分别加入在200 μL无血清培养基中稀释的20 000个实验组或对照组A498细胞。将小室放入含有750 μL完全培养基的24孔板中。与检测侵袭能力相似,在37 ℃培养箱中将A498细胞培养24 h后,将小室转入新的加入4%多聚甲醛的24孔板中。固定30 min后,再用结晶紫(0.5%)在室温下固定0.5 h。细胞用PBS洗3遍后,擦去上层细胞,在显微镜下拍照。每个孔拍摄5张照片,计数每张相片细胞数,计算平均数进行比较。
1.7 蛋白质印迹法(Western blot)和代谢葡萄糖能力的检测
HIF-1α和c-myc是肿瘤细胞代谢的关键性调控分子,通过调控代谢途径中的关键酶而影响肿瘤细胞代谢模式的转化。F2RL3、HIF-1α和c-myc的蛋白水平按照Western blot的标准流程进行检测。根据葡萄糖吸收和乳酸生成分析试剂盒(美国Biovision公司)的说明书,通过检测不同组细胞的葡萄糖吸收和乳酸生成水平来计算各组细胞代谢葡萄糖的能力。实验组和对照组分别设置3个平行组,共重复3次。
1.8 统计学处理
采用IBM SPSS 21.0软件进行统计学意义。组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 敲减F2RL3基因可以抑制A498细胞的增殖、侵袭和迁移能力
通过慢病毒介导的转染方式,干扰细胞内F2RL3的表达,进而观察F2RL3对细胞增殖和克隆形成的影响。使用CCK-8法检测细胞的增殖情况,结果发现F2RL3低表达组与对照组比较,细胞生长在第3~5天时受到明显抑制,表明敲减F2RL3具有抑制细胞增殖的作用(P<0.05,图1A)。另外,通过克隆形成实验发现F2RL3低表达细胞的克隆形成率显著低于阴性对照组细胞(P=0.001 3,图1B)。这一结果与上述细胞增殖实验结果一致,均表明敲减F2RL3基因能够抑制A498细胞的增殖能力。
恶性肿瘤的特征之一是无限增殖,其获得侵袭转移潜能是无法根治的主要原因。随后,借助于transwell小室检测了细胞的侵袭和迁移能力,结果发现F2RL3低表达的细胞的侵袭能力显著低于对照组(P=0.009 3,图1C)。F2RL3低表达的细胞的转移能力亦显著降低(P=0.004 0,图1D)。这些结果表明,F2RL3与肾癌A498细胞的增殖、侵袭和转移能力密切 相关。

图 1 敲减F2RL3基因后抑制A498细胞的增殖、克隆形成、侵袭和迁移能力Fig. 1 Decreased F2RL3 gene inhibited proliferation, clone formation, invasion and migration of A498 cells
2.2 F2RL3表达下调能抑制A498细胞的糖酵解效应
为了验证F2RL3是否与糖代谢模式转化相关,首先在蛋白水平上检测了影响代谢的关键分子c-myc和HIF-1α的变化。结果显示,F2RL3表达下调伴随着c-myc和HIF-1α分子的明显下调(图2A),提示F2RL3下调引起A498细胞增殖、侵袭转移能力减弱的同时伴有糖代谢模式的转化。随后,通过检测A498细胞吸收葡萄糖和分泌乳酸的水平发现,F2RL3下调明显抑制了A498细胞吸收葡萄糖和生成乳酸的能力(P=0.013和P=0.006,图2B)。这些结果显示,F2RL3下调不仅可抑制A498细胞的增殖、侵袭及迁移能力,而且抑制肿瘤细胞以糖酵解方式代谢葡萄糖的能力。
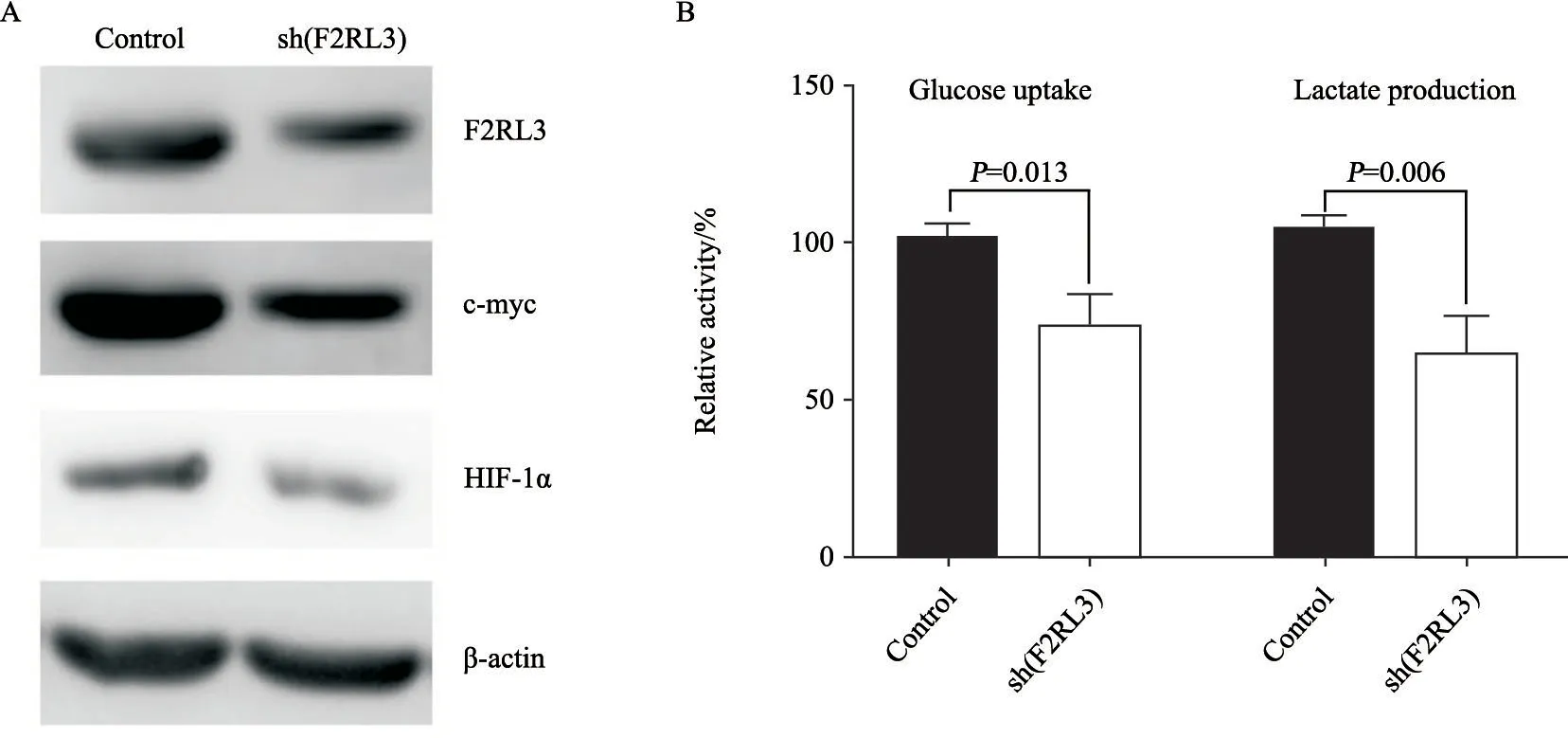
图 2 Western blot检测敲减F2RL3基因抑制A498细胞代谢葡萄糖的能力Fig. 2 Knocking down F2RL3 gene inhibited glucose utilization in A498 cells detected by Western blot
3 讨 论
在既往的研究中F2RL3被发现不仅与恶性肿瘤的发生、发展有关[10-11],而且与恶性肿瘤的转移有关[12]。F2RL3同时也是一种凝血酶受体并调控着血液的凝固过程。癌症患者的特征之一是血液呈现高凝状态,这也从另一个角度揭示F2RL3与癌症之间存在密切的联系[13]。我们的研究同样发现F2RL3还与肾癌的预后密切相关[5]。因此,进一步研究F2RL3在肾癌发生、发展中的具体作用机理有助于为干预肾癌的恶性生物学行为提供重要线索。
肿瘤细胞维持恶性增殖、侵袭转移能力需要细胞代谢不断地提供能量和物质。对于恶性肿瘤细胞而言,代谢模式转化至有氧糖酵解模式不仅可以为其恶性生物学行为提供ATP,而且可以为其合成生物大分子提供原料[14]。同时,糖酵解会伴随着乳酸生成的增加,造成肿瘤微环境呈酸性状态,进而导致细胞基质的不稳定性和降解,有利于肿瘤细胞的侵袭转移[15]。因此,肿瘤细胞代谢与其恶性增殖、侵袭转移能力之间存在着一定的联系。综上所述,研究F2RL3与肿瘤代谢模式转化、恶性增殖、侵袭转移之间的关系有助于寻找新的干预肾癌恶性生物学行为的 手段。
在F2RL3的临床转化应用研究中,Baglietto 等[11]发现F2RL3基因甲基化状态可以预测肺癌的风险。同样,亦有研究发现F2RL3可以作为治疗心血管疾病的靶点[16]。在乳腺癌的侵袭、转移能力增强时,伴随着其代谢模式发生明显的变化,果糖-1,6-二磷酸酶1(fructose-1,6-bisphosphatase 1,FBP1)的下调能进一步促进乳腺癌细胞获得代谢优势并增强其恶性潜能[7]。在本研究中,我们发现人肾癌A498细胞系中F2RL3下调后可以明显抑制其增殖、侵袭及迁移能力。HIF-1α和c-myc是肿瘤细胞代谢的关键性调控分子,通过调控代谢途径中的关键酶而影响肿瘤细胞代谢模式的转化。在本研究中我们同样发现,敲减F2RL3基因后可以引起肾癌A498细胞中HIF-1α和c-myc的下调,同时可以明显抑制该细胞吸收葡萄糖和生成乳酸的能力。
本文研究结果显示肾癌A498细胞中F2RL3不仅与肿瘤的恶性增殖、侵袭转移有关,而且与肿瘤代谢模式转化有关,同时间接揭示了肿瘤细胞代谢与其侵袭转移能力之间存在着一定的联系。这些结果为后续研究肾癌细胞侵袭转移与糖代谢之间的关系提供了重要的理论依据,同时为寻找干预肾癌侵袭转移潜能的手段提供了重要线索。

