腌制蔬菜微生物的研究进展
吴丽娜,谢小本,刘东红,叶兴乾,尹源明,周建伟,5,丁 甜,4
(1 浙江大学生物系统工程与食品科学学院,杭州 310058;2 工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室(天津科技大学),天津 300457;3 绍兴咸亨食品股份公司,浙江绍兴 312000;4 浙江大学馥莉食品研究院,杭州 310058;5 浙江大学宁波理工学院,浙江宁波 315100)
腌制是我国最常用的蔬菜加工方法,腌制蔬菜因其工艺简单,便于保存,风味独特而且能增进食欲,深受消费者喜爱。蔬菜腌制是指在蔬菜中加入食盐或者发酵剂,来改变蔬菜口感风味,提高营养价值的一种加工方法。腌制蔬菜按其加工工艺可分为酱渍菜、糖醋渍菜、糟渍菜、糠渍菜、盐水渍菜6类[3]。我国的腌制蔬菜种类繁多,比较出名的有涪陵榨菜、四川泡菜、东北酸菜等。
发酵作用是利用微生物分解蔬菜营养物质的产物,以及某些微生物本身的味道来增加蔬菜的风味和口感。发酵作用可分为乳酸发酵、酒精发酵、醋酸发酵和丁酸发酵等。乳酸发酵生成的乳酸,可以给蔬菜带来独特的酸味,也可以抑制有害菌的生长,有防腐效果;酒精发酵和醋酸发酵产生的少量乙醇与酯类,可以增加蔬菜的特殊香味,有增进食欲的效果;丁酸发酵生成的丁酸,会加速蔬菜的腐败,也影响风味。因为乳酸菌是兼性厌氧菌,生长繁殖不需要空气,而大多数有害菌均是好气菌,所以蔬菜腌制时要隔绝空气。本文腌制蔬菜微生物研究现状以及菌种鉴定方式。
1 蔬菜腌制过程中的主要微生物
1.1 乳酸菌
乳酸菌是一种兼性厌氧菌,在蔬菜腌制中具有重要作用,能提高营养价值、改善食品风味、预防腐败变质。在蔬菜的起始发酵和主发酵阶段,占优势的乳酸菌主要有植物乳杆菌、短乳杆菌、膜状明串珠菌、戊糖片球菌等[9]。
杨珺等[10]采用常规微生物培养方法,对四川榨菜后熟阶段微生物区进行研究,分离得到的细菌参照《伯杰氏细菌鉴定手册》和《一般细菌常用鉴定方法》做相关的生理生化试验和形态观察,分别归于9个属,12种菌,经进一步的试验工作,其中乳酸菌主要为植物乳杆菌、发酵乳杆菌、乳酸片球菌、戊糖片球菌等。李正国等[11]采用基于16SrRNA作为分子标记的变性梯度凝胶电泳(DGGE)方法,分析榨菜腌制过程中不同时期的细菌群落结构,分离鉴定得到7个属的细菌类群,乳酸菌中乳杆菌是优势菌群,另外还测出片球菌。在发酵初期,明串珠菌是优势菌;发酵中期,明串珠菌受到抑制,乳酸细菌迅速成为优势菌;发酵后期,乳酸菌也受到抑制。
1.2 酵母菌
酵母是一些单细胞真菌,是一种典型的兼性厌氧微生物,在有氧和无氧条件下都能够存活;同时也是一种天然发酵剂,常用于制作面包和蔬菜腌制。蔬菜腌制中常见的酵母主要是啤酒酵母、产醭酵母和鲁氏酵母等[1]。张腾[14]采用PCR-DGGE方法分析研究不同盐浓度蔬菜发酵过程中的细菌、真菌,结果表明,食盐浓度4%的发酵蔬菜中细菌体系包括假单胞菌、沙雷氏菌、泛菌及松鼠葡萄球菌等,而真菌微生物主要有Wickerhamomycesanomalus、假丝酵母、季也蒙酵母;食盐浓度6%的发酵蔬菜细菌体系中含有柠檬明串珠菌和肠系膜明串珠菌以及肠杆菌、泛菌,真菌微生物主要包括酿酒酵母、季也蒙酵母、汉逊德巴利氏酵母、毕赤酵母等;食盐浓度8%的发酵蔬菜细菌体系中包括沙雷氏菌、拉恩氏菌以及松鼠葡萄球菌,真菌微生物主要为假丝酵母、毕赤酵母、Wickerhamomycesanomalus及马克斯克鲁维酵母。
1.3 醋酸菌
在腌制过程中,原料蔬菜表面附着的少量醋酸菌能在有氧条件下将酒精氧化为醋酸。在蔬菜腌制过程中多为杆菌,如膜醋酸杆菌、黑醋酸菌和红醋酸菌等[1]。孟宪刚等[15]采用传统分离鉴定法对发酵蔬菜浆水中优势好氧微生物进行研究,得到8株酵母菌和1株细菌,初步鉴定酵母菌归入3个属,分别是酒香酵母属、瓶形酵母属和假丝酵母属;将细菌初步归为醋酸杆菌属。
1.4 霉菌
霉菌是真菌的一部分,菌丝发达,在蔬菜腌制过程中为有害菌,会导致蔬菜组织软化,口感变差,引起严重腐败,霉菌的大量繁殖也会影响蔬菜的外观。在蔬菜腌制过程中常见的霉菌主要有青霉、交链孢霉、镰刀霉等[1]。杨珺等[10]采用常规微生物培养方法,对四川榨菜后熟阶段微生物区进行研究,分离得到的细菌分别归于9个属,12种菌,其中霉菌鉴定出2个属,分别是青霉属和曲霉属。
1.5 其他细菌
在蔬菜腌制的初期还有另外一些细菌活动,如大肠杆菌、丁酸菌、丙醋杆菌和丙醋梭菌等[1]。何鹏晖等[16]以发酵蔬菜为研究对象,采用16S rDNA对其中形成腐败膜醭的主要微生物进行鉴定研究,利用胰蛋白胨大豆琼脂培养基分离培养发酵蔬菜腐败膜醭中的微生物,挑取50株单克隆回接到发酵盐卤胰蛋白胨培养基中培养,将能够在培养液表面显著形成膜醭的菌株进行鉴定,共分离鉴定出6株细菌,分别为枯草芽孢杆菌、弗氏柠檬酸杆菌、科氏葡萄糖球菌科氏亚种、普罗威登斯菌、克雷伯氏杆菌属和阴沟肠杆菌。
2 影响腌制蔬菜中微生物的环境因子
2.1 盐度
腌制蔬菜含盐量一般为泡酸菜0~4%、咸菜类10%~14%、糖醋菜1%~3%、盐渍菜25%。大多数微生物细胞渗透压力为3.54×105~1.62×106Pa,1%的食盐产生1.8×104Pa的渗透压。3%~5%的食盐抑制大多数腐败细菌,10%的食盐对乳酸菌、大肠杆菌、丁酸菌产生抑制作用,酵母菌耐盐性较强,受盐度影响较小。李军波[17]采用自然发酵和强化发酵2种发酵方式对2%、5%、8%(w/v)3种食盐浓度的泡菜进行了研究并发现了:(1)2%食盐浓度中乳酸菌的繁殖代谢最快;5%浓度能较好地抑制真菌和大肠杆菌的繁殖;8%浓度减缓了乳酸菌的繁殖代谢。(2)盐浓度低于2%时,食品乳杆菌缓慢生长;盐浓度高于2%时,食品乳杆菌的生长受到抑制,数量也逐渐降低。但相比于植物乳杆菌和肠膜明串珠菌,食品乳杆菌的耐盐性更好。
2.2 温度
微生物都需要适宜的温度才能正常的生长繁殖。乳酸菌活动的最适温度为26~30℃,醋酸菌适宜温度为25~30℃、酵母菌适宜温度为25~28℃、大多数霉菌适宜温度为25~30℃。腌制过程中的发酵温度应该保持在12~22℃之间,既保证了乳酸菌的发育,又能抑制腐败菌的繁殖。腌制过程中难免有杂菌产生,比如丁酸菌的适宜温度是35℃,为了延长腌制蔬菜的保质期,应将贮藏环境温度降低,最好放冰箱里。
2.3 酸度
蔬菜腌制中几种主要微生物所能忍受的最低pH为:霉菌1.2~3.0、丁酸菌4.5、大肠杆菌5~5.5、乳酸菌3.0~4.4、腐败细菌4.4~5.0、酵母菌2.5~3.0[1]。所以一般在腌制后熟阶段,把腌渍液的pH控制在4.5以下,就能控制有害微生物的生长繁殖。
2.4 气体成分
蔬菜腌制时一般都要压紧或密封,或者用盐水淹没来隔绝空气。因为乳酸菌是兼性厌氧菌,在隔绝空气状态下能进行正常的发酵,而以霉菌为主的有害微生物都是需氧菌,通过隔绝空气的措施可抑制它们的生长发育,来保证腌制蔬菜的品质。
2.5 蔬菜品种
蔬菜本身提供的营养物质,是乳酸菌进行发酵作用的条件之一。原料蔬菜中营养物质含量多少会影响发酵速度和酸性产物的生成。相同条件下,含糖量越多的蔬菜能令乳酸发酵越快。一般用于腌制的蔬菜,含糖量在1.5% ~3%比较合适,如果发酵效果不明显,可以适当添加一些糖。
3 腌制蔬菜微生物的鉴定技术
腌制蔬菜微生物的鉴定技术见附表。
3.1 传统菌种鉴定技术
传统的菌种鉴定技术有菌落形态观察、革兰氏染色、鞭毛染色、糖类分解试验、吲哚(靛基质)试验、淀粉水解试验、V-P试验、甲基红试验、硝酸盐还原试验、接触酶试验等。传统的细菌学检验与鉴定的主要依据是形态特征和生理形状进行细菌培养及一系列生化反应或免疫学检测。方法复杂费时,对有些细菌也往往不能给出理想的结果。
3.2 聚合酶链式反应技术(PCR)
PCR技术是1985年由MULLIS发明的一种聚合酶链式反应技术,是DNA的体外扩增技术,原理类似于DNA的体内复制过程,需要模版DNA、寡核苷酸引物、DNA
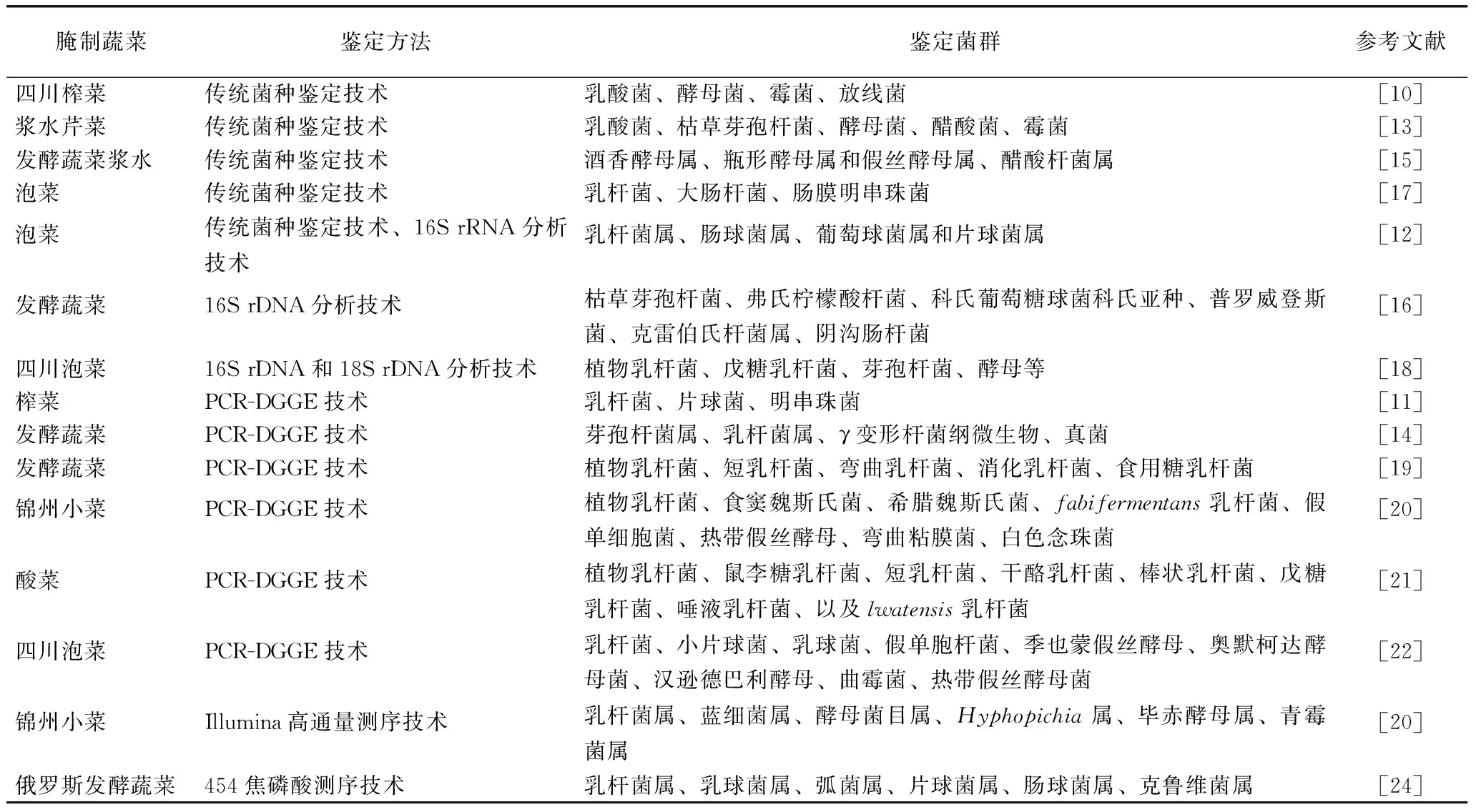
附表 腌制蔬菜菌群鉴定技术
聚合酶、4种脱氧核苷三磷酸(dNTP)原料和合适的缓冲液体系,在一定的温度下,经过重复的过程,就能完成DNA的体外合成。PCR技术的优点是能在短时间内将目的基因进行扩增,以便对已知DNA片段进行分析。以PCR技术为基础的PCR-DGGE技术和实时荧光定量PCR技术在发酵蔬菜的微生物研究有广泛应用。
3.2.1PCR-DGGE技术 PCR-DGGE技术是近几年比较热门的分子鉴定技术,它主要是通过在电泳凝胶中加入尿素和甲酰胺等变性剂,从而区分相同长度不同序列的DNA片段。DGGE技术可以用于特定菌的存在,也能发现没有被分离鉴定的菌种,还能监测菌群结构的变化,在食品微生物分析中应用广泛。但是PCR-DGGE也有缺点,它对含量较低的菌群无法检测,也很难区分相似度高的菌种。为了确保分辨率,用于DGGE分析的PCR产物一般要求长度在500bp以下。DGGE技术的缺陷是电泳的共迁移现象会对测序结果有所影响。荆雪娇等[25]采用PCR-DGGE技术,分析了市售9种发酵蔬菜中细菌菌群结构,结果表明,所有的发酵蔬菜中均存在植物乳杆菌,但在酱菜中含量比较少;另外含量较多的还有短乳杆菌、弯曲乳杆菌、消化乳杆菌和食用糖乳杆菌;在不同加工工艺中,泡菜工艺下真菌群落结构稳定性最高;酸菜工艺下真菌群落结构稳定性最差。
3.2.2实时荧光定量PCR技术 实时荧光定量PCR技术是在DNA扩增反应中加入荧光基团,每次聚合酶链式反应的进行,荧光信号会逐渐累积,循环后测出产物总量的方法,该技术能够使整个PCR反应过程被实时监测,然后通过标准曲线可以对未知的模版进行定量分析。荧光定量PCR技术精度高,在发酵食品中主要菌群的分布及丰度,发现新的微生物具有重要意义。
3.3 基因测序技术
基因测序技术的发展可分为三代:毛细管电泳测序技术、高通量测序技术、单分子测序技术。
3.3.1第一代测序技术 第一代测序技术的理论依据是Sanger建立的“DNA双脱氧链末端终止测序法”和Maxam-Gilbert 化学降解法。Sanger法利用双脱氧核苷三磷酸(ddNTP)比dNTP缺少3’-OH,能使引物与目的DNA的延伸反应停止这一原理建立4个反应,分别加入足量的4种dNTP和不同的被同位素标记的ddNTP,通过聚合酶合成能与目的DNA互补的片段,由于ddNTP的存在,会形成不同长度的DNA延伸片段,将4个反应的产物分4个泳道用聚丙烯酰胺凝胶电泳进行分离,便可以按顺序读出相应的DNA序列。荧光标记技术出现后,逐渐取代同位素标记技术,在Sanger法中,可以用不同荧光标记4种ddNTP,在一个泳道的尿素变性的PAGE胶上电泳分析,然后通过检测不同波长的信号,用计算机分析信号后即可获得目的DNA的碱基序列。Maxam-Gilbert化学降解法其原理是将目的DNA片段的5’端作放射性标记,然后设计5个独立的反应,每个反应中分别用不同试剂将目的DNA切割成重复的碱基片段,通过凝胶电泳分离,根据不同条带的显示情况,可以分析出各片段末端碱基,从而确定目的DNA的碱基序列。
化学降解法与Sanger法相比,是直接用目的DNA的片段来进行电泳分析,而不是通过酶合成的与目的DNA互补的片段进行测序,能够有效避免酶合成出错导致测序结果偏差。但化学降解法的操作过于复杂,渐渐被Sanger法代替。
3.3.2第二代测序技术 高通量基因测序技术是对毛细管电泳技术一次革命性的改变,高通量测序设备运行一次可以实现对几十万到几百万条DNA分子进行序列测定,每次运行所获得的数据量是Mbp。目前,高通量测序平台的代表有罗氏公司的454 测序仪、美国Illumina公司推出的Solexa基因组分析平台、ABI公司自主研发的SOLiD 测序仪[23]。
孙慧君等[20]采用Illumina高通量测序方法对27份传统发酵锦州小菜微生物多样性进行研究,共检测到5种已知细菌门,53种细菌属,乳杆菌属、蓝细菌属是优势菌属;检测出的20种真菌属中,2种酵母菌目属、Hyphopichia属、毕赤酵母属为优势菌属,青霉菌属在所有样品中测出。
侯强川等[24]采用454焦磷酸测序技术对采集自俄罗斯埃利斯塔市郊的2份发酵蔬菜样品中的细菌进行了分析,分别获得了10 869和12 204条高质量序列。经过与RDP数据库比对,结果表明,乳杆菌属占细菌总数的91.66%,成为绝对优势菌,乳球菌属占细菌总数的3.81%,成为次级优势菌。另外,还鉴定出了弧菌属、片球菌属、肠球菌属、克鲁维菌属等。
3.3.3第三代测序技术 Helicos单分子测序仪、Pacific Bioscience的SMRT技术(图1)和Oxford Nanopore Technologies公司的纳米孔单分子测序技术(图2),这三种技术被称为第三代测序技术[38,40]。不同于第二代测序依赖于DNA模版和PCR扩增,采用边合成边测序的方法,第三代测序方法具有更高通量、更短时间、更精确等优点。
韩琬[26]采用单分子测序技术对日本清酒曲样品细菌和真菌多样性进行研究,结果显示,共有39 121条高质量序列生成,通过序列分析将这些基因序列归类为5格细菌门和2格真菌门,优势菌门分别为变形菌门和子囊菌门。
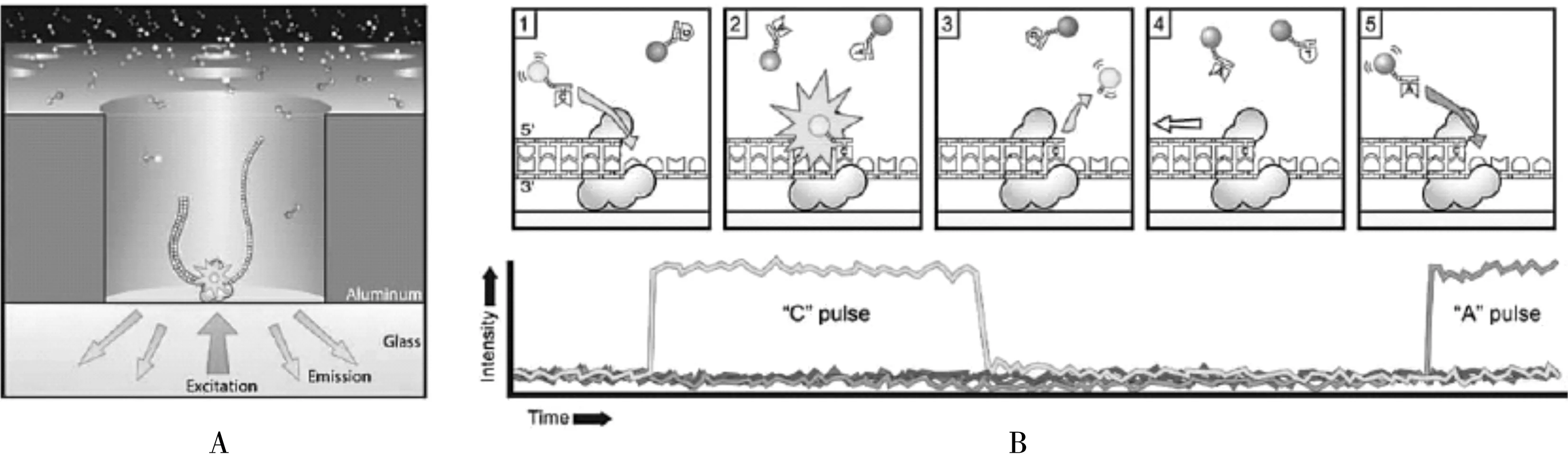
图1 SMRT 技术原理[25]

图2 纳米孔单分子测序技术原理[27]
4 结论
蔬菜腌制是一种冷加工方式,相比于热加工,在风味和营养价值上都有巨大的优越性。随着经济发展和生活水平的提高,人们对营养健康的高品质腌制蔬菜的需求也与日俱增。腌制蔬菜的品质取决于发酵微生物,因此,对传统腌制蔬菜的微生物研究及控制显得越来越重要。
从目前我国对传统发酵蔬菜中优势菌群的多样性研究方法来看,传统分离鉴定法依然占据主导,分离出的菌群种类和数量少,很多菌种都无法检测出。因此,基因测序技术的完善和推广变得越来越重要,基因测序技术精度高,简便快捷,能鉴定出大量传统分离鉴定法无法检测的菌株,有利于加深我们对传统发酵蔬菜中微生物菌群的了解,进一步阐明发酵蔬菜品质形成的机制。但是每种方法本身也有局限性,比如DGGE技术的电泳共迁移现象;高通量测序在测序前要通过PCR手段扩增,因此增加了测序的错误率等,所以在进行微生物多样性分析时,合理选择不同方法进行结果比较显的尤为重要。但笔者觉得在不久的将来,伴随着基因测序技术的成熟,对腌制蔬菜菌群变化的研究也将更加深入。◇

