猪胸膜肺炎放线杆菌的分离鉴定及药敏性试验
王宇慧,李昕,孙晓莉,孟佳丽,尚翠玲,林静,金天明
猪胸膜肺炎放线杆菌的分离鉴定及药敏性试验
王宇慧,李昕,孙晓莉,孟佳丽,尚翠玲,林静,金天明通信作者
(天津农学院 动物科学与动物医学学院,天津 300384)
以天津某大型猪场病死青年猪为研究对象,综合猪只脏器病变状况观察,以及形态学鉴定、培养基鉴定、生化鉴定和16S rRNA扩增PCR鉴定等4种方法,并通过动物致病性试验验证,结果显示,该发病猪为猪胸膜肺炎放线杆菌(,APP)感染。药敏试验结果显示,猪胸膜肺炎放线杆菌对头孢哌酮敏感;对氯霉素、阿莫西林、环丙沙星为中度敏感;对强力霉素、链霉素、卡那霉素、青霉素、四环素、氨苄青霉素、万古霉素、庆大霉素耐药。本试验为猪场猪胸膜肺炎的临床诊断及用药提供了理论依据。
猪胸膜肺炎放线杆菌;16S rRNA;分离鉴定;药敏试验
胸膜肺炎放线杆菌(,APP)是猪传染性胸膜肺炎(Porcine Contagious pleuropneumonia,PCP)的致病菌,为革兰氏阴性小球杆菌[1-3],主要寄生在呼吸道,随空气传播入肺,引发疾病,致死率可高达80%以上[4-5]。
猪传染性胸膜肺炎不分年龄阶段,各性别猪均易感染,常爆发于1~3月龄仔猪[6-9],自1957年由Pattison等首次报道以来,呈世界流行性趋势,集约化养殖国家尤甚严重,属集约化养殖厂五大疫病之一[10-11]。
1 材料与方法
1.1 试验材料
1.1.1 病料来源
2017年天津某大型猪场陆续发生猪只死亡,学校实验室接收送检3只病死青年猪(1号猪30日龄,2号猪58日龄,3号猪80日龄)。
1.1.2 主要仪器试剂
正倒置一体显微镜(Echo Laboratories),CO2恒温培养箱(上海福玛实验设备有限公司),恒温摇床(上海世平实验设备有限公司),PCR扩增仪(北京友华照钦医疗器械有限公司),电泳仪(北京君意东方电泳设备有限公司)。
TSB肉汤培养基(胰蛋白胨大豆肉汤,酵母粉,大豆蛋白胨,葡萄糖,NaCl,K2HPO4·H2O,NAD+,5%血清),TSA琼脂平板(同TSB肉汤培养基,Agar Power),革兰氏染色剂(批号:20170526),血琼脂平板培养基,葡萄糖、乳糖、麦芽糖、甘露醇蔗糖水溶液,Dunham氏蛋白胨水溶液,Ehrlich氏试剂,戊醇,二甲苯,甲基红试剂,VP试剂(使用前均加入NAD+),H2S微量发酵管,Buffer,MgCI2,dNTP,引物16S rRNA,酶,药敏纸片。
1.1.3 PCR引物(通用引物16S rRNA)
使用16S rRNA基因的通用引物对目标片段进行扩增,引物由上海捷瑞生物工程有限公司合成。按照使用说明进行稀释分装,-20 ℃保存。引物具体见表1。

表1 PCR引物
1.2 试验方法
1.2.1 病原菌分离
对病猪进行剖检,采集心、肝、脾、肺、肾、心包液、腹腔液、下颌淋巴结、胃、肠等病变部位病料,接种于TSA琼脂平板上,恒温培养箱37 ℃培养24 h。观察菌落形态,并挑取不同形态菌落分离培养。将纯化后的细菌接种于血琼脂平板培养基、伊红美蓝琼脂平板培养基、麦康凯琼脂平板培养基、三糖铁斜面培养基,37 ℃恒温培养箱过夜培养,观察培养结果。将纯化并鉴别后的菌种接种于TSB肉汤培养基,恒温摇床上170 r/min 37 ℃培养24 h后,菌种冻干保存。
1.2.2 革兰氏染色镜检
将纯化后的菌种进行革兰氏染色,应用光学显微镜,100倍物镜下进行油镜镜检观察并拍照记录。
1.2.3 生化鉴定
乳糖、果糖、葡萄糖、麦芽糖、甘露醇、蔗糖水溶液试管中放入倒置的杜氏小管,分别接种分离纯化后的菌种培养液100 μL,37 ℃恒温培养箱培育2~3 d,观察培养结果[8]。同时进行吲哚(靛基质)试验、甲基红(MR)/VP试验、H2S试验鉴定,观察并记录试验结果。
1.2.4 PCR鉴定
将分离纯化后的菌种接种到TSB肉汤培养基中,37 ℃培养24 h。利用16S rRNA引物扩增细菌基因序列。PCR反应体系为:5.0 μL 菌液、1.0 μL PF、1.0 μL PR、12.5 μL 2×PCR Master Mix,ddH2O定容至25 μL。反应条件为:95 ℃5 min;95 ℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环,72 ℃延伸15 min[12-13]。PCR反应结束后,取5 μL PCR产物与1 μL上样缓冲液混匀,进行1%琼脂糖凝胶电泳,检测目的条带。
将PCR产物送上海生工生物工程公司测序并用NCBI/BLAST分析测序结果。
1.2.5 动物致病性试验
将分离纯化细菌单个菌落用生理盐水作5倍和10倍稀释,取15~20 g小鼠分成3组,每组2只。第1组为试验组,腹腔接种5倍稀释的菌液0.2 mL;第2组为实验组,腹腔接种10倍稀释的菌液0.2 mL;第3组作为对照组,腹腔注射生理盐水0.2 mL,观察各组小鼠发病情况。待小鼠死后,剖检,记录病理变化,取内脏病料依据以上方法进行细菌分离培养,进行革兰氏染色镜检、培养基鉴定、生化鉴定等。
1.2.6 药敏试验
将对数生长期的致病菌菌液稀释至1×108~2×108cfu/mL,用移液器吸取菌液0.1 mL涂布于TSA琼脂平板,倒置于37 ℃恒温培养箱培养24 h,观察抑菌圈直径大小并记录。
2 结果与分析
2.1 剖检结果
对3只病死猪进行剖检发现,猪肺部大量出血,肺部与胸部黏连,分离下来的肺不完整,可能与胸膜的纤维素性黏连有关(图1、图2)。

图1 胸腔解剖图
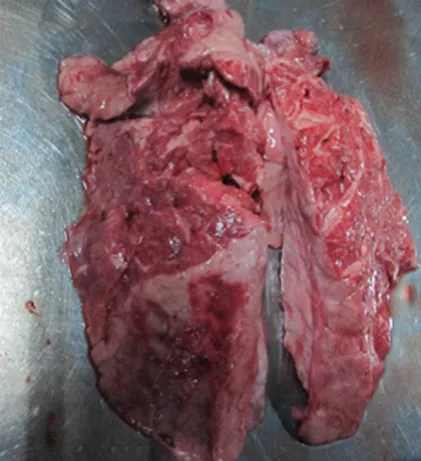
图2 肺脏解剖图
2.2 形态学检查结果
经过革兰氏染色,肺(1-1)、肺(1-3)、肺(2-3)、胃(1-3)、胃(2-1)、胃(2-3)、胃(2-2)、胃(2-2)、胃(2-3)、胃(2-2)、心包液(3)、心(1-2)、肝(1-1)、右肾(1-1)、右肾(1-2)、肠(1-4)和腹腔液分离到不同染色形态的细菌。其中肺(1-1)、肺(2-3)、心包液(3)虽眼观形态略有不同,但是都是革兰氏阴性小球状杆菌,如图3~图5所示。
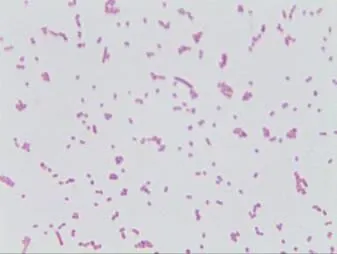
图3 肺(1-1)
图4 肺(2-3)
图5 心包液(3)
2.3 培养特性结果
细菌培养发现肺(1-1)、肺(2-3)在TSA琼脂平板上正常生长,形成湿润、灰白色、隆起的小圆形菌落;在血平板上有β-溶血环;在TSB肉汤培养基中呈均匀混浊。
2.4 生化鉴定结果
果糖、葡萄糖、麦芽糖生化试验培养液颜色转变,但杜氏小管中并未出现气体,而乳糖、甘露醇、蔗糖培养液颜色没有变化,杜氏小管中也没有出现气体;吲哚(靛基质)生化试验结果为阴性;MR试验培养液始终为黄色,VP试验培养液颜色未变;H2S试验培养液为无色,试验结果见表2。

表2 部分菌珠生化鉴定结果
注:“+”表示90%~100%阳性;“-”表示0%~10%阳性
2.5 PCR鉴定结果
2.5.1 PCR对分离株的电泳检测
相应编号细菌经过PCR扩增出约1 540 bp的条带,如图6、图7所示。
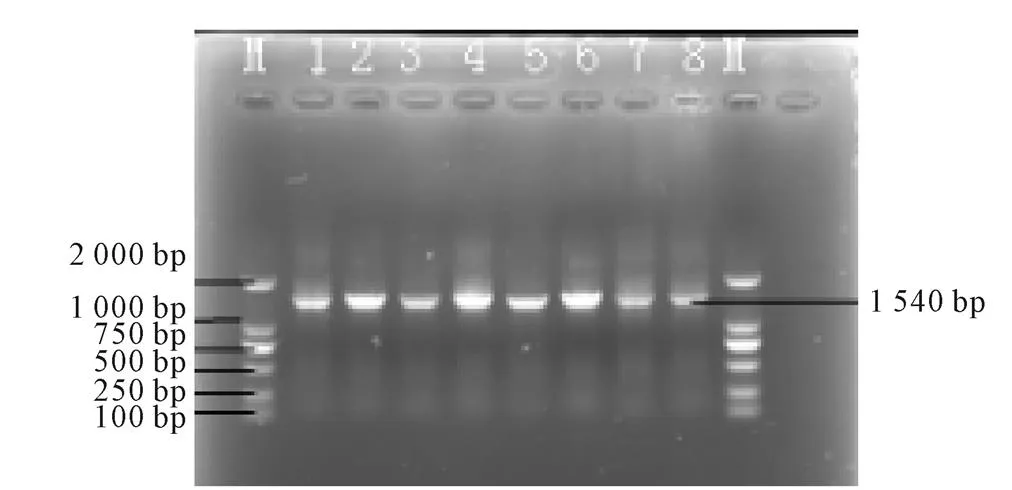
图6 基因PCR扩增图
注:M为DNA marker(DL-2000);1为肺(1-1);2为肺(1-3);3为肺(2-3);4为胃(1-3);5为胃(2-1);6为胃(2-3);7为胃(2-2);8为胃(2-2)

图7 基因PCR扩增图
注:M为DNA marker(DL-2000);1为胃(2-3);2为胃(2-2);3为心包液(3);4为心(1-2);5为肝(1-1);6为右肾(1-1);7为右肾(1-2);8为肠(1-4);9为腹腔液
2.5.2 PCR对分离株的基因序列检测
测序结果发现,肺(1-1)、肺(2-3)分离株16S rRNA基因序列测序结果相同,且与序列号为D30032.1的16S rRNA基因序列同源率高达98%,因此可确定该菌种为猪胸膜肺炎放线杆菌。
2.6 动物致病性试验结果
第1组(试验组)小鼠在接种后2 h,精神沉郁,食欲废绝。6只小鼠在8~48 h内先后死亡,剖检所见病理变化为肺脏出血,与胸膜有纤维素样黏连,支气管与肠系膜淋巴结发生水肿。对照组无发病或死亡。
解剖小鼠后,取病变脏器染色镜检,并同时进行细菌分离培养,染色镜检,培养性状观察,生化试验等。其菌的特征与病料中分离的一致。染色镜检如图8、图9所示。

图8 肺(1-3)
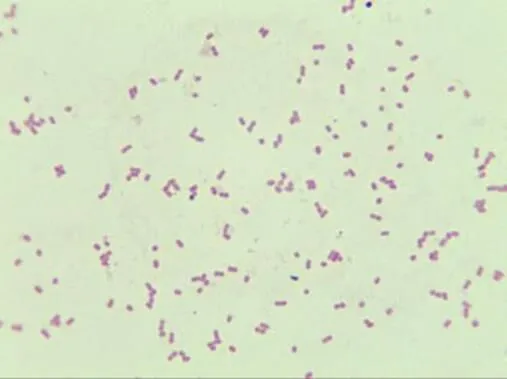
图9 肺(2-2)
2.7 药敏试验结果
研究结果发现,胸膜肺炎放线杆菌对头孢哌酮敏感;对氯霉素、阿莫西林、环丙沙星为中度敏感;对强力霉素、链霉素、卡那霉素、青霉素、四环素、氨苄青霉素、万古霉素、庆大霉素耐药。试验结果见表3。
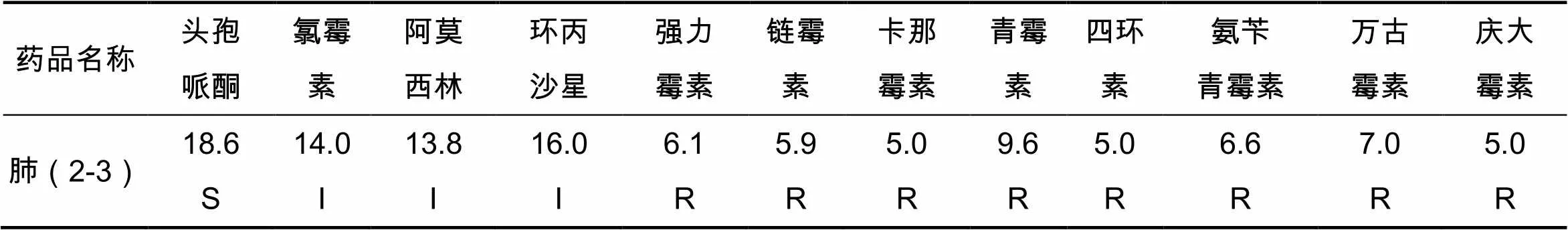
表3 致病性胸膜肺炎放线杆菌的耐药性情况(抑菌圈) mm
注:判定标准为2r<12,耐药(R);12≤2r≤16 ,中敏(I);2r>16 ,敏感(S)
3 讨论
猪胸膜肺炎放线杆菌为革兰氏阴性小球杆菌,常寄生于呼吸道中,可随空气流动,释放的毒素直接破坏机体免疫细胞、血细胞,到达肺脏引发疾病。猪胸膜肺炎放线杆菌感染病死猪肺部水肿、出血、坏死和纤维素化;胸腔出现纤维素样渗出物;心部发炎;浆膜表面有许多渗出物和纤维素的沉积[14-16]。若有类似症状,可初步怀疑病猪感染猪胸膜肺炎放线杆菌。剖检猪胸膜肺炎放线杆菌感染病死猪会发现肺部出血、不完整,可能与胸膜的纤维素性黏连有关,初步怀疑病猪感染胸膜肺炎放线杆菌。
本研究中,抹片染色镜检观察脏器细菌形态,发现细菌为革兰氏阴性小球状杆菌。培养基鉴定发现细菌在TSA琼脂平板上长出湿润、小圆形隆起菌落;在TSB肉汤培养基中呈均匀浑浊;因其有毒力因子如荚膜、脂多糖、外膜蛋白、黏附素和Apx毒素等[17],可直接破坏血细胞,在血平板上面有β-溶血现象。猪胸膜肺炎放线杆菌标准生化特性为:糖类分解试验中,乳糖显阴性、果糖显阳性、葡萄糖显阳性、麦芽糖显阳性、甘露醇显阴性、蔗糖显阴性;吲哚(靛基质)试验显阴性;甲基红(MR)试验显阴性、VP试验显阴性;H2S试验显阳性。生化鉴定结果表明,细菌生理代谢特点与胸膜肺炎放线杆菌相符。对该菌株的16S rRNA基因片段进行序列测定,经NCBI/Blast数据库比对分析,该菌株与猪胸膜肺炎放线杆菌16S rRNA基因序列相似性高达98%。动物致病性试验发现,小鼠脏器分离细菌与病料中细菌形态学检查、培养基鉴定以及生化鉴定试验结果一致,确定猪只死亡致病菌为胸膜肺炎放线杆菌。
4 结论
综合猪只脏器病变状况观察,以及形态学鉴定、培养基鉴定、生化鉴定和16S rRNA扩增PCR鉴定结果,得出猪胸膜肺炎放线杆菌为疑似致病菌;动物致病性试验确定病死青年猪死因为猪胸膜肺炎放线杆菌感染。
药敏试验发现胸膜肺炎放线杆菌对头孢哌酮敏感;对氯霉素、阿莫西林,环丙沙星敏感性中等;对强力霉素、链霉素、卡那霉素、青霉素、四环素、氨苄青霉素、万古霉素、庆大霉素耐药。
[1] 余光勇. 猪传染性胸膜肺炎放线杆菌的分离鉴定及ApxIA、TbpB基因的克隆和原核表达研究[D]. 雅安:四川农业大学,2008.
[2] 马晓平. 猪传染性胸膜肺炎放线杆菌的分离鉴定及PCR检测方法的建立[D]. 雅安:四川农业大学,2005.
[3] 丁丹丹,张震,邓立新,等. 河南省奶牛隐性乳房炎主要病原菌的分离鉴定与药敏试验[J]. 中国奶牛,2015(10):23-27.
[4] 朱吕昌. 猪胸膜肺炎放线杆菌、多杀性巴氏杆菌、副猪嗜血杆菌复合PCR检测方法以及猪胸膜肺炎放线杆菌PCR-ELISA检测方法的建立[D]. 扬州:扬州大学,2009.
[5] 薛国聪,徐成刚,涂玉蓉,等. 副猪嗜血杆菌的分离鉴定与药敏试验[J]. 中国畜牧兽医,2010,37(1):134-137.
[6] 黄红亮. 猪传染性胸膜肺炎鉴别诊断方法和胸膜肺炎放线杆菌外毒素单克隆抗体研究[D]. 武汉:华中农业大学,2005.
[7] 陈凯. 淄博地区猪传染性胸膜肺炎放线杆菌的分离鉴定及免疫预防研究[D]. 泰安:山东农业大学,2007.
[8] 任洪丽. 猪传染性胸膜肺炎发生症状及防治[J]. 中国畜禽种业,2018,14(4):135.
[9] 宋兆花,林夕香. 猪传染性胸膜肺炎的防治[J]. 畜牧兽医科技信息,2018(5):105.
[10] 张志伟. 猪传染性胸膜肺炎的诊治[J]. 当代畜禽养殖业,2018(5):27-28.
[11] 邱渊皓. 屠宰生猪肺脏病变及胸膜肺炎病原菌的分离鉴定[D]. 杨凌:西北农林科技大学,2013.
[12] 王金良,郭显坡,魏凤,等. SYBR Green Ⅰ实时荧光定量PCR检测猪流行性腹泻病毒方法的建立及应用[J].中国兽医学报,2010,30(10):1286-1290.
[13] 孙静,于志刚,甄毓,等. 运用PCR-DGGE技术对3种原甲藻18S rDNA部分序列的差异性分析[J]. 中国海洋大学学报(自然科学版), 2010,40(2):52-56.
[14] 王玉锋. 猪接触传染性胸膜肺炎的诊断与防治[J]. 农家参谋,2017(17):129.
[15] 刁有祥. 猪胸膜肺炎放线杆菌分子流行病学研究[D]. 泰安:山东农业大学,2005.
[16] 李婷婷. 胸膜肺炎放线杆菌flp操纵子的结构与功能研究[D]. 武汉:华中农业大学,2011.
[17] 徐良. 猪传染性胸膜肺炎杆菌菌影装载猪源巴氏杆菌外膜蛋白H基因二联疫苗的免疫效果评价[D]. 天津:天津农学院,2013.
责任编辑:张爱婷
The isolation and identification of pathogen and drug susceptibility test for
WANG Yu-hui, LI Xin, SUN Xiao-li, MENG Jia-li, SHANG Cui-ling, LIN Jing, JIN Tian-mingCorresponding Author
(College of Animal Science and Veterinary Medicine,Tianjin Agricultural University, Tianjin 300384, China)
In this study, three young pigs in a large pig farm from Tianjin were selected as the research objects. The results of the pathological changes of the organs, the isolation and identification of morphology, the culture medium, the biochemistry, 16S rRNA amplification and PCR were carried out to identify pathogenic bacteria. The bacteria were identified as pathogenic bacteria by animal pathogenicity test. The results showed that the cause of swine’s death wasThen drug sensitivity test showed that APP was sensitive to cefoperazone; moderately sensitive to chloramphenicol, amoxicillin and ciprofloxacin; and resistantto doxycycline, streptomycin, kanamycin, penicillin, tetracycline, ampicillin, vancomycin, and gentamicin. This experiment provides a theoretical basis for the clinical diagnosis and medication of APP.
; 16S rRNA; isolation and identification; drug sensitivity test
1008-5394(2018)04-0033-05
10.19640/j.cnki.jtau.2018.04.008
P641.131;S152.72
A
2018-06-06
天津市农委农业科技示范推广项目(201601380);天津市科技计划项目(高端兽药先进制造科技重大专项)(17ZXGSNC00030);大学生创新创业训练计划项目(201710061107)
王宇慧(1996-),女,本科在读,主要从事动物医学方面研究。E-mail:18322102589@139.com。
金天明(1968-),男,教授,博士,主要从事兽医分子免疫学研究。E-mail:jtm680@163.com。

