草鱼致病性腐败希瓦氏菌的分离鉴定及药敏特性研究
叶明皓,胡秀彩,吕爱军,孙敬锋,刘小雪,白杰
草鱼致病性腐败希瓦氏菌的分离鉴定及药敏特性研究
叶明皓,胡秀彩,吕爱军通信作者,孙敬锋,刘小雪,白杰
(天津农学院 水产学院 天津市水产生态及养殖重点实验室,天津 300384)
从患病草鱼()体内分离获得1株革兰氏阴性细菌,菌株编号为C0703,通过细菌形态学观察、理化特性、16S rDNA序列分析以及构建系统发育进化树分析等进行鉴定研究。结果表明,该分离菌株氧化酶、七叶苷、硝酸盐还原等为阳性,赖氨酸脱羧酶、葡萄糖等为阴性;进一步采用PCR方法扩增16S rDNA序列测序获得片段大小1 409 bp,与模式菌株ATCC 8071(NR 119141.1)序列相似性为98.23%;构建系统发育树分析显示与(NR 119141.1)自然聚为一支,最终判定C0703菌株为腐败希瓦氏菌()。人工回归感染草鱼试验显示,3 d累积死亡率为100%,并与自然感染临床症状基本一致;药敏试验结果显示,菌株C0703对阿莫西林、美罗培南、萘啶酸等药物敏感,对氨苄西林、头孢唑啉、万古霉素等不敏感。本研究结果为鱼源腐败希瓦氏菌的诊断及防治等提供了科学参考。
草鱼;腐败希瓦氏菌;16S rDNA;生理生化;药敏试验
草鱼是我国重要的养殖鱼类,具有较高经济价值[1-2]。近年来,水产高密度养殖容易导致草鱼疾病的发生,不仅严重影响其经济效益,而且也对人类健康造成潜在威胁[3]。近年来,关于草鱼的疾病暴发频繁,包括病毒、细菌、寄生虫引起的疾病[4],已报道水生呼肠孤病毒属()[5]、气单胞菌属()[6]、车轮虫()[7]等均可导致草鱼感染、发病、死亡。
腐败希瓦氏菌()为革兰氏阴性杆菌,已证实为水生动物和富含蛋白食品的典型腐败菌之一[8]。腐败希瓦氏菌最早被归为无色杆菌属()[9],后来被归至假单胞菌属()[10]和交替单胞菌属()[11]等多个属。目前根据16S rRNA序列进行系统发育分析,将其归为希瓦氏菌属()[12]。希瓦氏菌属广泛分布于淡水、污水和海洋中[13]。研究表明,希瓦氏菌可以导致水产动物感染发病,主要有厦门希瓦氏菌()、海藻希瓦氏菌()、腐败希瓦氏菌、鲍鱼希瓦氏菌()等[14-15]。近几年,国内外陆续发现由腐败希瓦氏菌引起的水产动物病例,不仅引起金带篮子鱼()、大菱鲆()等海水鱼类发病死亡[16-17],而且也会导致鲤()、异育银鲫()等淡水鱼类死亡[18-19]。
本研究首次发现腐败希瓦氏菌感染草鱼导致死亡。2017年7月,河南省某养殖场草鱼出现发病死亡现象,主要表现为鳃部充血、鳍条出血、鳞片脱落,解剖可见肝脏有出血点、腹水等症状。本研究从发病死亡的草鱼体内分离获得1株细菌,并对其进行细菌形态学观察、16S rDNA测序、生理生化特性、药敏试验及回归感染试验等进行系统研究,为草鱼养殖过程中有效防治疾病提供科学参考。
1 材料与方法
1.1 材料
1.1.1 试验动物
发病草鱼为河南省某养殖场送检病例样品,健康草鱼购自天津市西青区某养殖场,体长约7 cm,实验室暂养2周,确认健康无病后用于人工回归感染实验。
1.1.2 试剂
LB培养基、细菌生化鉴定管和药敏纸片均购自杭州滨和微生物试剂有限公司,PCR Master Mix试剂购自北京天根生化科技有限公司。
1.2 方法
1.2.1 细菌的分离与纯化
参照苗淼等[14]的方法,无菌操作取病鱼肝、肾等适量组织均匀涂布于LB固体培养基上,28 ℃恒温培养18 h。挑取优势单菌落接种纯化,经过3次纯化后得到纯菌种,4 ℃保存备用。
1.2.2 细菌生理生化试验
将分离菌株28 ℃培养18 h,进行革兰氏染色镜检。将菌株无菌操作接种于细菌生化鉴定管中,进行氧化酶、硝酸盐还原、糖(醇、苷)类代谢等52种生理生化特性测定,参照Bergey’s Manual of Systematic Bacteriology方法进行[20]。
1.2.3 细菌基因组DNA提取及16S rDNA基因序列的扩增
采用水煮法提取C0703菌株的基因组DNA[21],进行PCR扩增16S rDNA序列。采用通用引物27F: 5'-AGAGTTTGATCCTGGCTCAG-3',1492R: 5'-GGTTACCTTGTTACGACTT-3',引物由上海生工合成。采用1%琼脂糖凝胶电泳检测目的基因,并将PCR产物送金唯智生物科技有限公司进行基因测序。
1.2.4 细菌16S rDNA基因序列及系统发育树分析
将16S rDNA测序结果通过NCBI的Blast检索系统进行序列同源性分析,同时在NCBI下载已公布的希瓦氏菌属的16S rDNA基因序列进行相似性比较,采用MEGA 5.2软件邻接法(neighbor- joining,NJ)构建系统发育树,并通过1 000次的自举分析(bootstrap)进行置信度检测。
1.2.5 药敏试验
药敏试验采用K-B纸片法对分离菌株进行39种常用药物的敏感性检测,并测量抑菌圈直径大小,判定其对药物的敏感性。
1.2.6 动物感染试验
随机选取20尾健康草鱼作为试验动物,感染组草鱼采用腹腔注射100 μL/尾、菌液浓度为1.35×108cfu/mL,对照组注射等量无菌生理盐水;饲养温度为(26±2)℃,连续观察7 d,每天记录鱼体发病死亡情况。
2 结果
2.1 草鱼病原菌的分离及理化特性
从发病草鱼体内分离获得1株革兰氏阴性细菌,菌株编号为C0703。该菌在LB培养基28 ℃培养18 h,呈现为圆形、边缘整齐、表面湿润、光滑、不透明的较小菌落,革兰氏染色镜检为阴性短杆状细菌(图1)。细菌生理生化试验结果表明该菌株氧化酶、七叶苷、硝酸盐还原试验等为阳性,赖氨酸脱羧酶、葡萄糖、氰化钾试验等为阴性(表1),该菌株的形态学和理化特性,基本符合希瓦氏菌属()的特征。
图1 菌株C0703革兰氏染色

表1 菌株C0703的生理生化特性
注:+表示阳性,-表示阴性
2.2 分离菌的16S rDNA序列及系统发育树分析
以分离菌C0703基因组DNA为模板,采用PCR方法扩增16S rDNA序列,通过琼脂糖凝胶电泳检测大小约为1 500 bp的目的条带(图2),PCR产物测序获得16S rDNA片段大小为1 409 bp。Blast比对表明与模式菌株ATCC 8071(NR 119141.1)的16S rDNA序列相似性为98.23%,构建系统发育树分析显示分离菌C0703与(NR 119141.1)亲缘关系最近,自然聚为一支(图3),最终判定C0703菌株为腐败希瓦氏菌。
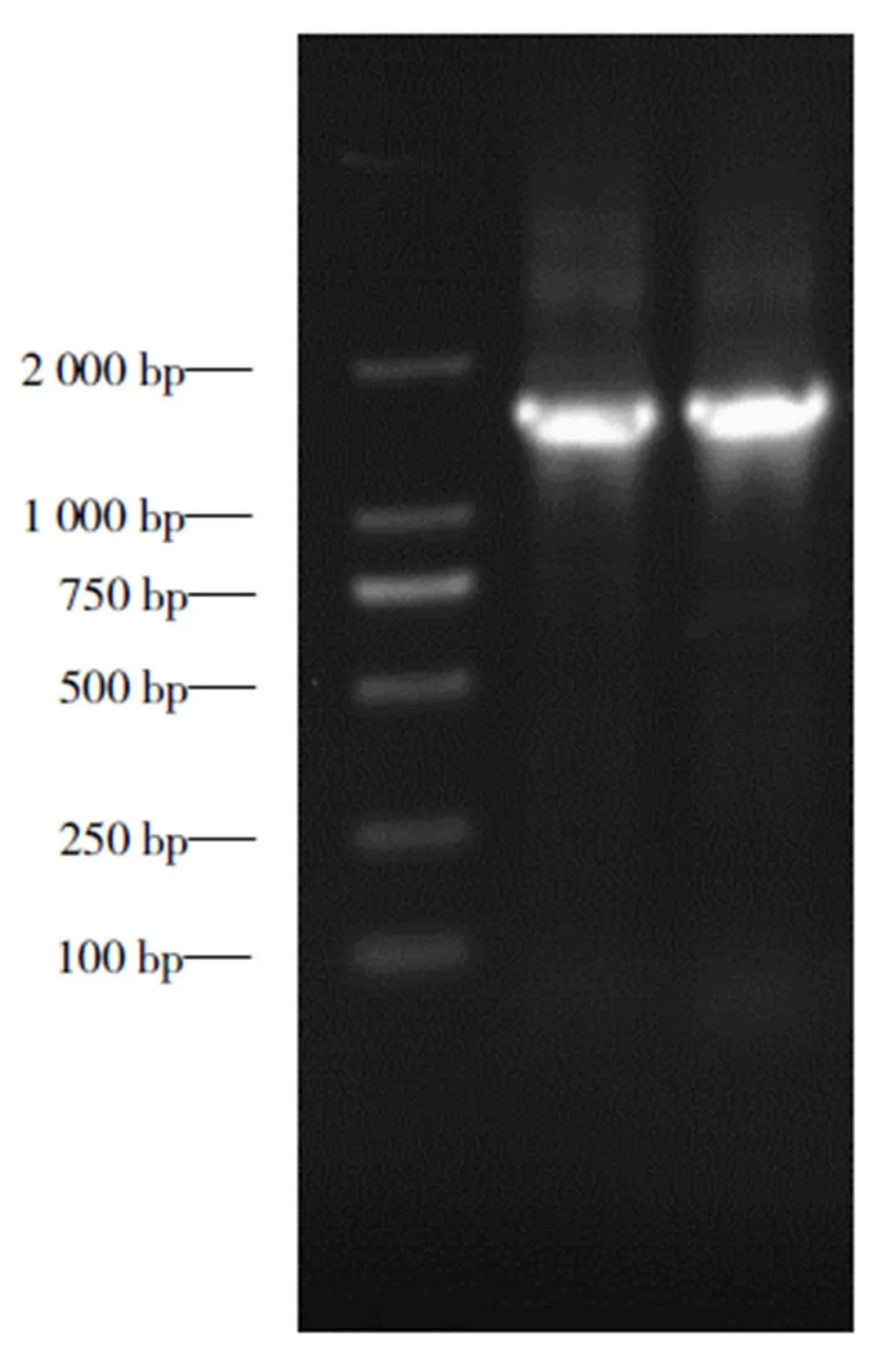
图2 菌株C0703的16S rDNA基因PCR扩增

图3 菌株C0703系统发育进化树分析
2.3 菌株C0703药敏特性
药敏试验结果显示,C0703菌株对阿莫西林、美罗培南、亚胺培南、链霉素、萘啶酸等药物高度敏感,对头孢噻肟、四环素、克林霉素等中度敏感;对氨苄西林、头孢唑啉、万古霉素等耐药(表2)。

表2 菌株C0703药敏特性
2.4 人工感染临床症状
草鱼发病临床症状主要表现为鳞片脱落、腐皮,尾部颜色变浅(图4A),解剖可见腹水,肝脏淤血,肠道出血,初步诊断为细菌性感染疾病。用C0703菌株人工腹腔注射草鱼感染12 h后,其出现发病、死亡现象,3 d累积死亡率达100%,感染草鱼临床症状主要表现为游动迟缓,鳞片脱落,停止摄食,尾部颜色变浅,腹部膨大、出血(图4B),解剖可见腹腔积水,肝淤血,肠壁出血(图4C)。人工感染发病死亡草鱼与自然发病症状基本相同,并且从发病死亡草鱼体内分离到与C0703菌株特征一致细菌。对照组草鱼观察7 d无发病死亡现象。

图4 菌株C0703感染草鱼临床症状
注:A为发病草鱼鳞片脱落、腐皮;B为腹部膨大、出血;C为肝淤血,肠壁出血
3 讨论
3.1 腐败希瓦氏菌的致病性
希瓦氏菌是水环境中常见的细菌,目前关于希瓦氏菌感染鱼类的报道较多[14]。许振伟等[22]将腐败希瓦氏菌接种于大黄鱼、大菱鲆无菌鱼块上,表明低温有氧条件下具有很强的腐败能力,对人类健康构成潜在的威胁。但是,针对致病性腐败希瓦氏菌分离鉴定鲜有报道[22-25]。研究表明,腐败希瓦氏菌是一种人兽共患病的病原菌,能够引起人类软组织感染[25]、心膜炎[26]等。近年来,腐皮病在水产动物养殖过程中频繁发生,给水产业造成重大经济损失[23-24]。本研究从患病草鱼体内分离到1株致病性腐败希瓦氏菌,人工感染试验显示,分离菌株C0703能够引起草鱼腐皮病。Pękala等[27]发现感染腐败希瓦氏菌的淡水鱼中,大多数临床症状为鳃部坏死、皮肤溃疡,解剖发现内脏出血、水肿。本文首次报道腐败希瓦氏菌感染草鱼病例,病鱼皮肤腐烂,解剖可见腹水,肝脏、肠道出血等,这与已有文献报道结果基本一致[27]。目前,关于草鱼腐皮病的病因及其致病机理有待进一步研究。
3.2 腐败希瓦氏菌的药敏特性
抗生素药物在水产养殖和疾病防控中应用广泛,且滥用药物现象时有发生,从而使鱼类疾病防治面临着新的挑战。本研究对鱼源腐败希瓦氏菌C0703菌株进行药敏试验,结果表明其对美罗培南、亚胺培南、链霉素、卡那霉素、诺氟沙星等药物敏感,对氨苄西林、复方新诺明、磺胺异恶唑等耐药。秦蕾等[19]对腐败希瓦氏菌的药敏结果显示,其对萘啶酸、恩诺沙星、左氟沙星等药物敏感,对万古霉素、磺胺异恶唑等药物耐药。苗淼等[14]对厦门希瓦氏菌的药敏结果显示,其对头孢哌酮、美罗培南、亚胺培南、阿奇霉素、卡那霉素等药物敏感,对氨苄西林、磺胺异恶唑、甲氧嘧啶等药物耐药。贾春红等[28]从方斑东风螺()中分离得到3株希瓦氏菌,进行药敏试验结果显示,鲍鱼希瓦氏菌对米诺环素、庆大霉素等敏感,对四环素、复方新诺明等药物耐药;海藻希瓦氏菌对左氟沙星、环丙沙星、氯霉素、链霉素、复方新诺明等药物敏感,对氨苄西林、克林霉素等药物耐药。以上希瓦氏菌属与本试验鱼源腐败希瓦氏菌的药敏结果基本一致。也有报道腐败希瓦氏菌对氯霉素、诺氟沙星、链霉素、复方新诺明等药物敏感,对阿米卡星、头孢哌酮、氨苄西林等药物耐药[28],这与鱼源腐败希瓦氏菌的药敏结果存在差异,可能与菌株来源、地域分布和临床药物使用等有关。以上研究报道腐败希瓦氏菌的药敏特性,为水产动物疾病防治提供了科学参考。
4 结论
本研究从患病草鱼体内分离到1株致病性腐败希瓦氏菌,药敏试验结果显示对美罗培南、亚胺培南、链霉素、卡那霉素、诺氟沙星等药物敏感。该结果为草鱼细菌性疾病防治提供科学依据。
[1] 程汉良,蒋飞,彭永兴,等. 野生与养殖草鱼肌肉营养成分比较分析[J]. 食品科学,2013,34(13):266-270.
[2] 陈少莲,刘肖芳,胡传林,等. 我国淡水优质草食性鱼类的营养和能学研究Ⅰ. 草鱼、团头鲂、长春鳊的生化成分和能值[J]. 海洋与湖沼,1992,23(2):193-205.
[3] 孙宏伟. 草鱼病综合防治技术[J]. 农技服务,2017,34(17):92.
[4] 倪达书. 我国三十年草鱼病研究的回顾与展望[J]. 湖南水产,1984(5):1-11.
[5] 李军,王铁辉. 草鱼出血病病毒的研究进展[J]. 海洋与湖沼,1999,30(4):445-453.
[6] 徐伯亥,葛蕊芳,熊木林. 二龄草鱼肠炎病发病机理[J]. 水生生物学报,1988,12(4):308-315.
[7] 夏润林. 草鱼主要寄生虫动态变化与水生态因子关系研究[D]. 大连:大连海洋大学,2014.
[8] 邓旗,孙力军,王雅玲,等. 环境条件对腐败希瓦氏菌生物被膜形成能力的影响[J]. 中国食品学报,2013,13(10):43-50.
[9] Derby H A,Hammer B W. Bacteriology of butter. IV: Bacteriological studies on surface taint butter[J]. Iowa Agricultural Experiment Station Research Bulletin,1931,145:385-416.
[10] Long H F,Hammer B W. Classification of the organisms important in dairy products III.[J].Iowa Agricultural Experimental Station Research Bulletin,1941,285:176-195.
[11] Baumann L,Baumann P,Mandel M,et al. Taxonomy of aerobic marine eubacteria[J]. Journal of Bacteriology,1972,110(1):402.
[12] Macdonell M T,Colwell R R. Phylogeny of the Vibrionaceae,and recommendation for two new genera,and[J]. Systematic & Applied Microbiology,1985,6(2):171-182.
[13] Huang J,Sun B,Zhang X.sp. nov.,isolated from coastal sea sediment[J]. International Journal of Systematic & Evolutionary Microbiology,2010,60(7):1585.
[14] 苗淼,吕爱军,胡秀彩,等. 锦鲤厦门希瓦氏菌的分离鉴定及药敏试验[J]. 南方农业学报,2018,49(1):172-177.
[15] Li S F,Zhang J D,Qiu D K,et al. Biological characteristics and pathogenicities ofandfrom[J]. Agricultural Science and Technology,2015,16(9):1845-1850,1859.
[16] Saeed M O,Alamoudi M M,Alharbi A H. Aassociated with disease in cultured rabbitfishin the Red Sea[J]. Diseases of Aquatic Organisms,1987,3(3):177-180.
[17] 吕俊超. 养殖大菱鲆病原菌的分离鉴定、组织病理学及免疫组织化学[D]. 青岛:中国海洋大学,2008.
[18] Koziñska A,Pêkala A. First isolation offrom freshwater fish-a potential new pathogen of the fish[J]. Bulletin-European Association of Fish Pathologists,2004,24:189-193.
[19] 秦蕾,张晓君,毕可然. 一种新的异育银鲫病原——腐败希瓦氏菌[J]. 微生物学报,2012,52(5):558-565.
[20] Brenner D J,Krieg N R,Staley J T,et al. Bergey’s manual of systematic bacteriology[J]. Springer:New York,2008,2(1):447-487.
[21] 沈德新,封志纯,杜江. 细菌DNA提取方法比较[J]. 中国实用医刊,2004,31(10):20-22.
[22] 许振伟,李学英,杨宪时,等. 海水鱼优势腐败菌腐败能力分析[J]. 食品与机械,2011,27(4):71-74.
[23] 黄艳华,施金谷,黄钧,等. 胡子鲶腐皮病病原菌的分离鉴定和药敏试验[J]. 广西畜牧兽医,2013,29(1):8-11.
[24] 张伟妮,朱志华,陈智伟,等. 日本鳗鲡腐皮病病原菌的分离及鉴定[J]. 淡水渔业,2010,40(2):41-46.
[25] Pagani L,Lang A,Vedovelli C,et al. Soft tissue infection and bacteremia caused by[J]. Journal of Clinical Microbiology,2003,41(5):2240.
[26] Dhawan B,Chaudhry R,Mishra B M,et al. Isolation offrom a rheumatic heart disease patient with infective endocarditis[J]. Journal of Clinical Microbiology,1998,36(8):2394.
[27] Pękala A,Kozińska A,Paździor E,et al. Phenotypical and genotypical characterization ofstrains isolated from diseased freshwater fish[J]. Journal of Fish Diseases,2015,38(3):283-293.
[28] 贾春红,李淑芳,张继东. 3株方斑东风螺病原希瓦氏菌对35种常用抗菌药物的敏感性试验[J]. 江西水产科技,2013(1):17-19.
责任编辑:张爱婷
Isolation, identification and antibiotic sensitivity of the pathogenic Shewanella putrefaciens from the grass carp
YE Ming-hao, HU Xiu-cai, LÜ Ai-junCorresponding Author, SUN Jing-feng, LIU Xiao-xue, BAI Jie
(Tianjin Key Lab of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China)
A bacterial strain was isolated from the grass carp(), and named C0703. The morphological observation, physiological and biochemical characteristics, sequencing of 16S rDNA and phylogenetic tree analysis were carried out in this study. Results showed that the C0703 strain was a rod-shaped, gram-negative bacillus; The isolated strain was positive for oxidase, esculin and nitrate reduction, and negative reaction for lysine decarboxylase and glucose etc. Furthermore, the 16S rDNA sequences were amplified by PCR method, to get fragment size of sequencing 1 409 bp. It had a 98.23% similarity with 16S rDNA sequence ofATCC 8071(NR 119141.1), and clustered into one group with(NR 119141.1), thus the C0703 strain was identified as. Animal experiment showed that the isolated strain has pathogenic to grass carp and causeddeath with a 100% rate, which were consistent with the natural symptoms of diseased fishes. The antibiotic susceptibility testing showed that it was sensitive to amoxicillin, meropenem and nalidixic acid etc, but resistant to ampicillin, cefazolin and vancomycin etc. This study firstly reported the isolation and identification offrom grass carp, which will provide a scientific reference for prevention and treatment in fishes.
grass carp;; 16S rDNA; physiological and biochemical; antibiotic sensitivity test
1008-5394(2018)04-0052-06
10.19640/j.cnki.jtau.2018.04.012
S917.1
A
2018-08-10
国家大学生创新训练计划项目(201810061036);天津市自然科学基金项目(16JCZDJC33500,18JCYBJC29900);天津市水产产业技术体系创新团队(ITTFRS2017009);天津农学院综投平台项目(J01009030638);天津市高等学校“创新团队培养计划”现代水产生态健康养殖项目(TD13-5089)
叶明皓(1995-),男,硕士在读,主要从事水产动物微生物与免疫学的研究。E-mail: 1084395663@qq.com。
吕爱军(1973-),男,教授,博士,主要从事水产动物微生物与免疫学的研究。E-mail: lajand@126.com。

