基于不同沉淀方法检测小鼠心脏组织中S-棕榈酰化蛋白
程 炜 占方玲 李水明 杨静波 王 勇* 刘 宁*
1(吉林大学第二医院中心实验室,教育部人兽共患病研究重点实验室,长春 130041)2(深圳大学生命与海洋科学学院,深圳 518060)
1 引 言
蛋白质的脂肪酰化现象最早由Lee等[1]发现,并通过研究发现脂肪酰化蛋白丰度最高的组织是脑白质,其次是灰质和心肌。Schmidt等[2]首次提出棕榈酰化的概念,利用[3H]棕榈酸标记的辛德毕斯病毒颗粒感染细胞,发现脂肪酸链通过硫酯键与糖蛋白中的半胱氨酸残基连接,同时,质谱分析表明脂肪酸部分主要为棕榈酸酯。与肉豆蔻酰化等过程不同,棕榈酰化是唯一可逆的脂质修饰,并且易被羟胺特异性切割[3],动态棕榈酰化(棕榈酰化-脱棕榈酰化)已经成为调节许多重要蛋白质结构和功能的重要机制[4]。
随着蛋白质组学技术的发展,越来越多的方法应用到蛋白质棕榈酰化修饰的研究中,如生物信息学预测法、放射性棕榈酸盐代谢标记法、点击化学法以及酰基-生物素置换法(Acyl-biotinyl exchange,ABE)等。最经典的方法是用放射性棕榈酸盐代谢标记,通过放射自显影检测同位素标记的程度,检测棕榈酰化修饰的蛋白质。此外,将含叠氮或炔基的棕榈酸类似物代谢进入蛋白质,然后通过点击化学方法,选择性地将带叠氮或炔基基团的蛋白质连接到生物素或荧光基团上,从而富集和检测棕榈酰化蛋白质。相比于代谢标记等方法,在检测组织中的棕榈酰化蛋白时,尤其是在临床样本的检测中,ABE法具有不可替代的优势,同时,ABE法还具有反应速度快和高灵敏度的特点,因此得到广泛应用[5]。利用ABE方法,Wei等[6]对人脐静脉内皮细胞进行定量蛋白质组学分析,鉴定出380种棕榈酰化蛋白质,其中200种以上是未知的棕榈酰化蛋白质[6]。Dowal等[7]从分离的血小板膜中鉴定出215种具有代表性的血小板棕榈酰化蛋白,包括51种已知的棕榈酰化蛋白质、61种在其它棕榈酰化特异性蛋白质组学研究中鉴定出的棕榈酰化蛋白质、103种新的棕榈酰化蛋白质。另外,蛋白质棕榈酰化修饰在神经系统疾病和癌症中具有较为广泛应用[8]。在人类额叶皮质中鉴定出219种棕榈酰化蛋白质,并且在精神分裂症中蛋白质的棕榈酰化修饰程度显著降低[9]。在小鼠大脑中鉴定的300多种棕榈酰化蛋白质中有19种在亨廷顿氏病模型中存在错误调节[10]。癌症相关信号的通路中(如Hippo信号通路,Ras信号通路和EGFR信号通路等)都有棕榈酰化的参与及调节[11]。Runkle等[12]利用ABE方法鉴定出EGFR的C-末端尾部的3种半胱氨酸残基是棕榈酰化修饰位点,棕榈酰化修饰的缺失会使EGFR信号持续激活,并使细胞对EGFR酪氨酸激酶抑制剂敏感。此外,蛋白质棕榈酰化修饰还涉及心脏相关疾病,但是总体研究较少。Pei等[12]研究表明,电压门控钠通道(Nav1.5)中4种半胱氨酸为棕榈酰化的修饰位点,棕榈酰化的改变可以调控Nav1.5的功能进而影响心脏的兴奋性,并且这种翻译后修饰可能是获得性和先天性心律失常的重要影响因素[13]。Zhou等[14]通过构建酰基转移酶Aph2(DHHC16)缺陷型小鼠,使受磷蛋白(Phospholamban,PLN)棕榈酰化修饰缺失,发现Aph2-/-胚胎和幼崽出现明显的心肌病表型,包括心功能减退、组织学异常及心动过缓等,这表明蛋白质棕榈酰化在心脏发育中具有一定作用。
与其它方法相比,ABE方法具有快速、高灵敏度,以及可应用于细胞、组织和体液等多种样本的优势[15],但也存在假阳性高、初始样本量需求大等局限性。通过对与ABE方法有关的研究总结发现,在去除杂质的过程中,大多数研究均使用甲醇-氯仿沉淀法,少数研究使用丙酮沉淀法。本课题组早期研究发现,沉淀过程对蛋白的影响较大。本研究通过比较ABE反应过程中沉淀蛋白质方法的不同,探究了蛋白质沉淀方法对ABE反应以及结果的影响。
2 实验部分
2.1 仪器与试剂
TripleTOF 5600质谱仪(美国 Applied Biosystems 公司); 全自动组织匀浆仪及组织裂解管(德国 Roche 公司); 低速离心机(美国Thermo公司); 恒温培养箱(上海精宏实验设备有限公司); 四维旋转混匀器(海门市其林贝尓仪器有限公司); Mini-PROTEAN Tetra Cell 垂直电泳仪(美国Bio-Rad公司); 脱色摇床(荣华仪器制造有限公司); pH试纸(美国Micro Essential Laboratory公司); Milli-Q纯水仪、 聚偏氟乙烯(PVDF) 膜(美国Millipore 公司); 微量离心机(美国Thermo Scientific公司); PowerLook2100XL-USB with UTA & Magic Scan凝胶成像仪(美国UMAX公司); 一体式化学发光成像系统(上海勤翔科学仪器有限公司)。
NaOH、Na2S2O3、EDTA、Na2CO3、KH2PO4、KCl、乙醇、三氯甲烷、乙酸、丙酮(北京化工厂); DMF、DMSO(美国Alfa Aesar公司); Triton X-100、Tris、Na2HPO4、NaCl、DTT(美国Vetec公司); 盐酸羟胺、NEM、PMSF、Biotin-maleimide(美国Sigma Aldrich公司); Biotin-HPDP(美国ApexBio公司); 链霉亲和素修饰琼脂糖树脂(美国Thermo公司); 测序级TPCK修饰的胰蛋白酶(美国Promega公司); 链霉亲和素标记的辣根过氧化物酶(美国 Invitrogen 公司)。
2.2 实验方法
2.2.1小鼠心脏组织取材首先称量小鼠的体重,给小鼠腹腔注射0.3%戊巴比妥钠(剂量15 μL/g)。麻醉后将其用针头固定在泡沫板上,快速剪开小鼠胸腔,将注射针头插入小鼠左心室,灌注预冷的PBS,充分灌洗心脏,使心脏中血液尽可能排尽。摘取心脏后置于预冷的PBS中再次灌洗。用眼科剪及镊子剔除粘附在心脏上的结缔组织后,用滤纸吸干心脏表面的水分,称量心脏重量,保存于液氮中。
2.2.2酰基-生物素置换反应(ABE) 配制裂解缓冲液(pH 7.4,150 mmol/L NaCl,50 mmol/L Tris-HCl,5 mmol/L EDTA)。取两颗小鼠心脏组织切碎,分两份置于组织裂解管中,每管加入500 μL封闭缓冲液(含10 mmol/L NEM,2 mmol/L PMSF,1.7% Triton的裂解缓冲液),用组织匀浆仪4000 r/min进行组织匀浆,每次1 min,间歇5 min,置于冰上,重复4~6次后,用四维旋转混匀器于4℃翻转混匀1 h。在4℃以250 g离心5 min,去除不溶物,吸取上清液至同一管中,再均分为A、B两组。A组进行丙酮沉淀(5倍体积的冷冻丙酮,-20℃,3 h,4000 r/min离心5 min,收取沉淀); B组进行甲醇-氯仿沉淀(4倍体积的冷冻甲醇,1.5倍体积的冷冻氯仿,3倍水混匀,4000 r/min,离心20 min,去除上层相。再缓慢加入3倍体积的冷冻甲醇,轻轻混匀,4000 r/min离心10 min,收取沉淀)。两组沉淀分别加入300 μL包含10 mmol/L NEM 的4SB(4% SDS,50 mmol/L Tris-HCl,5 mmol/L EDTA),37℃,溶解蛋白10 min。再加入900 μL包含1 mmol/L NEM,1 mmol/L PMSF,0.2%Triton X-100的裂解缓冲液,4℃翻转过夜后,A组再次进行3次丙酮沉淀,B组再次进行3次甲醇-氯仿沉淀,以除去多余未反应的NEM。每次沉淀后加入300 μL 4SB,37℃,溶解蛋白10 min,再加入900 μL裂解缓冲液。最后一次加入500 μL 4SB溶解蛋白后,A、B两组各取240 μL,加入960 μL含有HA 的缓冲液(+HA组,pH 7.4,0.7 mol/L HA,1 mmol/L HPDP-Biotin,0.2% Triton X-100,1 mmol/L PMSF)。另取一份240 μL加入960 μL无HA的缓冲液(-HA组,pH 7.4,50 mmol/L Tris-HCl,1 mmol/L HPDP-Biotin,0.2% Triton X-100,1 mmol/L PMSF)作为对照组,室温翻转1 h。A组+/-HA进行一次丙酮沉淀,B组+/-HA进行一次甲醇-氯仿沉淀,以除去多余的羟胺。240 μL 4SB 溶解沉淀,加入960 μL Low HPDP-Biotin 缓冲液(pH 7.4,150 mmol/L NaCl,50 mmol/L Tris-HCl,5 mmol/L EDTA,0.2 mmol/L HPDP-Biotin,0.2% Triton X-100,1 mmol/L PMSF),室温翻转1 h。若使用生物素化试剂Biotin-maleimide进行标记,则终浓度为1 μmol/L。生物素标记后的A组进行3次丙酮沉淀,B组进行3次甲醇-氯仿沉淀,以除去多余的HPDP-Biotin。每次沉淀后加入300 μL 4SB,37℃,溶解蛋白10min,再加入900 μL裂解缓冲液。最后一次沉淀后,每管样品加入120 μL 2SB(2% SDS,50 mmol/L Tris-HCl,5 mmol/L EDTA),37℃保持10 min,溶解蛋白[16]。
2.2.3S-棕榈酰化蛋白富集取15 μL链霉亲和素琼脂糖树脂加入1 mL裂解缓冲液(0.1% SDS,0.2% Triton X-100)平衡,8200 g离心30 s后,去除上清液。用裂解缓冲液(0.2% Triton X-100,1 mmol/L PMSF)将120 μL 2SB溶解的蛋白稀释20倍,室温翻转30 min,15000 g离心1 min,取上清液,加入平衡后的链霉亲和素琼脂糖树脂,室温翻转1.5 h,8200 g离心30 s,去除上清液。1 mL裂解缓冲液(0.1% SDS,0.2% Triton X-100)洗涤4次,1 mL裂解缓冲液洗涤3次,50 mmol/L NH4HCO3洗涤3次。每次加入洗涤液后,翻转5 min,8200 g离心30 s,小心吸除上清液。以 50 μL洗脱液(50 mmol/L NH4HCO3,50 mmol/L DTT)洗脱蛋白,37℃孵育30 min,15000 g离心1 min,取上清液,-20℃保存[16]。
2.2.4WesternBlot检测ABE反应取等量的+/-HA两组样品,加入5倍上样缓冲液,沸水煮样5 min后,进行Western Blot实验。将PVDF膜封闭过夜后,1∶3000稀释的Streptavidin-HRP孵育1 h,洗涤后进行显影,对比+/-HA两组条带深浅的差别。
2.2.5银染检测样品进行电泳后,将聚丙烯酰胺凝胶用30%甲醇,10%乙酸,固定20 min; 20%甲醇,清洗20 min; 超纯水清洗10 min; 0.02% (w/V)Na2S2O3致敏1 min; 超纯水清洗两次,每次1 min; 预冷的0.2% (w/V)AgNO3染色20 min; 超纯水清洗两次,每次1 min; 用2%(w/V)无水Na2CO3,0.04%甲醛进行显色; 待显色至一定程度后,用5%乙酸终止。
2.2.6质谱检测S-棕榈酰化蛋白在样品中加入适量的胰酶,37℃水解过夜。在肽段样品中加入适量0.1%三氟乙酸(TFA)后上样。色谱条件: 将毛细管C18色谱柱(ChromXP,Eksigent Technologies,150 mm×75 μm×3.0 μm)与纳升级液相柱(Eksigent-nanoLC pump)结合; 流动相A为2%乙腈-0.1%甲酸,B为98% 乙腈-0.1%甲酸; 梯度洗脱程序: 0~60 min,5%~30% B; 60~75 min,28%~42% B; 75~85 min,42%~85% B; 流速为: 300 nL/min。Nano-LC-MS/MS 分析条件: 多肽经毛细管C18色谱柱洗脱后,用TripleTOF 5600质谱仪进行分析。然后用信息依赖采集方式进行二级质谱扫描,离子质荷比范围为m/z350~1250,离子带电数目选择为2~5,将碰撞能量设定成滚动方式。本研究采用MS-GF+数据处理软件进行数据分析,具体设置为: 胰蛋白酶特异性消化,允许两次错误切割,肽段允许误差为20 ppm,碎片离子允许误差为0.5 Da。在鉴定结果中,+HA组肽段峰强度大于-HA组肽段3倍以上的蛋白被认为是具有S-棕榈酰化修饰的阳性结果。
3 结果与讨论
3.1 酰基-生物素置换法标记S-棕榈酰化蛋白
在一定条件下,经羟胺处理,可将蛋白质中的棕榈酸与半胱氨酸巯基相连的硫酯键切断,暴露出被棕榈酸修饰的巯基,从而利用巯基反应性生物素化试剂(HPDP-Biotin或Biotin-maleimide)对新产生的半胱氨酸巯基进行生物素标记。由于生物体系复杂,可能存在内源性生物素化蛋白或者可与HPDP-Biotin或Biotin-maleimide反应的基团,这些因素可能会导致假阳性。因此,通过设立-HA对照组减少假阳性结果的影响。在本研究前期工作中,通过Western Blot方法检测每次沉淀后的样品发现,随着沉淀次数增加,沉淀过程对蛋白的影响越来越大(图1)。在将小鼠心脏组织分别进行+HA及-HA反应后,经Western Blot检测(图2),+HA组部分蛋白条带(以箭头标注)与-HA组同等位置蛋白条带相比颜色较深,表明此蛋白为潜在的S-棕榈酰化修饰蛋白,而+/-HA组均存在的蛋白默认为存在假阳性结果(以短线标注)。
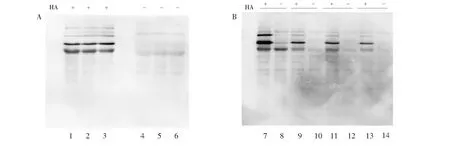
图1 Western Blot检测不同沉淀方法对S-棕榈酰化修饰蛋白富集的影响; 1、2和3泳道分别为有HA实验组经第1、2和3次沉淀后的样品; 4、5和6泳道分别为无HA对照组经第1、2和3次沉淀后的样品; 7、9、11和13分别为有HA实验组经第4、5、6和7次沉淀后的样品; 8、10、12和14分别为无HA对照组经第4、5、6和7次沉淀后的样品Fig.1 Western Blot detection of effect of precipitation on proteins; 1, 2 and 3 are samples of the experimental HA group after the first, second and third precipitation, respectively; 4, 5 and 6 are samples after the first, second and third precipitation of the HA-free control group; 7, 9, 11 and 13 are the samples after the 4th, 5th, 6th and 7th precipitation of the HA experimental group; 8, 10, 12 and 14 are the samples after the 4th, 5th, 6th and 7th precipitation in the HA-free control group, respectively

图2 Western Blot检测酰基-生物素置换法标记的S-棕榈酰化蛋白(箭头标注为S-棕榈酰化修饰蛋白,短线标注为假阳性结果)Fig.2 Western Blot detection of S-palmitoylated protein labeled by acyl-biotin exchange (The arrow is labeled S-palmitoylated modified protein, and the short line is marked as a false positive result)
3.2 S-棕榈酰化蛋白的富集与分离
酰基-生物素置换反应后的蛋白质样品(+/-HA两组)经过丙酮沉淀或甲醇-氯仿沉淀处理后,除去未反应的HPDP-Biotin,再利用链霉亲和素琼脂糖树脂对已经被Biotin标记的蛋白进行富集及纯化。由图3可见,小鼠心脏组织中的S-棕榈酰化修饰蛋白在羟胺作用下可以发生酰基-生物素置换,从而能够被链霉亲和素琼脂糖树脂高效地富集纯化; 而未经过羟胺处理的对照样品则不能进行酰基-生物素置换反应,便不能被富集纯化。Input条带为ABE反应后而未经富集的总蛋白,可以看出+/-HA两组总蛋白初始量相同。Pull down条带是经链霉亲和素琼脂糖树脂富集后洗脱下来的蛋白,可以判断+HA组洗脱出的蛋白为经ABE反应后被标记的S-棕榈酰化蛋白,而-HA组非常浅的蛋白条带为链霉亲和素树脂非特异性吸附的蛋白。这说明本方法用于富集S-棕榈酰化蛋白的特异性较高。
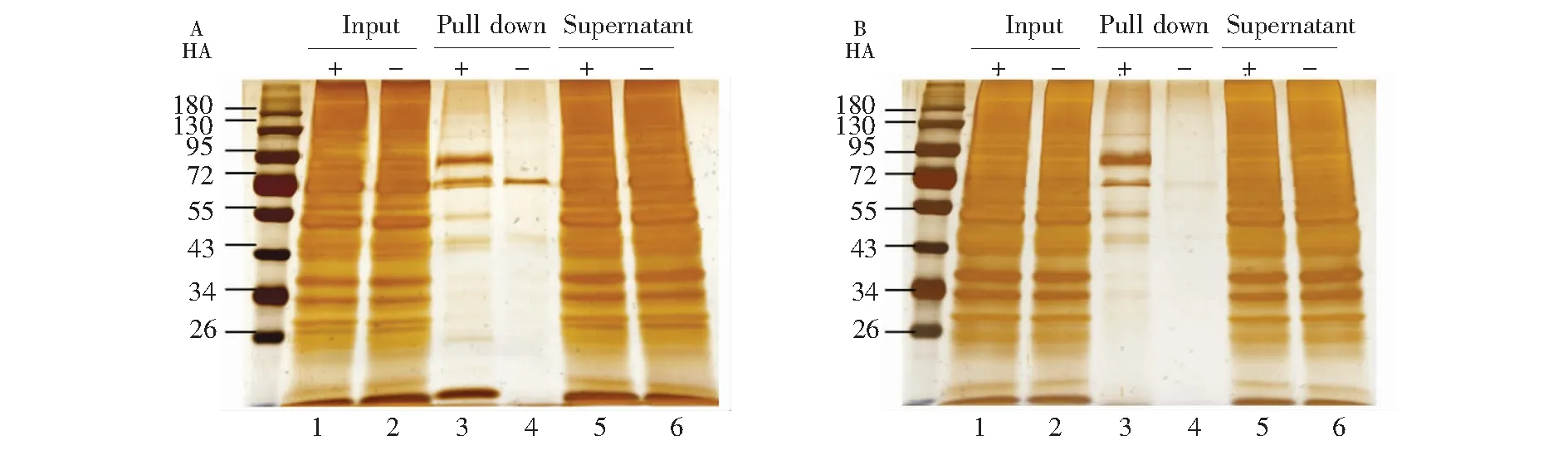
图3 银染检测S-棕榈酰化蛋白的富集及纯化(A) 丙酮沉淀实验组; 1. ABE反应后的(+HA)样品; 2. ABE反应后的(-HA)样品; 3. 经链霉亲和素纯化后的(+HA)样品; 4. 经链霉亲和素纯化后的(-HA)样品; 5. 经链霉亲和素纯化后的(+HA)上清液; 6. 经链霉亲和素纯化后的(-HA)上清液; (B)甲醇-氯仿实验组; 1. ABE反应后的(+HA)样品; 2. ABE反应后的(-HA)样品; 3. 经链霉亲和素纯化后的(+HA)的样品; 4. 经链霉亲和素纯化后的(-HA)样品; 5. 经链霉亲和素纯化后的(+HA)上清液; 6. 经链霉亲和素纯化后的(-HA)上清液Fig.3 Enrichment and purification of S-palmitoylated protein indicated by silver staining(A) Acetone precipitation experimental group; 1. Sample(+HA) after ABE reaction; 2.Sample (-HA) after ABE reaction; 3. Sample (+HA) after streptavidin purification; 4.Sample (-HA) after purification of streptavidin; 5. Supernatant (+HA) purified by streptavidin; 6. Supernatant (-HA) purified by streptavidin; (B) Methanol-chloroform experimental group; 1. Sample(+HA) after ABE reaction; 2.Sample (-HA) after ABE reaction; 3. Sample (+HA) after streptavidin purification; 4. Sample (-HA) after purification of streptavidin; 5. Supernatant (+HA) purified by streptavidin; 6. Supernatant (-HA) purified by streptavidin
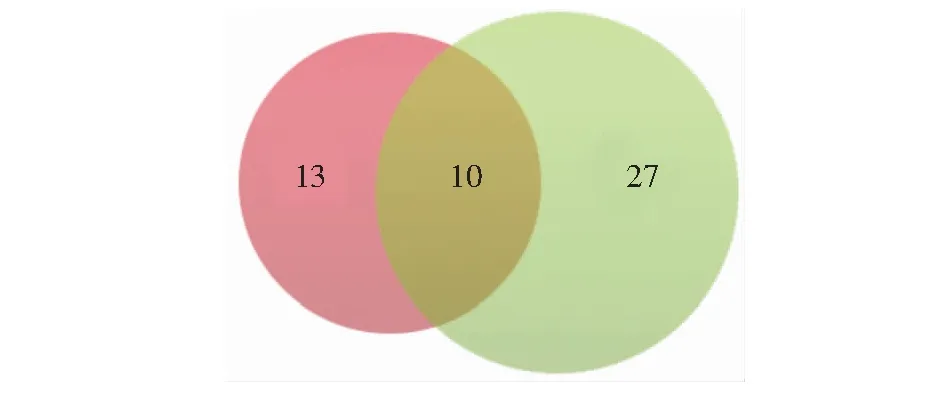
图4 两种沉淀方法中重复鉴定的S-棕榈酰化蛋白Fig.4 Experimental overlap of S-palmitoylated protein by two precipitation methods
3.3 小鼠心脏组织中S-棕榈酰化蛋白的质谱分析
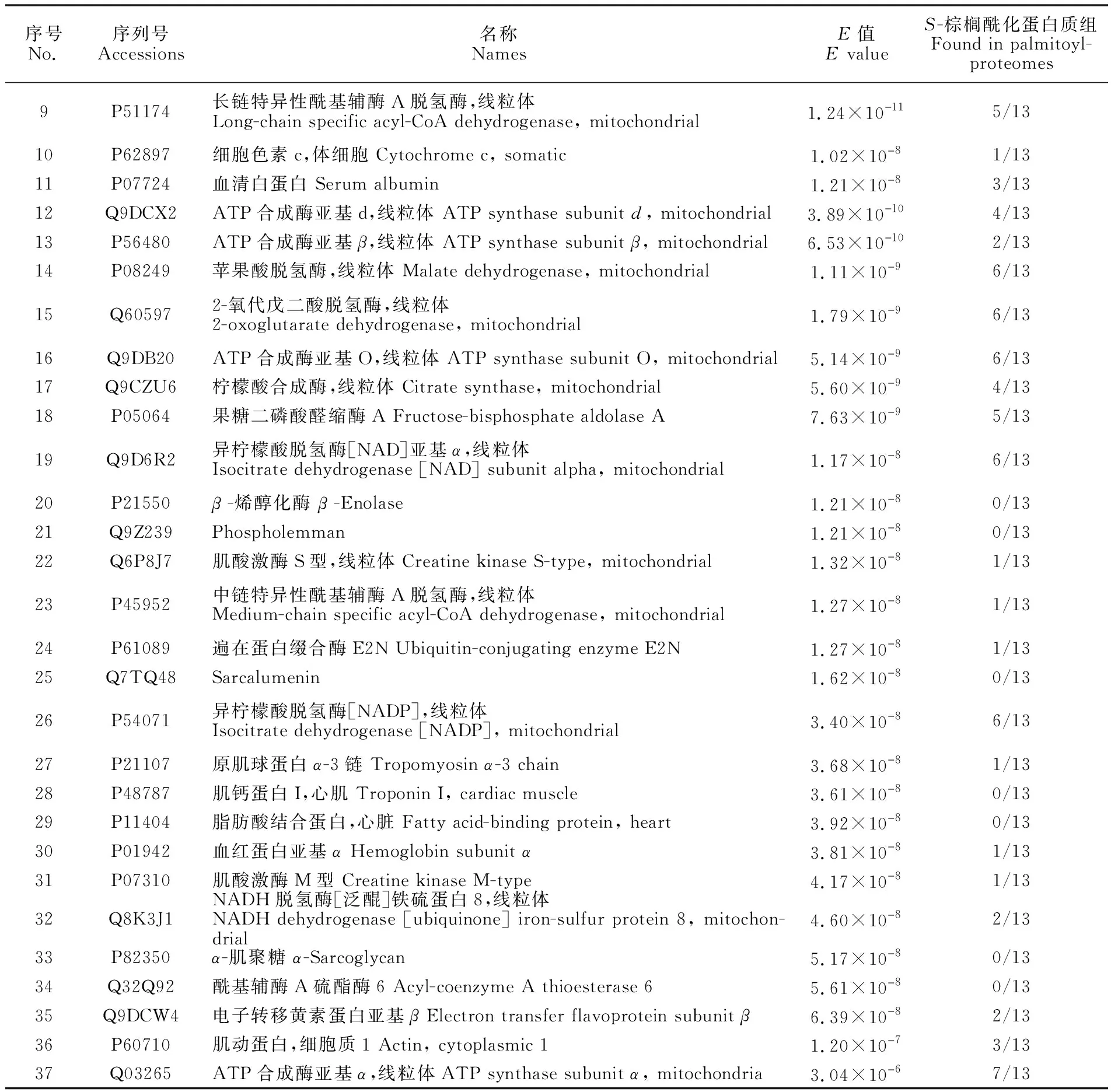
采用液相色谱-质谱联用技术得到样品中肽段的串联质谱数据,经MS-GF+数据处理软件在蛋白数据库中进行检索分析。本研究中的每种沉淀方法分别进行了3次生物学重复,再将3次重复实验得到的样品分别进行混合得到4种样品(丙酮沉淀±HA; 甲醇-氯仿沉淀±HA),然后利用质谱技术分别对这4种样品进行分析,每种样品进行2次技术重复。本研究共鉴定出50种S-棕榈酰化蛋白(图4),基于丙酮沉淀的ABE方法共鉴定出23种S-棕榈酰化蛋白(表1),甲醇-氯仿沉淀方法共鉴定出37种S-棕榈酰化蛋白(表2),序号1~10为两种沉淀方法共同鉴定出的S-棕榈酰化蛋白。本研究中有14种棕榈酰化蛋白未在其它棕榈酰化蛋白质组研究中发现。表2中,E值代表蛋白质鉴定可信度,本研究中筛选条件为E<0.05。棕榈酰化蛋白质组一列表示此蛋白已在棕榈酰化蛋白质组研究中发现的次数(SwissPalm数据库)。根据细胞区室划分,所鉴定出的S-棕榈酰化蛋白主要为胞内蛋白,其次为细胞器组分(图5)。此外,根据分子功能划分可以发现具有催化活性的蛋白数量最多,占所鉴定总蛋白的50%(图6)。同时,不同沉淀方法对-HA对照组也具有一定影响,在丙酮沉淀中-HA对照组有17种蛋白,而甲醇-氯仿中仅有4种蛋白。
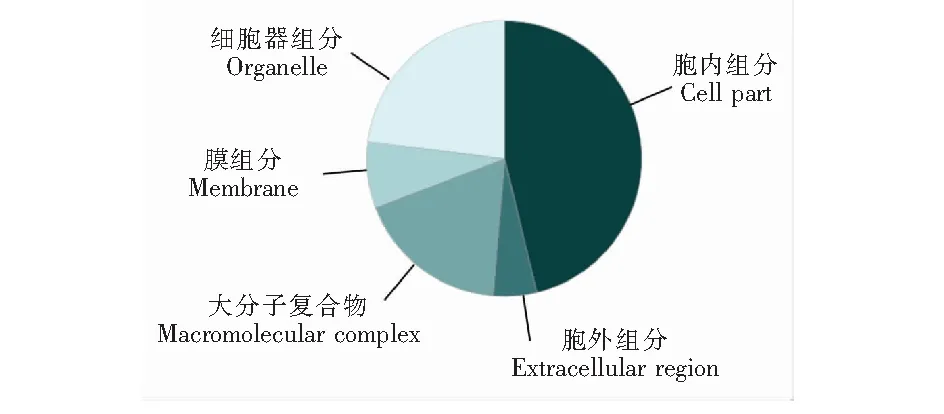
图5 按细胞组分对已鉴定出的S-棕榈酰化蛋白进行的分类Fig.5 Cellular compartment of proteins identified as S-palmitoylated

图6 按功能对已鉴定出的S-棕榈酰化蛋白进行分类Fig.6 Functional classification of proteins identified as S-palmitoylated
表1 丙酮沉淀方法中质谱鉴定出的S-棕榈酰化蛋白
Table 1S-Palmitoylated protein identified by mass spectrometry using acetone precipitation method

序号No.序列号Accessions名称NamesE值E valueS-棕榈酰化蛋白质组Found in palmitoyl-proteomes1Q8BMF4丙酮酸脱氢酶复合物,线粒体的二氢脂酰赖氨酸残基乙酰转移酶组分Dihydrolipoyllysine-residue acetyltransferase component of pyruvate dehydrogenase complex, mitochondrial1.26 × 10儊83/132O09044突触体相关蛋白23Synaptosomal-associated protein 234.89× 10儊107/133Q9D2G22-羟基戊二酸脱氢酶复合物的二氢脂酰赖氨酸残基琥珀酰转移酶,线粒体Dihydrolipoyllysine-residue succinyltransferase component of 2-oxogl-utarate dehydrogenase complex, mitochondrial3.40× 10儊32/134Q8BWT13-酮脂酰辅酶A硫解酶,线粒体3-ketoacyl-CoA thiolase, mitochondrial2.89× 10儊119/135Q99KI0乌头酸水合酶,线粒体 Aconitate hydratase, mitochondrial1.58× 10儊1010/136Q8QZT1乙酰辅酶A转移酶,线粒体 Acetyl-CoA acetyltransferase, mitochon-drial2.22× 10儊97/137Q08857血小板糖蛋白4 Platelet glycoprotein 42.68× 10儊86/138P50462半胱氨酸和富含甘氨酸的蛋白质3 Cysteine and glycine-rich protein 32.70× 10儊80/139P51174长链特异性酰基辅酶A脱氢酶,线粒体Long-chain specific acyl-CoA dehydrogenase, mitochondrial1.24× 10儊115/1310P62897细胞色素c,体细胞 Cytochrome c, somatic1.02× 10儊81/1311P08228超氧化物歧化酶[Cu-Zn] Superoxide dismutase [Cu-Zn]1.65× 10儊71/1312P29391铁蛋白轻链1 Ferritin light chain 1)2.84× 10儊32/1313P09671超氧化物歧化酶[Mn],线粒体Superoxide dismutase [Mn], mitochondrial5.46× 10儊102/1314P05201天冬氨酸氨基转移酶,细胞质 Aspartate aminotransferase, cytoplas-mic1.43× 10儊93/1315Q5I2A0丝氨酸蛋白酶抑制剂A3G Serine protease inhibitor A3G1.26× 10儊80/1316P04247肌红蛋白 Myoglobin4.38× 10儊80/1317E9Q784锌指含CCCH结构域的蛋白质13 Zinc finger CCCH domain-contai-ning protein 137.63× 10儊80/1318Q3UR70转化生长因子-β受体相关蛋白1Transforming growth factor-beta receptor-associated protein 18.25× 10儊80/1319Q9ERR7硒蛋白F Selenoprotein F8.83× 10儊80/1320Q91XL1富含亮氨酸的HEV糖蛋白 Leucine-rich HEV glycoprotein9.60× 10儊80/1321Q9CQA3琥珀酸脱氢酶[泛醌]铁硫亚基,线粒体Succinate dehydrogenase [ubiquinone] iron-sulfur subunit, mitochon-drial9.61× 10儊84/1322P49945铁蛋白轻链2 Ferritin light chain 21.14× 10儊71/1323P09528铁蛋白重链 Ferritin heavy chain4.93× 10儊114/13
表2 甲醇-氯仿沉淀方法中质谱鉴定出的S-棕榈酰化蛋白
Table 2S-Palmitoylated protein identified by mass spectrometry by methanol-chloroform precipitation method

序号No.序列号Accessions名称NamesE值E valueS-棕榈酰化蛋白质组Found in palmitoyl-proteomes1Q8BMF4丙酮酸脱氢酶复合物,线粒体的二氢脂酰赖氨酸残基乙酰转移酶组分Dihydrolipoyllysine-residue acetyltransferase component of pyruvate dehydrogenase complex, mitochondrial2.59×10儊93/132O09044突触体相关蛋白23 Synaptosomal-associated protein 231.42×10儊107/133Q9D2G22-羟基戊二酸脱氢酶复合物的二氢脂酰赖氨酸残基琥珀酰转移酶组分,线粒体Dihydrolipoyllysine-residue succinyltransferase component of 2-oxogl-utarate dehydrogenase complex, mitochondrial3.78×10儊102/134Q8BWT13-酮脂酰辅酶A硫解酶,线粒体 3-ketoacyl-CoA thiolase, mitochon-drial3.89×10儊109/135Q99KI0乌头酸水合酶,线粒体 Aconitate hydratase, mitochondrial1.83×10儊96/136Q8QZT1乙酰辅酶A转移酶,线粒体 Acetyl-CoA acetyltransferase, mitochon-drial2.96×10儊87/137Q08857血小板糖蛋白4 Platelet glycoprotein 49.12×10儊86/138P50462半胱氨酸和富含甘氨酸的蛋白质3 Cysteine and glycine-rich protein 38.69×10儊80/13
续表2(Continued to Table 2)
序号No.序列号Accessions名称NamesE值E valueS-棕榈酰化蛋白质组Found in palmitoyl-proteomes9P51174长链特异性酰基辅酶A脱氢酶,线粒体Long-chain specific acyl-CoA dehydrogenase, mitochondrial1.24×10儊115/1310P62897细胞色素c,体细胞 Cytochrome c, somatic1.02×10儊81/1311P07724血清白蛋白 Serum albumin1.21×10儊83/1312Q9DCX2ATP合成酶亚基d,线粒体 ATP synthase subunit d, mitochondrial3.89×10儊104/1313P56480ATP合成酶亚基β,线粒体 ATP synthase subunit β, mitochondrial6.53×10儊102/1314P08249苹果酸脱氢酶,线粒体 Malate dehydrogenase, mitochondrial1.11×10儊96/1315Q605972-氧代戊二酸脱氢酶,线粒体2-oxoglutarate dehydrogenase, mitochondrial1.79×10儊96/1316Q9DB20ATP合成酶亚基O,线粒体 ATP synthase subunit O, mitochondrial5.14×10儊96/1317Q9CZU6柠檬酸合成酶,线粒体 Citrate synthase, mitochondrial 5.60×10儊94/1318P05064果糖二磷酸醛缩酶A Fructose-bisphosphate aldolase A7.63×10儊95/1319Q9D6R2异柠檬酸脱氢酶[NAD]亚基α,线粒体Isocitrate dehydrogenase [NAD] subunit alpha, mitochondrial1.17×10儊86/1320P21550β -烯醇化酶 β -Enolase1.21×10儊80/1321Q9Z239Phospholemman1.21×10儊80/1322Q6P8J7肌酸激酶S型,线粒体 Creatine kinase S-type, mitochondrial1.32×10儊81/1323P45952中链特异性酰基辅酶A脱氢酶,线粒体Medium-chain specific acyl-CoA dehydrogenase, mitochondrial1.27×10儊81/1324P61089遍在蛋白缀合酶E2N Ubiquitin-conjugating enzyme E2N1.27×10儊81/1325Q7TQ48Sarcalumenin1.62×10儊80/1326P54071异柠檬酸脱氢酶[NADP],线粒体Isocitrate dehydrogenase [NADP], mitochondrial3.40×10儊86/1327P21107原肌球蛋白α-3链 Tropomyosin α-3 chain3.68×10儊81/1328P48787肌钙蛋白I,心肌 Troponin I, cardiac muscle3.61×10儊80/1329P11404脂肪酸结合蛋白,心脏 Fatty acid-binding protein, heart3.92×10儊80/1330P01942血红蛋白亚基α Hemoglobin subunit α3.81×10儊81/1331P07310肌酸激酶M型 Creatine kinase M-type4.17×10儊81/1332Q8K3J1NADH脱氢酶[泛醌]铁硫蛋白8,线粒体NADH dehydrogenase [ubiquinone] iron-sulfur protein 8, mitochon-drial4.60×10儊82/1333P82350α-肌聚糖 α-Sarcoglycan5.17×10儊80/1334Q32Q92酰基辅酶A硫酯酶6 Acyl-coenzyme A thioesterase 65.61×10儊80/1335Q9DCW4电子转移黄素蛋白亚基β Electron transfer flavoprotein subunit β6.39×10儊82/1336P60710肌动蛋白,细胞质1 Actin, cytoplasmic 11.20×10儊73/1337Q03265ATP合成酶亚基α,线粒体ATP synthase subunit α, mitochondria3.04×10儊67/13
4 结 论
利用ABE反应和质谱技术等对小鼠心脏组织中S-棕榈酰化蛋白进行整体分析,发现基于不同蛋白沉淀方法的酰基-生物素置换(ABE)反应鉴定出的蛋白质在数量及类型上均有一定差别,在后续的研究中可同时使用不同的沉淀方法进行互补,从而使实验结果更加完善,为大规模研究S-棕榈酰化蛋白质组提供了一种新的优化方向。

