基于细胞代谢组学技术的人参皂苷Rb1对SH-SY5Y细胞保护机制研究
杨银平 律广富 张 乔 姚梦杰 梁新合 李 茎 张 辉 孙佳明
(长春中医药大学吉林省人参科学研究院,长春 130117)
1 引 言
阿尔茨海默病(AD)是痴呆的主要形式之一,是以老年斑、神经纤维缠结和海马神经元丢失为主要病理特征,以记忆力减退、认知功能障碍为主要临床特征的神经退行性疾病[1]。现代药理学研究表明,AD经典的发病机制主要包括氧化应激反应、Aβ淀粉样蛋白沉积、tau蛋白异常磷酸化等[2],氧化应激作为与神经退行性疾病发生和发展相关的重要病理机制之一,在中枢神经系统高度敏感的情况下可引起蛋白、脂质及DNA氧化修饰,继而引发线粒体功能障碍,导致细胞损伤[3]。谷氨酸作为神经递质,广泛分布在神经中枢系统中,在神经病理情况下,由于神经细胞损伤后兴奋性氨基酸转运体的反向转运激活,神经末梢释放大量谷氨酸,致使“谷氨酸泄漏”(Glutamate leakage),累积大量谷氨酸引起的基于氧化应激和线粒体功能障碍的神经毒性和细胞毒性[4,5],最终导致神经死亡而引发AD等神经退行性疾病。
人参皂苷被认为是人参中主要有效成分和生理活性成分,具有保护脑组织和神经细胞、改善学习和记忆功能。人参皂苷可以调节谷氨酸诱导氧化应激和线粒体功能障碍,可能对预防和治疗神经退行性疾病起到关键作用[6,7]。其中,人参皂苷元可调节神经元对神经传递兴奋的反应或压力,非皂苷元部分治疗改善了老年老鼠的记忆力衰退[8]。研究表明,人参皂苷Rb1可以改善AD的小鼠临床症状,其潜在机制可能与AD小鼠的卵磷脂、氨基酸和鞘脂类代谢有关[9],但体外细胞代谢研究较少,AD可能与细胞代谢物不平衡之间有一定的关系,但具体代谢调节机制尚不清楚。
细胞代谢组学研究能够直接描述特定细胞类型的代谢,快速直观,干扰小,是微观生命体的宏观表现。目前,尚未有应用1H NMR技术分析人参皂苷Rb1对谷氨酸诱导损伤的神经细胞保护的细胞代谢组学研究报道。本研究应用基于1H NMR的细胞代谢学技术对谷氨酸损伤和人参皂苷Rb1保护的SH-SY5Y细胞中的内源性代谢物变化进行考察,筛选鉴定各组细胞差异代谢物和分析主要代谢途径,在细胞水平上,系统探讨了人参皂苷Rb1保护氧化损伤神经细胞的作用机制。
2 实验部分
2.1 仪器与试剂
500 MHzAvance Ⅲ NMR谱仪(德国Bruker公司); CO2培养箱(日本Sanyo公司); CKX41荧光倒置式基础型显微镜(日本Olympus公司); 流式细胞仪(美国Merck-Millipore公司); BP211D 型十万分之一电子天平(北京赛多利斯天平有限公司); Model 680型酶标仪(日本Takara公司); KQ5200 型超声波清洗器(昆山市超声仪器有限公司); Microfuge®22R Centrifuge高速低温离心机(美国Beckman Coulter公司); HH-6型数显恒温水浴锅(金坛市荣华仪器制造有限公司); 微孔滤器(美国 Millipore公司); 多规格培养皿(美国Corning公司); Milli-Q超纯水仪(美国Bedford公司)。
人参皂苷Rb1标准品(中国药品生物制品检定所); 胎牛血清(FBS,美国Gibico公司); DMEM细胞培养液(美国Hyclone公司); 双抗(100 μg/mL 链霉素和100 U/mL 青霉素,美国Hyclone公司); 胰蛋白酶(美国Amresco公司); 噻唑蓝(MTT,美国Amresco公司); 二甲基亚砜(DMSO,天津市光复精细化工研究所); Annexin V-FITC/PI 细胞凋亡诊断试剂盒(四正柏生物有限公司); TSP-d4(青岛腾龙微波科技有限公司); 重水(D2O,青岛腾龙微波科技有限公司); NaH2PO4·2H2O和Na2HPO4·12H2O(汕头市西陇化工厂)。
2.2 实验方法
2.2.1MTT法测定SH-SY5Y细胞存活率选用AD体外SH-SYSY细胞谷氨酸损伤模型[10]。人神经母细胞瘤细胞株(SH-SY5Y)购自上海细胞库,置于37℃、5% CO2的CO2培养箱内,用含有10%(V/V)胎牛血清的DMEM培养基培养。传代3次后,取对数生长期细胞,加入0.25%胰蛋白酶消化,接种于96孔板,每孔100 μL(4×103细胞/孔)。培养24 h后,造模,设置模型组和对照组则和人参皂苷Rb1保护组,每组设置6个平行孔。继续培养24 h,以DMEM培养液配制人参皂苷Rb1至工作浓度(0.1、1、10、50、100和200 μg/mL)进行体外保护作用考察,考察时间设置为 24、48和72 h。离心,弃去培养液,每孔加入含20% MTT(5 mg/mL)的DMEM细胞培养液100 μL,4 h后,吸去孔内培养液,每孔加入100 μL DMSO,置酶标仪中振荡10 min,使结晶溶解,颜色均匀。在490 nm处测量各孔的吸光值,重复3次,按以下公式计算细胞存活率: 存活率(Survival rate, SR, %)=(OD样品组-OD空白组)/(OD正常组-OD空白组)。
2.2.2AnnexinV/PI双染法对细胞凋亡的分析细胞凋亡是AD发病过程中的一个重要病理环节,是细胞死亡的一种基本形式,线粒体在谷氨酸诱导的细胞凋亡过程中发挥重要作用。在该方法中,异硫氰酸荧光素(FITC)标记的膜联蛋白(Annexin V)可用于检测细胞凋亡[11]。碘化丙啶(PI)被用于区分存活的早期细胞和坏死或晚期凋亡细胞。本研究考察人参皂苷Rb1对谷氨酸诱导的SH-SY5Y细胞系是否有诱导凋亡的保护作用,设置模型组、对照组和人参皂苷Rb1保护组(100 μg/mL),作用于SH-SY5Y细胞24、48和72 h后,用Annexin V/PI 细胞凋亡检测试剂盒测定细胞凋亡情况。
2.2.3细胞代谢组学样本制备参考文献[12],取对数生长期细胞,按1×105接种于培养瓶中,培养24 h,设置模型组、对照组和人参皂苷Rb1保护组,每组设置6个平行瓶。模型组和人参皂苷Rb1保护组的每个样品瓶加10 mL 30 mmol/L谷氨酸DMEM溶液,正常组每瓶加10 mL 含FBS的DMEM完全细胞培养液。培养24 h,给药保护组加入含50 μg/mL人参皂苷Rb1的培养液10 mL,模型组、空白组加入DMEM细胞培养液10 mL,作用24 h后,分别吸取培养液,在4℃以1000 r/min离心10 min。用PBS洗培养瓶内细胞8次,以0.25% 胰蛋白酶消化细胞,用PBS溶液分别轻吹打培养瓶内和离心管底部的细胞,合并对应的两组细胞后,在相同条件下离心清洗2次。再次弃去上清后,迅速放入液氮中淬灭细胞,-80℃保存过夜。 取出细胞和培养液,于4℃反复冻融5次,加入甲醇-水(1∶2,V/V)溶液,适当涡旋后,于冰浴下超声破碎(超声设置为运行5 s,停顿9 s,20 min),充分释放细胞内容物。在4℃以13000 r/min离心10 min,取上清液,冻干,供细胞代谢组学用。
2.2.4细胞代谢组学数据采集细胞冻干粉溶于600 μL 0.1 mol/L磷酸盐缓冲液(含0.005% TSP 10%重水, pH 7.4),在4℃以13000 r/min 离心10 min, 取上清液,于5 mm NMR 管中进行测试。所有样品均在25℃下于Bruker Avance Ⅲ 500谱仪上完成(频率500 MHz)。采用 NOSEY序列测试, 弛豫延迟 320 ms, 谱宽12019.12 Hz, 扫描次数为64次,以TSP为内标物质。
2.3 数据处理
原始核磁文件采用MestReNova进行处理。核磁图谱经过定位、基线校准,归一化后,在δ0~9 ppm区域按δ0.04 ppm等间隔分段积分,其中δ4.80~5.06 ppm(残余水峰)不进行积分,将积分后的数据导入Excel程序中进行整理。所得数据导入SIMCA-P 11.0软件中进行多元统计分析,包括主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA)。

图1 人参皂苷Rb1对谷氨酸诱导的SH-SY5Y细胞存活率的影响(x±s, n=3)。*p<0.05: 与模型组相比; #p<0.05: 与48 h相比; ▲p<0.05: 与24 h相比; ▼p<0.05: 与24 h相比。Fig.1 Survival rate of SH-SY5Y cell induced by glutamic acid after treated with ginsenoside Rb1, (x±s, n=3). *p<0.05, compared with corresponding model groups; #p<0.05, compared with the 48h group; ▲p<0.05, compared with the 24 h group; ▼p<0.05, compared with the 24 h group
3 结果与讨论
3.1 人参皂苷Rb1对谷氨酸诱导SH-SY5Y细胞存活率的影响
基于人参皂苷Rb1对谷氨酸诱导的SH-SY5Y细胞的作用,研究其对氧化损伤神经细胞增殖的影响。以正常对照组细胞存活率(100%)为参照,人参皂苷Rb1作用较低浓度(0.1、1、10和50 μg/mL)时,表现出明显的剂量依赖性,随着剂量和作用时间增加,细胞存活率逐渐增强,48和72 h存活率呈现较明显的上升趋势。经计算,人参皂苷Rb1作用48 h后细胞存活率达到88.10%±0.01%; 72 h后的细胞存活率达到95.57%±0.05%(图1)。结果表明,人参皂苷Rb1对谷氨酸诱导的SH-SY5Y细胞损伤具有一定的保护作用。
3.2 人参皂苷Rb1对谷氨酸诱导SH-SY5Y细胞凋亡的影响

图2 流式细胞术Annexin V-FITC 双染色法检测细胞凋亡Fig.2 Cell apoptosis detected by flow cytometry with Annexin V-FITC double staining
细胞经Annexin V-FITC和PI双染,从对照组细胞流式散点图(图2)左下象限可见,早期有极少荧光信号,说明正常生长的细胞几乎无凋亡现象。而谷氨酸作用于SH-SY5Y细胞24、48和72 h后的模型组凋亡细胞比例逐渐增高,并于72 h达到最高,早期和晚期细胞凋亡率之和为49.3%。人参皂苷Rb1保护组作用于谷氨酸诱导的SH-SY5Y细胞24、48和72 h 后,可见凋亡细胞比例先上升达到最大,48 h时细胞早期和晚期凋亡率之和为42.5%,逐渐下降并于72 h达到36.8%,上述结果表明, 人参皂苷Rb1对谷氨酸诱导的SH-SY5Y细胞损伤活性有一定的保护作用。
3.3 细胞代谢组学的核磁图谱指认
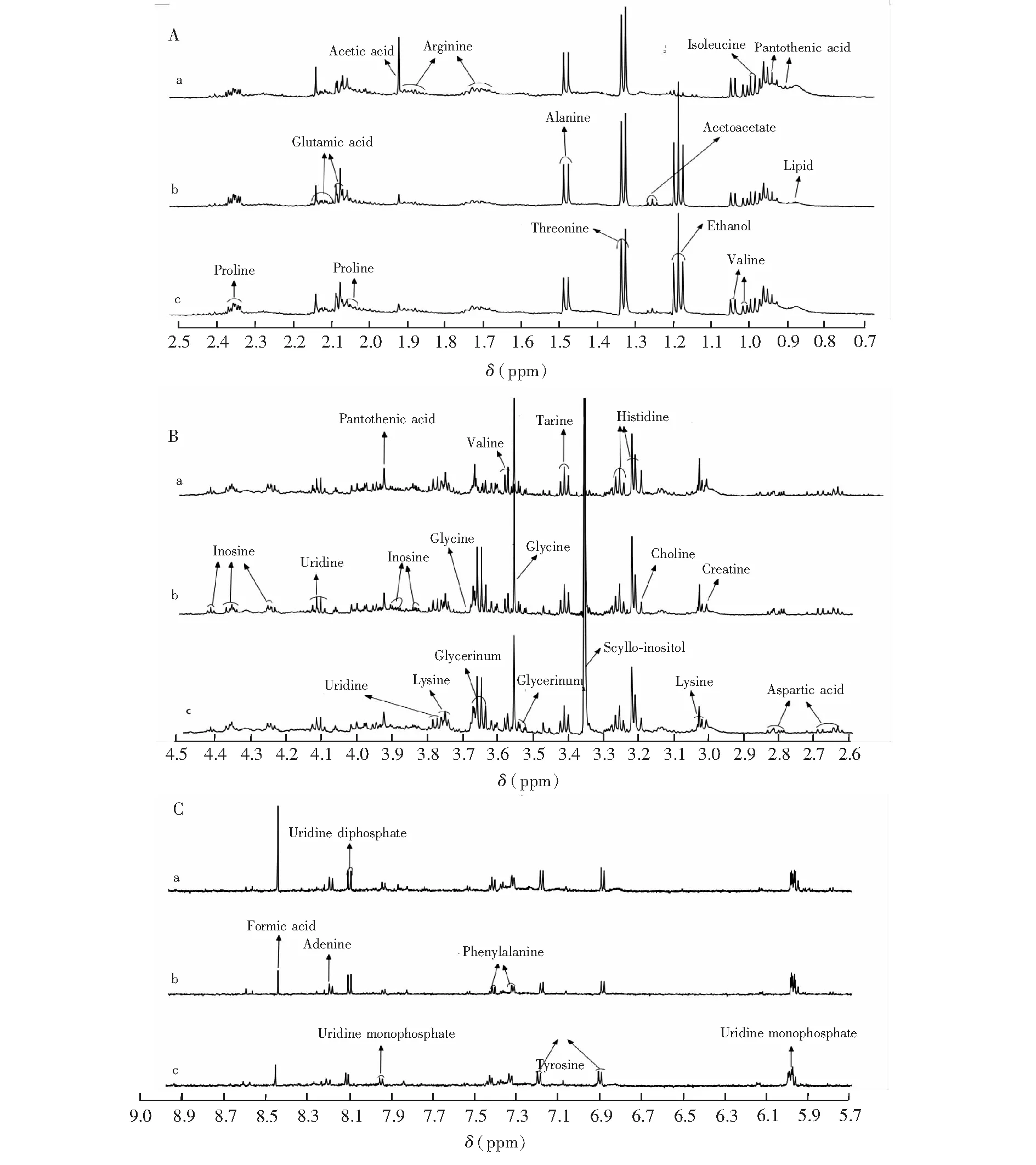
图3 对照组、模型组、人参皂苷Rb1保护组的SH-SY5Y细胞1H NMR指纹图谱: A、B、C分别为δ 0.7~2.5 ppm、 δ 2.6~4.6 ppm和δ 5.7~9.0 ppm的1H NMR谱图,a、b、c分别代表对照组、模型组和人参皂苷Rb1保护组Fig.3 1H NMR fingerprint spectra (A: δ 0.7~2.5 ppm, B: δ 2.6~4.6 ppm, C: δ 5.7~9.0 ppm) of SH-SY5Y cell from control group (a) , model group (b) and ginsenoside Rb1 treatment group (c)
应用优化的实验条件获取细胞代谢组学的核磁数据,通过分析化学位移、峰型及耦合常数等核磁数据,结合文献[13~22]对化合物的结构进行了指认。图3为典型的对照组、人参皂苷Rb1保护组和模型组的1H NMR指纹谱,鉴定出包括氨基酸、有机酸、脂类等29种化合物。直观分析发现,细胞经谷氨酸处理前后,化学成分差异较大。
3.4 谷氨酸损伤SH-SY5Y细胞的代谢组学分析
为阐明SH-SY5Y细胞经谷氨酸处理前后的化学差异,对经MestRoNova处理后数据进一步采用多元统计分析方法进行分析。主成分分析(PCA)是目前最常用的无监督分析方法之一,通过降低维度的思想把相关性的指标转化为几个具有更高聚合度的主成分指标,可以最大限度地体现数据特征[23]。图4A为SH-SY5Y细胞经谷氨酸处理前后的PCA得分散点图(PC1: 0.65; PC2: 0.22),空白对照组和模型组组间分离明显,这可能是由于谷氨酸损伤的细胞代谢发生异常所致,由此推断模型组细胞发生了显著变化。有监督的PLS-DA 排列实验(Permutation test)通常用于判别建立模型的有效性和模型的稳定性,即原始模型的预测能力大于任何一次随机排列y变量的预测能力,该分析结果(图4B)显示模型有效稳定,预测性能高。OPLS-DA方法去除与样品的分类不相关的干扰因素,即进一步消除非谷氨酸作用的影响,使组间分离最大化,并寻找差异性代谢物。OPLS-DA(图4C)显示谷氨酸造模有效。由表1可知,对照组和模型组差异具有统计学意义。结合载荷图(图4D)和VIP分析,结果见表1。

图4 对照组(■ )和模型组(●)细胞基于1H NMR的细胞代谢组学下的PCA得分图(A)、PLS-DA图(B)、OPLS-DA得分图(C)和OPLS-DA载荷图(D)Fig.4 Principal component analysis (PCA) scores plot (A), partial least squares discriminant analysis (PLS-DA) plot (B), orthogonal partial least squares discriminant analysis (OPLS-DA) score plot (C) and loading plot (D) based on1H NMR-metabolomics of cell from control group (■) and model group (●)
对正常对照组和模型组进行建模比对,将VIP>1及t检验(p<0.05)的24种差异代谢物带入MetaboAnlyst 3.0(http://www.metaboanalyst.ca/)在线分析平台,选择Homo sapiens (human)路径库作为代谢通路数据库,Hypergeometric Test作为通路富集分析,Relative-betweeness centrality分析通路拓扑结构,筛选出代谢通路影响值大于0.10的代谢通路。如图5所示,确定24种差异代谢物(见表1)分别分布于代谢通路中,表明谷氨酸可能对以上通路造成代谢紊乱,使造模细胞在整体状态上失调。其中,有6种代谢物在模型组中表现为上调,18种代谢物在模型组中为下调。
3.5 人参皂苷Rb1对谷氨酸损伤SH-SY5Y细胞保护的代谢组学分析
以相同的方法处理对照组、模型组和人参皂苷Rb1保护组的细胞代谢组学数据矩阵,由PC1(0.55)和PC2(0.20)为坐标轴构建的PCA得分散点图(图6A)可见,3组样本能够明显分开,人参皂苷Rb1保护组的代谢轮廓离开模型组,并有向对照组靠近的趋势,表明人参皂苷Rb1对模型细胞具有一定的保护作用。PLS-DA模型验证显示,模型有效可靠(图6B)。由3组OPLS-DA得分图(图6C,R2=0.22,Q2=0.45)可见,对照组、模型组和人参皂苷Rb1保护组具有明显差异。采用有监督的OPLS-DA获取3组间的潜在差异生物标记物,对载荷图(图6D)和VIP值进行分析。
表1 对照组与模型组差异代谢物鉴定与代谢通路分析
Table 1 Identified biomarkers and pathway of control group compared with the control group
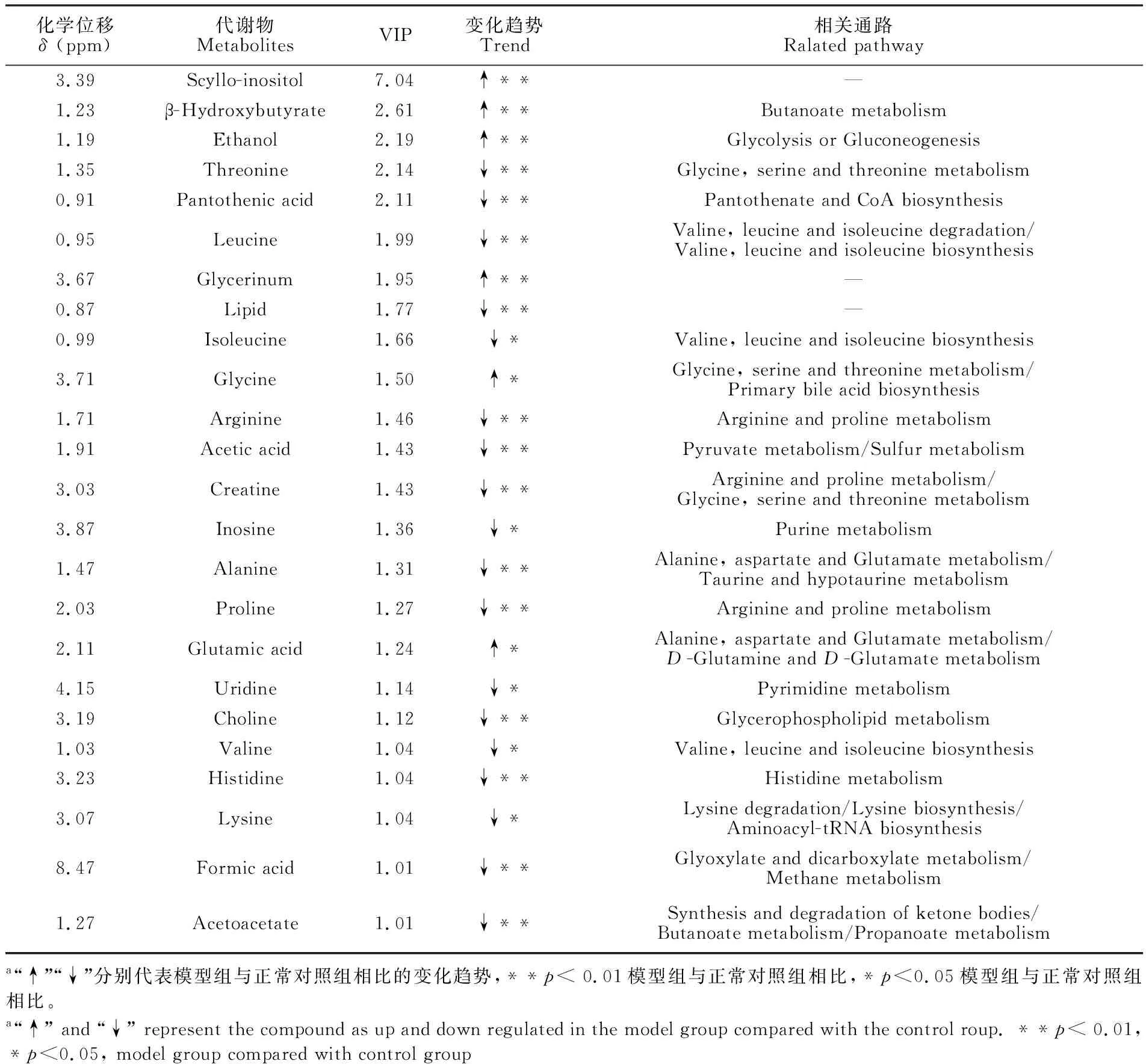
化学位移δ (ppm)代谢物MetabolitesVIP变化趋势Trend相关通路Ralated pathway3.39Scyllo-inositol7.04↑**—1.23β-Hydroxybutyrate2.61↑**Butanoate metabolism1.19Ethanol2.19↑**Glycolysis or Gluconeogenesis1.35Threonine2.14↓**Glycine, serine and threonine metabolism0.91Pantothenic acid2.11↓**Pantothenate and CoA biosynthesis0.95Leucine1.99↓**Valine, leucine and isoleucine degradation/Valine, leucine and isoleucine biosynthesis3.67Glycerinum1.95↑**—0.87Lipid1.77↓**—0.99Isoleucine1.66↓*Valine, leucine and isoleucine biosynthesis3.71Glycine1.50↑*Glycine, serine and threonine metabolism/Primary bile acid biosynthesis1.71Arginine1.46↓**Arginine and proline metabolism1.91Acetic acid1.43↓**Pyruvate metabolism/Sulfur metabolism3.03Creatine1.43↓**Arginine and proline metabolism/Glycine, serine and threonine metabolism3.87Inosine1.36↓*Purine metabolism1.47Alanine1.31↓**Alanine, aspartate and Glutamate metabolism/Taurine and hypotaurine metabolism2.03Proline1.27↓**Arginine and proline metabolism2.11Glutamic acid1.24↑*Alanine, aspartate and Glutamate metabolism/D-Glutamine and D-Glutamate metabolism4.15Uridine1.14↓*Pyrimidine metabolism3.19Choline1.12↓**Glycerophospholipid metabolism1.03Valine1.04↓*Valine, leucine and isoleucine biosynthesis3.23Histidine1.04↓**Histidine metabolism3.07Lysine1.04↓*Lysine degradation/Lysine biosynthesis/Aminoacyl-tRNA biosynthesis8.47Formic acid1.01↓**Glyoxylate and dicarboxylate metabolism/Methane metabolism1.27Acetoacetate1.01↓**Synthesis and degradation of ketone bodies/Butanoate metabolism/Propanoate metabolisma“↑”“↓”分别代表模型组与正常对照组相比的变化趋势,**p< 0.01模型组与正常对照组相比,*p<0.05模型组与正常对照组相比。a“↑” and “↓” represent the compound as up and down regulated in the model group compared with the control roup. **p< 0.01, *p<0.05, model group compared with control group
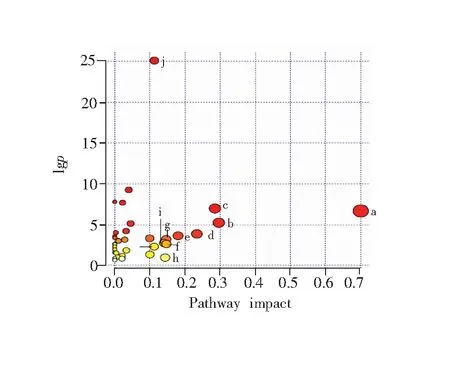
图5 对照组和模型组细胞代谢物组学图
酮体的合成和降解(a),精氨酸和脯氨酸代谢(b),甘氨酸、丝氨酸和苏氨酸代谢(c),丙氨酸、天冬氨酸和谷氨酸代谢(d),泛酸和辅酶A生物合成(e),赖氨酸降解(f),甲烷代谢(g),二羧酸代谢(h),组氨酸代谢(i),氨酰tRNA生物合成(j),D-谷氨酰胺和D-谷氨酸代谢(k)
Fig.5 Metabolome view of control group and model group
Synthesis and degradation of ketone bodies (a), arginine and proline metabolism (b), glycine, serine and threonine metabolism (c), alanine, aspartic acid and glutamate metabolism (d) , pantothenic acid and coenzyme A biosynthesis (e), lysine degradation (f), methane metabolism (g), dicarboxylic acid metabolism (h), histidine metabolism (i), aminoacyl tRNA biosynthesis (j),D-glutamine andD-glutamate metabolism (k)
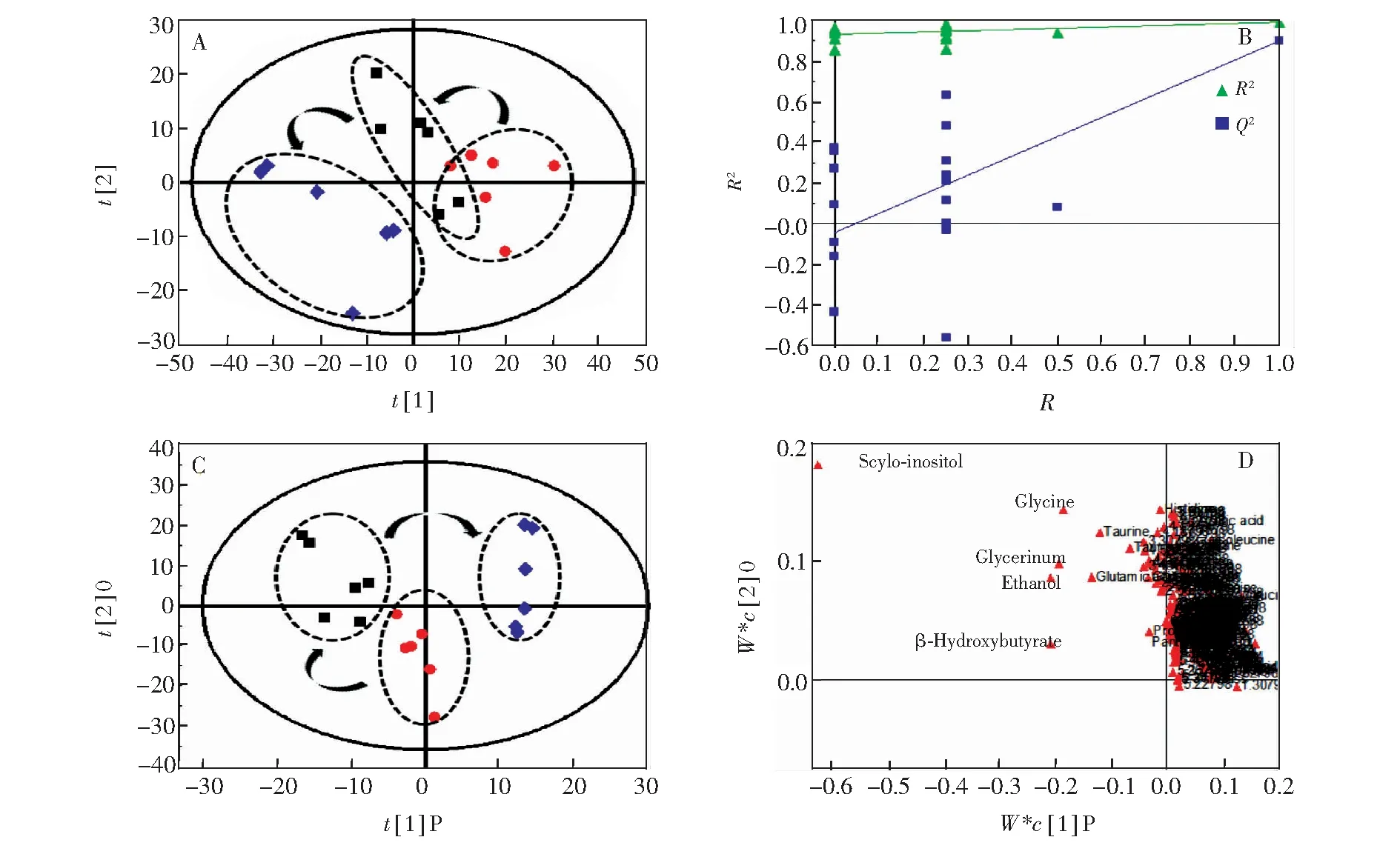
图6 人参皂苷Rb1保护组(■)、对照组(◆)和模型组(●)细胞基于1H NMR的细胞代谢组学下的PCA得分图(A)、PLS-DA图(B)、OPLS-DA得分图(C)和OPLS-DA载荷图(D)Fig.6 PCA scores plot (A), PLS-DA plot (B), OPLS-DA score plot (C) and loading plot (D) based on1H NMR-metabolomics of cell from ginsenoside Rb1 treatment group, control group and model group
为探索以上获得的代谢差异物涉及的代谢通路,采用MetaboAnalyst 3.0中的Pathway Analysis数据库进行分析。将多元统计分析所得的VIP>1及单因素方差分析(p<0.05)的7种代谢差异物(表2)导入数据库,筛选出与差异代谢物密切相关的代谢通路(图7)。代谢通路影响值大于0.10的靶标代谢路径中,代谢通路圆点越大表示对代谢组学的重要性越大,其中影响最大的为牛磺酸和亚牛磺酸代谢(图7a)。代谢通径颜色越深,表示代谢通路分析的富集性越大,其中最强的也是牛磺酸和亚牛磺酸代谢(图7a)。谷氨酸诱导的细胞损伤给药保护后代谢物的变化主要涉及牛磺酸和亚牛磺酸代谢(图7a),精氨酸和脯氨酸代谢(图7b),丙氨酸、天冬氨酸和谷氨酸代谢(图7c),D-谷氨酰胺和D-谷氨酸代谢(图7d),丙酮酸代谢(图7e)等代谢通路。以上这些通路分别与能量代谢及氨基酸代谢紧密相关,表明人参皂苷Rb1主要通过对以上5种通路对模型细胞代谢产生影响,使模型细胞在整体代谢状态上回调,此结论与谷氨酸诱导的PC12细胞所影响的代谢通路大多相同[12]。与模型组相比,牛磺酸、乙酸、精氨酸、肌酸、脯氨酸和丙氨酸6种代谢差异物在人参皂苷Rb1保护组中表现为上调,谷氨酸在人参皂苷Rb1保护组中表现为下调。
表2 模型组与人参皂苷Rb1保护组差异代谢物鉴定与代谢通路分析
Table 2 Identified biomarkers and pathway of ginsenoside Rb1 group compared with the control group and the model group

化学位移Chemical shift(ppm)VIP value代谢物Metabolites变化趋势Trenda相关通路 Ralated pathway2.111.97Glutamic acid↓*Alanine, aspartate and Glutamate metabolism/D-Glutamine and D-Glutamate metabolism3.271.76Taurine↑*Taurine and hypotaurine metabolism/Primary bile acid biosynthesis1.911.26Acetic acid↑*Pyruvate metabolism/Sulfur metabolism1.711.21Arginine↑*Arginine and proline metabolism/Aminoacyl-tRNA biosynthesis3.031.18Creatine↑*Arginine and proline metabolism/Glycine, serine and threonine metabolism1.471.1Alanine↑**Alanine, aspartate and Glutamate metabolism/Taurine and hypotaurine metabolism2.031.04Proline↑*Arginine and proline metabolism/Aminoacyl-tRNA biosynthesisa“↑”“↓”分别代表人参皂苷Rb1给药保护组与模型组与对照组相比的变化趋势,**p<0.01模型组与对照组相比,*p<0.05模型组与对照组相比。a “↑” and “↓” represent the compound as up and down regulated in ginsenoside Rb1 treatment group compared with model group. **p<0.01,*p<0.05, model group compared with control group.
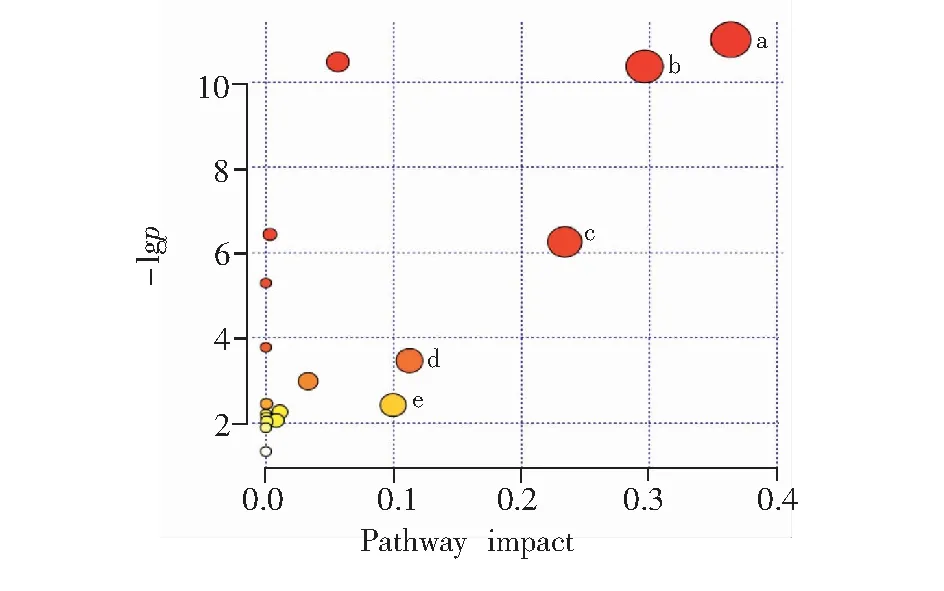
图7 人参皂苷Rb1给药保护组、模型组、正常对照组差异性代谢物通路得分图牛磺酸和亚牛磺酸代谢(a),精氨酸和脯氨酸代谢(b),丙氨酸、天冬氨酸和谷氨酸代谢(c),D-谷氨酰胺和 D-谷氨酸代谢(d),丙酮酸代谢(e)Fig.7 Metabolome view of ginsenoside Rb1 group, control group and model groupTaurine and hypotaurine metabolism(a); Arginine and proline metabolism(b); Alanine, aspartate and Glutamate metabolism(c); D-glutamine and D-glutamate metabolism(d); Pyruvate metabolism(e)
牛磺酸在机体中有抗氧化和清除自由基的能力,与牛磺酸和亚牛磺酸代谢密切相关,对抗老年痴呆患者神经元细胞凋亡和衰老有重要意义。研究表明,牛磺酸能够増强大鼠的学习记忆能力,机体内牛磺酸及亚牛磺酸含量改变及代谢异常可能会造成记忆能力下降和认知功能障碍,而且与神经元的衰老进程密切相关。牛磺酸是参与多个氨基酸代谢与能量代谢的关键蛋白转化节点,由谷氨酸脱羧酶活性异常引起的牛磺酸和亚牛磺酸代谢紊乱可能导致大脑性麻痹症状的发生。谷氨酸损伤的SH-SY5Y细胞通过给予人参皂苷Rb1保护后,发现牛磺酸含量显著增高,代谢恢复正常,提示人参皂苷Rb1通过调节改善牛磺酸和亚牛磺酸代谢而达到缓解和治疗AD的作用。
脯氨酸在机体内要经谷氨酸才能被代谢,可导致谷氨酸代谢紊乱, 阻止谷氨酸摄取[12]。与模型组相比,人参皂苷Rb1给药保护组脯氨酸含量明显升高。因此AD患者机体内一种氨基酸的代谢紊乱可能同时干扰其它多种活性物质的改变,导致多种氨基酸代谢的异常。
谷氨酸和天冬氨酸作为神经系统中重要的兴奋性神经递质广泛分布于神经系统中,能引起突触后膜去极化。当与AD发病相关的神经元细胞过度兴奋时,短时间内释放大量谷氨酸和天冬氨酸,使得局部含量超标,产生较严重的神经毒性,可加速神经元细胞变性死亡。与模型组相比,人参皂苷Rb1保护组谷氨酸含量显著下降,可见人参皂苷Rb1能通过对谷氨酸的回调从而达到治疗AD的作用。
丙酮酸是代谢过程中重要的中间产物,丙酮酸累积可以加速机体应激反应,进而导致能量代谢异常,是加速脑体功能下降。与模型组相比,人参皂苷Rb1保护组的乙酸含量显著上升,表示丙酮酸累积减少可使丙酮酸代谢正常进行,人参皂苷Rb1给药后能抑制脑体功能下降幅度, 对AD起到治疗作用。
甘氨酸是神经系统的一种抑制性神经递质,与AD患者体内苏氨酸利用降低及丝氨酸的利用升高密切相关。细胞可以从甘氨酸合成丝氨酸,并且丝氨酸在细胞膜及神经鞘的合成中都发挥着作用。研究结果表明,细胞损伤后丝氨酸含量的降低可以抑制活性氧(ROS)和炎症因子的生成,与模型组相比, 人参皂苷Rb1给药保护组甘氨酸含量明显上升,其代谢异常可能在AD发生中发挥着重要作用。
泛酸和辅酶A生物合成、硫代谢、谷胱甘肽代谢、初级胆汁酸生物合成等为生物体内最常见且必不可少的代谢方式,在AD的形成和治疗中参与机体内多种活性物质的合成与代谢,在机体的学习记忆、神经传导和受体功能等方面发挥着重要作用。
4 结 论
人参皂苷Rb1通过减少谷氨酸诱导的SH-SY5Y细胞凋亡发挥对神经细胞氧化损伤的保护作用。本研究基于1H NMR细胞代谢组学技术,发现谷氨酸主要通过影响氨基酸代谢对SH-SY5Y细胞产生氧化损伤作用,而人参皂苷Rb1通过上调谷氨酸损伤模型中的牛磺酸、精氨酸、脯氨酸、丙氨酸、甘氨酸和苏氨酸等15种代谢差异物,下调谷氨酸、β-羟基丁酸和鲨肌醇使SH-SY5Y细胞代谢整体回调,说明人参皂苷Rb1主要通过影响多种能量及氨基酸代谢,在细胞整体水平上对氧化损伤神经细胞产生保护作用。

