席夫碱多功能金属离子探针的合成及在生物成像中的应用
曹亚萍 吴 庆 胡庆红 余光勤 袁泽利
(遵义医学院药学院, 遵义 563000)
1 引 言
钙、铜及锌是生物体中不可或缺的重要金属元素,它们在生物体中浓度平衡紊乱会导致诸多疾病的发生[1,2]。如阿尔兹海默病[3]和帕金森病[4]等神经退行性疾病与体内Cu2+的浓度有关;糖尿病[5]、脑缺血[6]、白内障[7]等疾病与Zn2+的浓度有关;骨质疏松等疾病与Ca2+的浓度有关。而这些金属离子在体内浓度平衡与生物体获取这些金属离子来源(如水体、食物及药品等)密切相关。因此, 监控生物体内、水体及药品中Ca2+、Cu2+及Zn2+的浓度十分必要。
目前,检测Ca2+、Cu2+及Zn2+的方法有原子吸收光谱法、紫外-可见吸收光谱法、比色法、滴定分析法和电感耦合质谱法等[8,9]。近年发展起来的化学探针法因其具有灵敏度高、选择性好、方法简便和可生物体原位检测等优点,受到研究者的青睐[10~13]。近年来报道的金属离子化学探针,如1,8-萘二甲酸酐类[14]、罗丹明类[2]、苯并咪唑类[15]及杯芳烃类[16]等,能对待测的一种或两种金属离子具有高选择性,且可用于实际样品中。但这些探针的合成步骤复杂,样品测试多在有机溶体系中进行,限制了它们在生物体内对金属离子检测的实际应用[17]。因此,设计合成简易、能在水相体系中选择性识别金属离子,并可应用于生物体内检测的新化学探针受到极大关注[17,18]。
含亚胺或甲亚胺基团的席夫碱结构因其合成简单、光电特性优良及金属离子螯合能力强等特性,可被作为化学探针检测金属离子。本课题组在前期通过简单的的方法合成了系列可在水中进行双重识别待测物的席夫碱化学探针[19,19],并用于细胞荧光成像检测[98,20]。在此基础上,本研究以2,6-二甲酰基对甲基苯酚为原料,与烟酸酰肼进行一步缩合,得到具有多个N、O配位原子的双席夫碱探针L(图 1)。在无水乙醇-Tris-HCl缓冲液(9∶1,V/V, pH 7.40)中,探针L能同时选择性识别Ca2+、Cu2+及Zn2+,对实际样品(药品、水样、血清)中3种金属离子含量的测试结果令人满意。尤为重要的是,探针L能应用于肝癌细胞HepG2、斑马鱼活体及小鼠体内Ca2+的荧光成像检测。本研究结果表明,所构建的双席夫碱探针L是一种具有多重识别Ca2+、Cu2+和Zn2+,并可在生物体应用的化学探针。
2 实验部分
2.1 仪器与试剂
Agilent400 MR DD2核磁共振仪、Varian 1000 FT-IR红外光谱仪、Varian Carry 荧光分光光度计(美国Aglient公司); Micromass LCT PremierXE 高分辨质谱仪(美国Waters公司); ABSCIEX QTRAP4000 LC-MS/MS质谱仪(美国ABSCIEX公司); TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司); IVIS Lumina XRMS Series Ⅲ 小动物活体成像系统(美国PerkinElmer公司); IX73奥林巴斯倒置荧光显微镜(日本奥林巴斯公司)。
烟酸酰肼、4-甲基苯酚等试剂均为分析纯,如未特殊说明,使用前均未进行纯化处理。实验用水为超纯水(电阻率18.3 MΩ·cm)。2,6-二甲酰基-4-甲基苯酚按本课题组前期方法[13]合成。血清样品来自于遵义医学院附属医院检验科。
2.2 探针L合成方法
探针L的合成线路如图1所示,于100 mL圆底烧瓶中加入0.33 g (2 mmol)的2,6-二甲酰基-4-甲基苯酚、0.56 g (4 mmol)烟酸酰肼和25 mL无水乙醇,加热回流3.5 h,冷却,抽滤,烘干,得淡黄色粉末状固体,产率72.0%。m.p.: 277~279℃;1H NMR(400 MHz, DMSO-d6)δ(ppm):12.31(s, 2H, NH), 12.24(s, 1H, OH), 9.10(s, 2H, CH=N), 8.79(s, 2H, Ar-H), 8.72(s, 2H, Ar-H), 8.29~8.30(d,J= 6.5 Hz, 2H, Ar-H), 7.60(s, 4H, Ar-H), 2.34(s, 3H, CH3);13C NMR(100 MHz, DMSO-d6)δ(ppm): 161.97, 155.24, 152.87, 149.07, 147.14, 135.96, 128.83, 124.10, 120.23, 20.35; HR-MS(ESI-MS) calcd for C24H25N6O3(M++ H+): 403.1519, found 403.1511; FT-IR (4000~400 cm-1)v: 3464, 3415, 3290, 3201, 2851, 1667, 1618, 1597, 1558,1458, 1400, 1355, 1300, 1270, 1195和756。
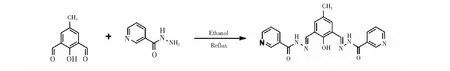
图1 探针L的合成过程示意图Fig.1 Synthesis of chemsensor probe L
2.3 溶液配制
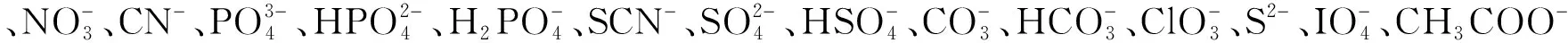
2.4 紫外-可见吸收光谱和荧光光谱检测
将探针L及其分别与2.3中所述的阴离子或金属离子配制成相应浓度的溶液5 mL,测紫外-可见吸收光谱和荧光光谱(狭缝宽度均为5 nm,电压为中等,λex=337 nm,λem=515 nm)。
2.5 细胞成像实验
取对数生长期的HepG2细胞悬液 300 μL(5×104cell/mL)于24孔板中,孵育24 h后,加入96 μL 探针L(160 μmol/L)继续孵育30 min,再加入30 μL 2 mmol/L的Ca2+或Zn2+溶液,继续孵育30 min后,用PBS轻轻洗涤3次,用奥林巴斯IX73荧光倒置显微镜蓝色通道(λex=420~485 nm,λem=515 nm)进行细胞成像分析。
2.6 斑马鱼成像测试
将适量L用1 mL DMSO溶解后,以PBS配制成2 mmol/L待测液,取3.5 μL待测液于EP管中,用去离子水定容至1 mL,作为探针对照组;以同样的取样量取L至EP管中,再加入100 μL的Ca2+或Zn2+溶液,定容至1 mL,作为实验组;分别在探针对照组及实验组中加入1~2条斑马鱼,孵育30 min,于奥林巴斯IX73荧光倒置显微镜蓝色通道(λex=420~485 nm,λem=515 nm)下观察成像结果。
2.7 小鼠成像测试
昆明小鼠(SPF级,雄性,5~6 W,34~36 g)购自华中农业大学实验动物中心,喂养一周后进行实验;SPF级C57BL/6小黑鼠(雄性,6~8 W,18~22 g)购于华中农业大学,喂养一周进行实验。取对数生长期的B16F10细胞进行消化、离心,将所得的约5×106个细胞溶于0.1 mL DMEM培养液,注射于C57BL/6 小黑鼠左右后肢背根部皮下。接种后7~9天瘤体长到5~10 mm,此B16F10肿瘤模型小黑鼠可进行后续实验。
将探针L用乙醇溶解,浓度为2 mmol/L。取300 μL探针L,加入300 μL生理盐水,作为探针对照组;取300 μL探针L,加入300 μL Ca2+或Zn2+溶液,作为实验组;用1 mL注射器取100 μL探针对照组溶液,皮下注射到正常昆明小鼠腹部左侧,在正常昆明小鼠腹部右侧皮下注射实验组溶液,注射完毕后,在小动物活体成像系统(λex=460 nm,λem=520 nm)中观察成像结果;取同浓度同剂量的对照溶液皮下注射到B16F10肿瘤模型小黑鼠左侧肿瘤部位,在右侧肿瘤部位皮下注射实验组溶液,注射完毕后,利用小动物活体成像系统(λex=460 nm,λem=520 nm)观察成像结果。
3 结果与讨论
3.1 探针L的合成与结构表征
以2,6-二甲酰基-4-甲基苯酚为原料,经与烟酸酰肼缩合反应制得目标探针L。探针L为黄色粉末状固体,熔点227℃~229℃,易溶于二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、甲醇、氯仿、二氯甲烷及乙醇溶剂中。L的结构和组成经1H NMR、13C NMR、HR-MS(ESI-MS)以及FT-IR证实为预期目标分子结构(表征谱图见电子版文后支持信息图S1~S4)。
3.2 探针L的识别性能
3.2.1探针L的选择性在无水乙醇-Tris-HCl缓冲液(9∶1,V/V, pH 7.40)混合溶剂中,研究了探针L对碱金属离子(Li+、Na+和K+)、碱土金属离子(Mg2+、Ba2+、Ca2+和Sr2+)、过渡金属离子(Mn2+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+、Cd2+、Hg2+和Ag+)及Al3+和Pb2+的选择性(图2和图S5)。由紫外-可见吸收光谱(图2A)可见,未加入Ca2+、Cu2+和Zn2+时,L在301和366 nm处有最大吸收;加入Ca2+后,L在470 nm产生了新的吸收峰;当Cu2+和Zn2+分别加入后,均在335 nm以及405 nm和415 nm产生了新的吸收峰。上述结果表明,3种金属离子分别与L发生了结合。在相同的条件下,选择加入18种常见阴离子后,未观察到探针L的紫外-可见吸收光谱发生任何变化(图S6)。
在同样条件下,测试了L与上述金属离子作用前后的荧光光谱图(图2B)。加入Zn2+和Ca2+后,在486和514 nm处的荧光强度分别增加了11倍和9倍,而Al3+的加入也会使486 nm处的荧光强度增加5倍。此外,于365 nm紫外灯照射下,还观测到Ca2+和Zn2+分别与探针L结合后有绿色的荧光和蓝色荧光(图S7),Al3+与L混合后,也观察到较弱的蓝色荧光。而加入其余阴离子后,未观察到探针L的荧光变化(图S8和S9)。根据上述实验结果,可用紫外-可见吸收光谱法识别检测Cu2+,用荧光光谱法识别检测Zn2+和Ca2+。

图2 (A)在无水乙醇/Tris-HCl(9∶1, V/V, pH=7.40)缓冲溶液中加入探针L(10 μmol/L)与Ca2+、Cu2+、Zn2+(100 μmol/L)的紫外-可见吸收光谱;(B)在无水乙醇/Tris-HCl(9∶1, V/V, pH=7.40)缓冲溶液中加入L(20 μmol/L)以及各个金属离子(Li+, Na+, K+, Zn2+, Fe3+, Al3+, Mg2+, Ca2+, Cu2+, Cd2+, Pb2+, Ni2+, Ba2+, Co2+, Mn2+, Sr2+, Hg2+和Ag+)后的荧光光谱。Fig.2 (A) Absorbance spectra of probe L (10 μmol/L) in ethanol/Tris-HCl buffer (9∶1, V/V, pH 7.40) upon individual addition of 100 μmol/L different metal ions. (B) Fluorescence spectra of probe L (20 μmol/L) before and after the addition of various metal ions (40 μmol/L), including Li+, Na+, K+, Zn2+, Fe3+, Al3+, Mg2+, Ca2+, Cu2+, Cd2+, Pb2+, Ni2+, Ba2+, Co2+, Mn3+, Sr2+, Hg2+ and Ag+ in ethanol/Tris-HCl buffer (9∶1, V/V, pH 7.40).
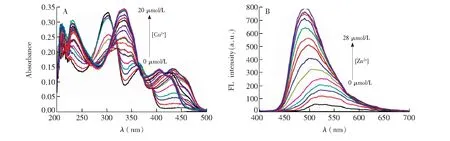
图3 在探针L (10 μmol/L)的乙醇/Tris-HCl (9∶1, V/V, pH=7.40)缓冲液中加入不同浓度Cu2+ (A) 的紫外-可见吸收光谱图以及不同浓度Zn2+(B)的荧光光谱图。Fig.3 UV-Vis absorbance spectra of probe L (10 μmol/L) in the presence of different concentrations of Cu2+ (A), and fluorescence spectra of probe L (10 μmol/L) in the presence of different concentrations of Zn2+(B) in ethanol/Tris-HCl (9∶1, V/V, pH 7.40) buffer.
3.2.2探针L的浓度依赖性为进一步验证探针L能否用于Ca2+、Cu2+和Zn2+的定量检测,测定了不同浓度的Cu2+、Zn2+和Ca2+对探针L光谱的影响,结果如图3和S10所示。由图3A可知,探针L在301 nm处的吸收峰强度随Cu2+浓度的增加而逐渐减小,而在366 nm处的吸收峰强度逐渐增加,并逐渐蓝移至335 nm。同时,在432 nm处产生新的吸收峰,当Cu2+浓度为10 μmol/L时,吸光度达到最大值;其后,随着Cu2+浓度增加,吸收峰蓝移至406 nm处,当Cu2+浓度增至20 μmol/L,达到最大吸收,Cu2+浓度继续增加,体系的吸光度变化不大(电子版文后支持信息图S10)。而在荧光光谱图中,随Ca2+浓度的增加,在514 nm有新的吸收峰,且Ca2+浓度达到30 μmol/L后,体系的荧光强度值变化较小。类似地,随着Zn2+浓度增加,探针L在波长486 nm处的荧光强度逐渐增大,当Zn2+浓度增至30 μmol/L后,体系荧光强度变化趋势明显减弱(图3B),表明二者之间具有很好的络合作用。此外,探针L溶液的吸光度或荧光强度与Cu2+、Ca2+和Zn2+的浓度有较好的线性关系, 线性相关系数(R2)分别为0.9990、 0.9929和0.9969(图S11~S13),以空白样品3倍的标准偏差计算检出限,得探针L对Cu2+、Ca2+和Zn2+的检出限分别为9.2×10-7mol/L、 9.0×10-7mol/L和5.1×10-7mol/L,表明探针L可以用于定量检测Cu2+、Ca2+和Zn2+。
3.2.3探针L识别Ca2+、Cu2+和Zn2+的pH范围和时间响应为了验证L识别Ca2+、Zn2+和Cu2+的实用性,分别考察了pH值和时间对L识别Ca2+、Cu2+和Zn2+的光谱的影响,结果见图4和图S14、S15。由图可知,探针L与Ca2+在pH=6~8范围内有识别作用,而探针L与Zn2+则在pH=7~9的范围内有识别作用。用紫外-可见光谱法测定,探针L可在pH 5~11范围内对Cu2+进行识别。因此,L可在生理条件下对这3种金属离子进行识别检测。
从时间对探针L识别Ca2+、Cu2+和Zn2+光谱的影响可知,探针L均可快速识别上述3种金属离子。

图4 (A) pH值和(B)时间对L 识别Zn2+和Ca2+的影响Fig.4 Effect of (A) pH value and (B) raction time on recognition of probe L to Zn2+ and Ca2+
3.2.4探针L识别Ca2+、Cu2+和Zn2+的抗干扰性能为考察probe 识别Cu2+、Ca2+和Zn2+受其余金属离子干扰性能,将L分别与待测的Cu2+、Ca2+和Zn2+混合物后,再分别加入干扰离子进行竞争性实验,用紫外-可见吸收光谱法和荧光光谱法进行测定,结果见图5以及图S16、S17。由图5可见,荧光光谱法测定Zn2+会受到同周期的Fe3+、Cu2+、Ni2+、Co2+和Pd2+的干扰外,其余的干扰物未有显著干扰。可用F-、半胱氨酸、丁二酮肟和I-掩蔽Fe3+、Cu2+、Ni2+和Pd2+对L识别Zn2+的干扰(图S18~S21)。

图5 探针L(10 μmol/L)及其与Zn2+(26 μmol/L)在各种金属离子(26 μmol/L)存在下的荧光强度,以L作对照,λmax= 498 nmFig.5 Relative emission of probe L (10 μmol/L) and its complexation with Zn2+ (26 μmol/L) in the presence of different metal ions (26 μmol/L). The response of probe L on its own is used as a control. λmax= 498 nm
然而,探针L识别Cu2+受到Fe3+、Cd2+和Pb2+微小干扰外,其余金属离子未见显著干扰。类似地,探针L识别Ca2+受到Fe3+和Pd2+微小干扰外,其余金属离子未见显著干扰。这表明探针L识别Ca2+、Cu2+和Zn2+具有一定的抗干扰能力。
3.3 探针L识别Ca2+、Cu2+和Zn2+的机理
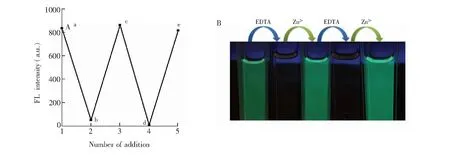
图6 (A) 探针L在乙醇/Tris-HCl (9∶1, V/V, pH=7.40)缓冲液中加入Zn2+(λmax = 498 nm) 和EDTA的可逆性变化; (B)在356 nm紫外灯下观察探针L在乙醇/Tris-HCl (9∶1, V/V, pH=7.40)缓冲液中加入Zn2+(λmax = 498 nm) 和EDTA的颜色变化Fig.6 (A) Reversible changes of fluorescence response of probe L following addition of Zn2+ (λmax=498 nm) and EDTA to a mixture of ethanol/Tris-HCl (9∶1, V/V, pH 7.40) buffer. (B) Color change of probe L following addition of Zn2+ (λmax=498 nm) and EDTA to a mixtur of ethanol/Tris-HCl (9∶1, V/V, pH 7.40) buffer under 365 nm UV-Vis light
3.3.1配位作用为验证L识别Ca2+、Cu2+和Zn2+的机理,向L+M2+(M2+=Ca2+、Cu2+和Zn2+)溶液中加入EDTA,再加入相应M2+离子,如此循环5次的实验结果如图6、图S22和图S23所示。由图6A可见,随着强螯合剂EDTA的加入, EDTA迅速夺取与L配位的M2+, 使参与配位的L重新游离出来,引起吸光度或荧光强度逐渐下降(过程a→b)。当EDTA浓度达到26 μmol/L 时,荧光强度基本不再下降,表明EDTA与Zn2+发生定量配合。再次加入26 μmol/L Zn2+时, 吸光度或荧光强度恢复到原来的大小(过程b→c), 如此继续重复两次(c→d, d→e),得到相似的结果,且溶液颜色也发生由绿色的荧光变为无色的重复变化(图6B)。类似地,EDTA引起L识别Ca2+和Cu2+荧光强度或吸光度也能得到重复变化。上述现结果表明,L是通过配位反应识别Ca2+、Cu2+和Zn2+, 且识别过程可多次重复可逆。
3.3.2配位比鉴于L与M2+(M2+=Ca2+、Cu2+和Zn2+)发生配位作用,将L和M2+的总浓度保持为10 μmol/L,通过改变M2+浓度绘制了探针L分别与3种金属离子的络合曲线(图7(探针L与Ca2+络合的Job-plot图)和图S24、S25)。结果表明, 改变3种金属离子的摩尔分数, 当Ca2+的摩尔分数为0.5时, 溶液荧光强度达到最大值;当Zn2+和Cu2+的摩尔分数约为0.6时, 溶液的荧光强度或吸光度达到最大值。表明L与Ca2+的络合比为1∶1,而L与Zn2+和Cu2+的络合比均为1∶2。
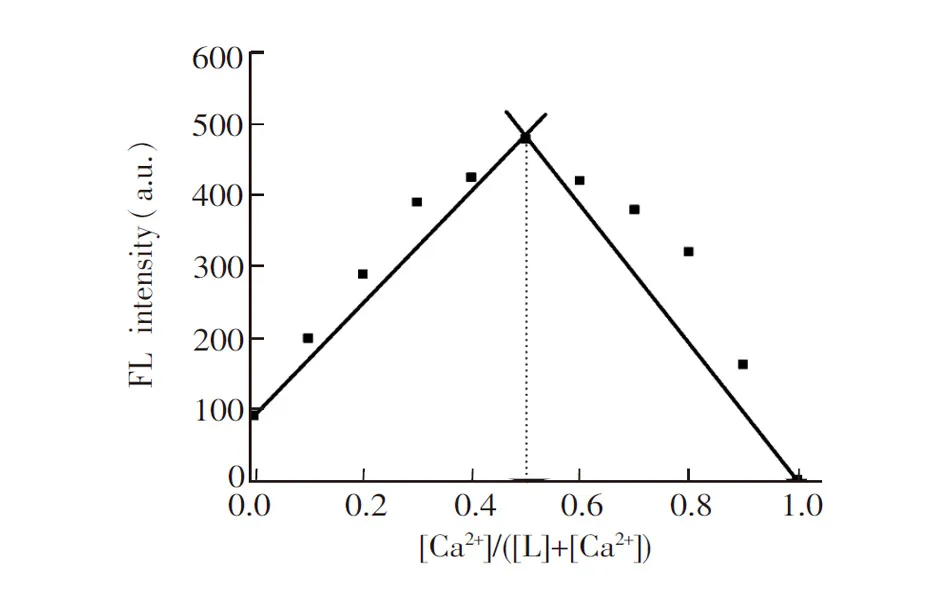
图7 在探针L的乙醇/Tris-HCl (9∶1, V/V, pH=7.40)缓冲液中L与Ca2+络合的Job-plot图Fig.7 Job-plot for Ca2+and probe L showing 1∶1 stoichiometry in ethanol/Tris-HCl (9∶1, V/V, pH 7.40) buffer
3.3.3核磁共振氢谱滴定为进一步证实探针L通过配位作用识别Zn2+,考虑到Zn2+为顺磁性,在L的DMSO-d6-D2O(9∶1,V/V),溶液中滴加不同浓度含Zn2+的DMSO-d6-D2O(9∶1,V/V)溶液,并测试其核磁共振氢谱,结果如图8所示。探针L结构中的羟基质子(Ha)和酰肼NH质子(Hc)的质子化学位移随着Zn2+的加入信号逐渐减小,当加入Zn2+与L的物质的量比为2∶1(0.4 mol/L)时,羟基质子(Ha)和酰肼NH质子(Hc)几乎消失。上述现象表明,L识别Zn2+确实是以配位方式识别的。
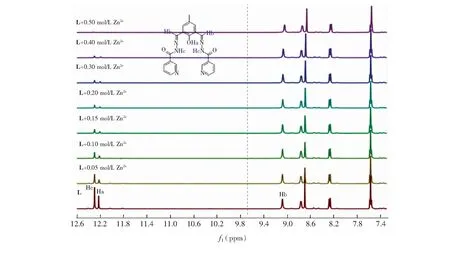
图8 L与Zn2+在DMSO-d6和D2O(9∶1, V/V)中的1H NMR滴定谱图Fig.8 Partial 1H NMR spectra of ProboL with different concentrations of Zn2+ in DMSO-d6:D2O=9∶1(V/V)
3.4 探针L检测水样、血清和药物中金属Ca2+、Cu2+和Zn2+
将L应用于药品(多种微量元素注射液Ⅱ)、水样(遵义市湘江河水及遵义医学院自来水)和血清(遵义医学院附属医学院检验科血清样本)样品中Ca2+、Cu2+和Zn2+含量测定。水样和血清中Cu2+的回收率见表1;探针L对多种微量元素注射液Ⅱ示值为1.135 mg/mL的Zn2+和Ca2+测定结果均为1.11 mg/mL(n=5),相对标准偏差(RSD)值均小于5%,说明探针L在测定实际样品中Ca2+、Zn2+和Cu2+方面有潜在的应用价值。
3.5 探针L应用于Ca2+和Zn2+荧光成像
3.5.1探针L用于活细胞中Ca2+和Zn2+荧光显微成像为考察探针L用于活细胞中荧光显微Ca2+和Zn2+成像的可行性,首先采用MTT法考察了探针L对HepG2活细胞存活率影响,结果(图S26)表明,L对HepG2活细胞具有较低的细胞毒性。进一步研究了L在活细胞中Ca2+和Zn2+荧光显微成像。由图9可见,HepG2细胞与L孵育2 h后,未观察到荧光信号。在同样条件下,当加入Ca2+或Zn2+,继续孵育30 min后,在活细胞中观测到明亮的荧光(图9G和9H),表明L具有良好的细胞渗透性,可用于检测活细胞中的Ca2+和Zn2+。
3.5.2探针L在斑马鱼活体中的Ca2+和Zn2+荧光显微成像用5天龄斑马鱼幼体进行活体中Ca2+和Zn2+荧光显微成像。由图10可见,经斑马鱼活体及斑马鱼和L孵化30 min后,几乎观测不到荧光,表明斑马鱼幼体体内Ca2+和Zn2+水平极低。而将经L孵化后的斑马鱼再分别与Ca2+或Zn2+一起孵育后, 在斑马鱼体内观察到强的荧光,尤以Zn2+在斑马鱼头部及尾部观察到荧光最强。 整个成像过程,斑马鱼幼体状态良好,表明L对斑马鱼的毒性很小,能用于活体中Ca2+和Zn2+荧光成像检测,尤其是对Zn2+荧光成像检测更为显著。
表1L对水样及血清中Cu2+的加标回收率
Table 1 Recovery of Cu2+in water samples and serum
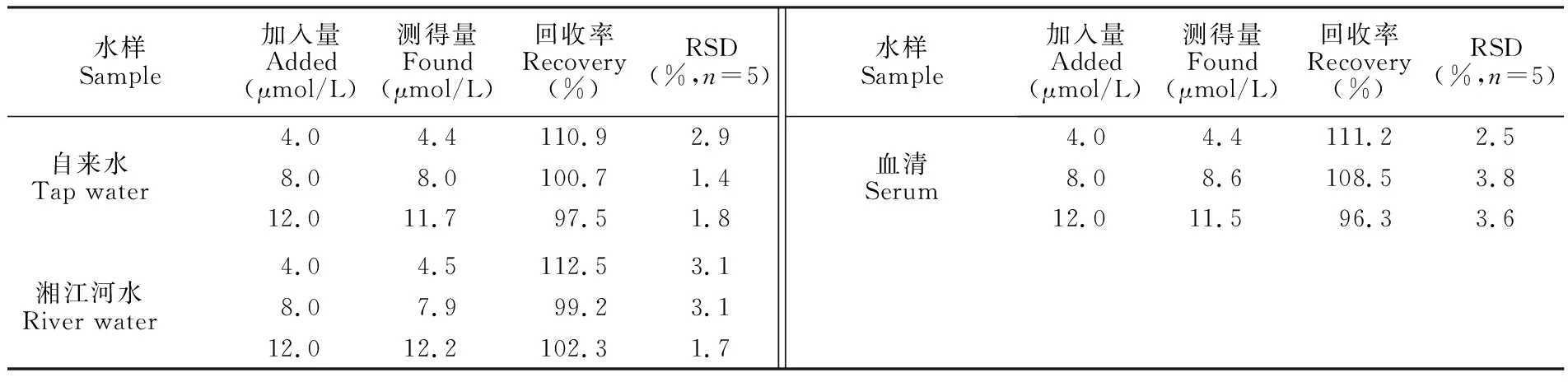
水样Sample加入量Added (μmol/L)测得量Found (μmol/L)回收率Recovery (%)RSD(%,n=5)自来水Tap water湘江河水River water4.04.4110.92.98.08.0100.71.412.011.797.51.84.04.5112.53.18.07.999.23.112.012.2102.31.7水样Sample加入量Added (μmol/L)测得量Found (μmol/L)回收率Recovery (%)RSD(%,n=5)血清Serum4.04.4111.22.58.08.6108.53.812.011.596.33.6

图9 探针L在HepG2细胞中识别Ca2+或Zn2+的荧光成像图(A~D) 明场通道成像;(E~F) 蓝色荧光通道成像。(A和E)未经任何处理的HepG2细胞;(B和F) HepG2细胞加入探针L后孵育30 min后的成像结果;(C和G) HepG2细胞加入探针L后孵育30 min后再加入Ca2+继续孵育30 min的成像结果;(D和H) HepG2细胞加入探针L后孵育30 min后再加入Zn2+继续孵育30 min的成像结果Fig.9 In vitro fluorescence imaging of Ca2+ or Zn2+ in HepG2 cells using probe L (A-D) Bright-field images; (E-F) Fluorescence images in blue channel. (A and E) HepG2 cells without probe L; (B and F) HepG2 cells incubated with probe L for 30 min; (C and G) HepG2 cells incubated with probe L for 30 min, and further incubated with Ca2+ for 30 min; (D and H) HepG2 cells incubated with probe L for 30 min, and further incubated with Zn2+ for 30 min

图10 探针L在斑马鱼中识别Ca2+或Zn2+的荧光成像图。(A~D)明场通道;(E~F)蓝色荧光通道。(A和E)未经任何处理的斑马鱼;(B和F) 斑马鱼中加入探针L后孵育30 min后的成像结果;(C和G) 斑马鱼中加入探针L后孵育30 min后再加入Ca2+继续孵育30 min的成像结果;(D和H) 斑马鱼中加入探针L后孵育30 min后再加入Zn2+继续孵育30 min的成像结果Fig.10 In vivo fluorescence imaging of Ca2+ or Zn2+ in living zebra fishes using probe L (A-D) Bright-field images. (E-F) Fluorescence images in blue channel. (A and E) zebra fishes without probe L; (B and F) zebra fishes incubated with probe L for 30 min; (C and G) zebra fishes incubated with probe L for 30 min, and further incubated with Ca2+ for 30 min; (D and H) zebra fishes incubated with probe L for 30 min, and further incubated with Zn2+ for 30 min
3.5.3探针L用小鼠体内Ca2+和Zn2+荧光成像由图11可见,空白鼠和皮下注射探针L的小鼠均未观察到荧光。当在皮下注射探针L后的同一位置注射Ca2+或Zn2+后,随即观察到显著的荧光。整个实验过程中,小鼠体征未出现异常,且继续喂养3 d未死亡,表明L对小鼠毒性很小,并能快速地在体内荧光成像检测Ca2+和Zn2+。
将L用于B16F10肿瘤模型小黑鼠肿瘤组织Ca2+和Zn2+的荧光成像检测。由图12可见,空白肿瘤组织(图12A)和仅注射L的肿瘤组织(图12B左侧肿瘤)未见荧光,当在肿瘤组织注射L并再注射Ca2+或Zn2+后,能观察到显著的荧光(图12B右侧肿瘤)。实验后继续喂养3天,B16F10肿瘤模型小黑鼠未出现异常或死亡,说明探针L经肿瘤注射后对小鼠毒性小,并能快速地在肿瘤组织内荧光成像检测Ca2+和Zn2+。

图11 探针L用小鼠体内Ca2+和Zn2+荧光成像(A)空对照组;(B)左侧:皮下组织注射探针L(100 μL, 50 μmol/L), 右侧:皮下组织注射探针L(100 μL, 50 μmol/L),随后注射Ca2+(100 μL, 50 μmol/L);(C) 左侧:皮下组织注射探针L(100 μL, 50 μmol/L), 右侧:皮下组织注射探针L(100 μL, 50 μmol/L),随后注射Zn2+ (100 μL, 50 μmol/L)。λex=460 nm, λem=520 nmFig.11 Fluorescence imaging of Ca2+ and Zn2+ in the healthy mice using probe L(A) Control; (B) Left: subcutaneous tissues given an injection of probe L (100 μL, 50 μmol/L). Right: subcutaneous tissues given an injection of probe L (100 μL, 50 μmol/L), and followed by an injection of Ca2+ (100 μL, 50 μmol/L). (C) Left: subcutaneous tissues given an injection of probe L (100 μL, 50 μmol/L). Right: subcutaneous tissues given an injection of probe L (100 μL, 50 μmol/L), and followed by an injection of Zn2+ (100 μL, 50 μmol/L). λex=460 nm, λem=520 nm

图12 探针L在B16F10肿瘤模型小黑鼠体内Ca2+和Zn2+的荧光成像(A) 左侧:在肿瘤组织部位注射探针L(100 μL,50 μmol/L),右侧:在肿瘤组织部位注射探针L(100 μL, 50 μmol/L),随后注射Ca2+(100 μL, 50 μmol/L);(B) 左侧:在肿瘤组织部位注射探针L(100 μL, 50 μmol/L),右侧:在肿瘤组织部位注射探针L(100 μL, 50 μmol/L),随后注射Zn2+(100 μL, 50 μmol/L);λex=460 nm, λem=520 nmFig.12 Fluorescence imaging of Ca2+ or Zn2+ in B16F10 cells tumor-bearing mice using probe L(A) Left: tumor tissues given an intra-tumor injection of probe L (100 μL, 50 μmol/L). Right: tumor tissues given an intra-tumor injection of probe L (100 μL, 50 μmol/L), and followed by a intra-tumor injection of Ca2+(100 μL, 50 μmol/L). (B) Left: tumor tissues given an intra-tumor injection of probe L (100 μL, 50 μmol/L). Right: tumor tissues given an intra-tumor injection of probe L (100 μL, 50 μmol/L), and followed by a intra-tumor injection of Zn2+(100 μL, 50 μmol/L). λex=460 nm, λem=520 nm
4 结 论
将2,6-二甲酰基对甲基苯酚与烟酸酰肼在乙醇中简便一步合成得到具有多个N、O配位原子的双席夫碱探针L。在无水乙醇-Tris-HCl缓冲液(9∶1,V/V, pH 7.40)中,通过紫外-可见吸收光谱和荧光光谱法研究其对常见18种金属离子和18种阴离子的识别性能,结果表明, 探针L能同时对Ca2+、Cu2+和Zn2+表现出较高的灵敏度和选择性。对Ca2+、Cu2+和Zn2+检出限分别为9.0×10-7mol/L、9.2×10-7mol/L和5.1×10-7mol/L,且L在实际样品中(药物、水样和血清) 对Ca2+、Cu2+和Zn2+离子具有良好的识别效果。此外,探针L还可在HepG2细胞、斑马鱼和活体小鼠中对Ca2+和Zn2+成像检测。本研究结果对检测生物活体中金属离子研究具有重要参考价值。

