一种新型电化学-质谱联用系统的研制
崔利利 魏忠林 费 强* 李 明
1(吉林大学化学学院,长春 130012) 2(中国计量科学研究院化学计量与分析科学研究所,北京10029)
1 引 言
电化学通过测量电流和电压的变化研究电极表面和电解质溶液的浓度及电化学反应,因其具有灵敏、快速、价廉等优势而被广泛使用[1]。然而,仅依靠电信号不能直观地识别出复杂氧化还原反应的中间体和产物,因此对于电化学反应机理的研究仍存在一定的挑战。质谱是一种通过对质荷比(m/z)测量直接获得待测物分子量的分析技术[2],可以快速鉴定电化学氧化还原反应的中间体和产物,并由此推断出电化学反应机理。因此,电化学-质谱联用成为解决电化学现有问题的有力工具[3]。此外,电化学-质谱联用技术因其快速、高效等优势,在蛋白质组学[4]、药物代谢[5]等领域具有广泛应用前景。接口技术是电化学-质谱联用技术的关键。1971年,Bruckenstein等[6]首次将电化学与质谱联用,利用特氟隆疏水膜直接与多孔电极相连,挥发性气体可透过扩散膜并由电子轰击离子源(Electron impact ion source, EI)进行离子化,从而实现质谱检测。Hambitzer等[7]利用热喷雾作为接口,开发了电化学与质谱联用系统,并研究了N,N-二甲基苯胺的电化学氧化过程。1995年,电喷雾(Electrospray ionization, ESI)技术首次被用于电化学与质谱的联用接口[8]。目前,ESI是电化学与质谱联用系统的主要接口。然而,被施加高电压的电喷雾针和接地的质谱仪入口构成了一个回路,使ESI源本身成为一个电化学池,能够诱导发生氧化或还原副反应[9]。为避免ESI中副反应的发生,需要实现EC与ESI的分离。
可与质谱联用的电化学装置主要包括多孔电解池、薄层电解池和微流体芯片电解池。Bruins研究组采用多孔电解池的EC-MS系统成功模拟了药物代谢的过程[10],并实现了电化学代替化学试剂或酶试剂对蛋白质或多肽的裂解[11]。虽然多孔电解池的电极氧化还原效率高,但电极不易清洗。薄层电解池的电极可以通过抛光清洗保持电极表面活性,但薄层电极的氧化还原效率比多孔电极低,所以为了提高其电化学转换效率,流速通常小于10 μL/min[12]。由于非挥发性的无机盐会抑制质谱信号,同时会污染质谱接口和离子透镜,所以在EC-MS中,通常使用甲酸铵或乙酸铵作为电解质[7]。在EC-MS系统中,可以根据实验需要选择电极材料,常用的电极材料包括玻碳电极[13]、铂电极、汞电极[14]、掺硼的金刚石电极[15]和钛电极[16]等,但很少有研究者使用玻碳电极进行电化学还原反应。本研究选择薄层电解池作为电化学反应池,玻碳电极作为工作电极,0.1% (V/V)甲酸作为支持电解质,流速设定为4 μL/min。
在以电喷雾离子源作为电化学与质谱联用的接口技术时,如在电化学池与质谱仪之间不采取任何措施,直接施加在喷雾针上的高电压会对电化学恒电位仪电路系统造成损坏。为解决此问题,Kraj等在2013年提出的一种新型快速还原二硫键的电化学与质谱联用的系统中,特别强调电化学池与质谱仪之间接地线的去耦合作用[16]。在此之前,Berkel等已经提出在电化学池的出口与质谱仪之间使用约30 cm的管路线[17],或在电喷雾质谱系统之前插入一个接地线[18],或让整个EC/ESI-MS系统浮在由ESI高电压诱导的电压之中[19],以避免直接施加在喷雾针上的高电压对电化学恒电位仪的影响。近年来,常压质谱技术[20,21]的出现,也为解决这一问题提供了新思路。例如,解吸电喷雾(Desorption electrospray ionization, DESI)以高的耐盐性、结构简单等优势成功实现了EC-MS的连接,并且电化学池与质谱仪不直接相连,因此不需要去耦合装置[22]。另外,Bruins在其综述[23]中也指出,接地的ESI喷雾针可完全消除上游电流的影响。
本研究提出了一种新型电化学与质谱联用系统,采用喷雾针接地设计的电喷雾离子源作为接口技术,避免了直接施加在喷雾针上的高电压对电化学恒电位仪的耦合作用,可实现EC和MS的直接在线联用,并且简化了仪器结构。为考察仪器性能,以氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)作为模型样品,考察了多肽在该系统中的氧化还原行为。
2 实验部分
2.1 仪器与试剂
氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)购自Aladdin公司; 二硫苏糖醇(DTT,Sigma公司); 甲醇(色谱级,Burdick﹠Jackson公司); 甲酸(色谱级,Roe Scientific公司); 谷胱甘肽片(阿拓莫兰)购自于本地药店; 5 mmol/L醋酸铵缓冲液(pH 5.5)用氨水和醋酸配制并调节pH值。
电化学氧化还原实验在薄层电化学电池与Bruker HCT高容量离子阱质谱仪(Bruker公司)在线联用装置上完成,如图1所示。由于电喷雾离子源(Bruker公司)采用质谱入口施加反向高电压的方式对样品进行离子化,因此喷雾针接地,并不施加任何电压,这种设计能够实现EC与ESI高电压的分离,从而避免电喷雾的高电压对电化学恒电位仪电路系统的损坏。薄层电化学池包括嵌入在PEEK内直径为3 mm的双玻碳工作电极(WE)、Ag/AgCl(3 mol/L NaCl)参比电极(RE)和含有一个小孔的不锈钢辅助电极(AE)。此电解池由50 μm厚的聚四氟乙烯垫片组成,体积约为7 μL。实验使用DY2300恒电位仪(日本Digi-Ivy公司)。

图1 电化学-质谱联用系统示意图,包括注射泵、薄层电化学池和离子阱质谱仪Fig.1 Schematic of electrochemistry with mass spectrometry (EC-MS) set up. The device includes a syringe pump, an electrochemical cell and an ion trap mass spectrometer
质谱参数:正离子模式; 毛细管电压为4000 V; 雾化气N2的压力为310 kPa; 干燥气N2的流速和温度分别为4.0 L/min和300℃; 质量范围设为m/z100~650。二级质谱参数:碰撞气为氦气,母离子选择的窗口宽为m/z1.0,碰撞诱导解离(Collision induced dissociation, CID)能量为0.3~1.2 eV。质谱数据处理使用CompassTM软件(版本4.0),所列质谱图均为采集0.3 min的平均值。
2.2 实验方法
2.2.1氧化型谷胱甘肽(GSSG)的还原采用经典的DTT化学试剂还原二硫键[24]: 250 μmol/L氧化型谷胱甘肽溶于含有100 mmol/L DTT的5 mmol/L醋酸铵缓冲溶液(pH 5.5),在37℃下孵育30 min。立即冷却样品,抑制进一步还原。将溶液用甲醇-超纯水(1∶1,V/V)稀释至50 μmol/L,直接进入质谱测试。
在线电化学与质谱联用系统还原二硫键:将氧化型谷胱甘肽冻干粉用含有1%(V/V)甲酸-甲醇(1∶1,V/V)稀释至250 μmol/L,用氮气除氧20 min。玻碳电极先在抛光布上用3、1和0.5 μm 的氧化铝依次抛光,待表面打磨光滑后,在蒸馏水中超声清洗10 min。样品溶液由注射泵进样,以4 μL/min 的流速(图1红线)流经电化学池进行电化学反应,反应产物通过不锈钢电极的小孔流出电化学池,进入电喷雾中进行离子化。同时,恒电位仪施加-1.7 V 恒电压对样品进行还原。
2.2.2还原型谷胱甘肽的氧化在线的电化学与质谱联用系统氧化GSH与还原GSSG的实验步骤基本相同,不同之处是, 在氧化过程中,施加2.0 V 恒电压; 还原过程中,施加-1.7 V的恒电压。
2.2.3样品的制备取一片谷胱甘肽片(阿拓莫兰)研磨,超声溶解于10 mL超纯水中,离心,取上清液,用1%(V/V)甲酸-甲醇(1∶1,V/V)稀释5倍,待测。
3 结果与讨论
3.1 氧化型谷胱甘肽(GSSG)的还原
一个GSSG分子的二硫键加氢还原生成两个GSH分子,两个GSH分子通过脱氢氧化生成一个GSSG分子,其反应机理如式(1)所示。

(1)
为了考察在线电化学与质谱联用系统还原二硫键的仪器性能,首先使用了文献中最常采用的化学试剂还原二硫键的实验方法,评估了将肽与过量的DTT在37℃温育30 min后达到的二硫键降低程度。如图2A所示,经DTT还原后的GSSG,一级质谱图显示m/z308(GSH)与m/z613(GSSG)的峰,说明在上述条件下,DTT并未将GSSG完全还原。为了验证这一推测,分别对m/z308与m/z613进行二级碎裂,如图2B和图2C所示,碎片离子的分析结果表明,DTT的确将氧化型谷胱甘肽进行还原,且通过加氢生成了还原型的谷胱甘肽。

图2 (A)氧化型谷胱甘肽(GSSG)经DTT还原后的一级质谱图; (B)经DTT还原后的氧化型谷胱甘肽(GSSG)m/z 308的MS/MS图; (C)经DTT还原后的氧化型谷胱甘肽(GSSG)m/z 613的MS/MS图Fig.2 (A) Mass spectrum of GSSG after dithiothreitol(DTT) reduction; (B) MS/MS spectrum of GSSG after DTT reduction at m/z 308 ; (C) MS/MS spectrum of GSSG after DTT reduction at m/z 613
对在线电化学与质谱联用系统还原二硫键进行考察。电化学池未施加电压时,GSSG样品的质谱图见图3,m/z307.1和m/z613.1分别为[GSSG+2H]2+和[GSSG+H]+。当对EC施加-1.7 V 电压后,[GSSG+2H]2+峰强度下降了83.3%,[GSSG+H]+峰强度下降了88.6%; 并且出现了强度较高的m/z308.1和m/z615.1峰,分别为[GSH+H]+和[2GSH+H]+。为进一步确证GSSG在电化学池中发生了还原反应,对GSH标准品和GSSG发生电化学还原后的反应产物m/z308分别进行CID碎裂,结果如图4所示。图4A和图4B的二级质谱图都含有[M-H2O]+、b2、y2和y2-NH3离子。由此可知,GSSG中的一对二硫键通过获得2个氢原子被还原为GSH(见式(1))。氧化型谷胱甘肽GSSG是2个GSH通过脱氢氧化形成一对链间二硫键的多肽。在电化学中,很难通过循环伏安法发现二硫键的还原,但通过电化学-质谱联用系统,利用质谱进行直观的分子量测定及串联技术,能直接观察到GSSG与GSH之间的转换。本实验GSSG的电化学还原结果和生成产物GSH的二级碎裂图结果与以DESI作为电化学与质谱联用的接口技术结果[20]一致。

图3 氧化型谷胱甘肽(GSSG)在电化学池(A)未施加电压和(B)施加-1.7 V电压后的质谱图。插图为m/z 307.1的放大图Fig.3 Mass spectra of GSSG (A) without and (B) with a potential of -1.7 V applied to EC. Insets: the enlarged spectra of m/z 307.1
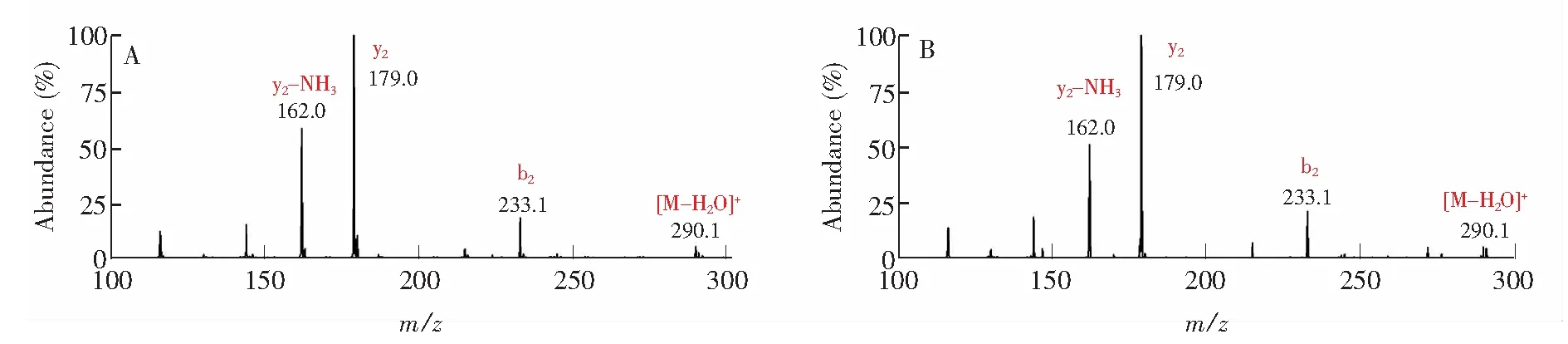
图4 (A)还原型谷胱甘肽(GSH)标准品的MS/MS谱图; (B)氧化型谷胱甘肽(GSSG)在电化学池施加-1.7 V电压后的还原产物m/z 308的MS/MS图Fig.4 (A) MS/MS spectrum of GSH standard; (B) MS/MS spectrum of on-line reduced GSSG with a potential of -1.7 V applied to EC
对比上述两个实验可知,在线电化学与质谱联用系统可实现多肽中二硫键的还原,并且在电化学与质谱联用的系统中,无需使用有机还原剂等化学试剂,无需样品前处理,允许直接的电化学还原进行质谱的分析,简化了实验操作,体现了此装置高效快速等优势。同时,基于质谱的碎裂定性功能,可直接对GSSG的还原产物GSH进行结构分析。
3.2 还原型谷胱甘肽(GSH)的氧化
当GSH样品溶液进入电化学-质谱联用系统时,获得的质谱图如图5A所示,m/z308.1和m/z615.1分别为[GSH+H]+和[2GSH+H]+。当电化学池施加2.0 V 的恒电位后,[GSH+H]+峰强度下降了71.7%,同时,出现了m/z613.1 [GSSG+H]+信号(如图5B)。由此可知,GSH在2.0 V的玻碳电极上发生了电化学氧化反应,生成了GSSG。对比电化学池施加电压前后的结果可知,施加电压后确实发生了电化学反应。如图5A所示,如若不加电压,所得结果与直接质谱进样相同。

图5 还原型谷胱甘肽(GSH)溶液在电化学池(A)未加电压(B)施加2.0 V电压时质谱图Fig.5 Mass spectra of GSH (A) without and (B) with a potential of 2.0 V applied to EC
为进一步验证GSSG的生成,对电化学反应产物m/z613进行碎裂,获得二级质谱图,并将其与GSSG标准品的二级质谱图进行对比,结果如图6所示。GSSH标准品的母离子m/z613.1在CID条件下的MS/MS谱图见图6A,m/z595.1为[M+H-H2O]+;m/z484.1为[M+H-E]+,即失去一个谷氨酸残基的碎片;m/z409.0为[M+H-H2O-E-G]+, 即失去一分子水、一个谷氨酸残基和一个甘氨酸残基之后的碎片;m/z355.0为[M+H-2E]+,即失去两个谷氨酸残基的碎片。GSH溶液在电化学池施加2.0 V电压后,产物m/z613.1在CID条件下的MS/MS质谱图如图6B。图6A与图6B完全一致,表明2个GSH通过电化学氧化失去2个氢原子形成二硫键,反应产物为GSSG(式(1)), 同时也表明EC-MS系统能实现GSH中的巯基氧化,并直接对反应产物进行质谱鉴定。
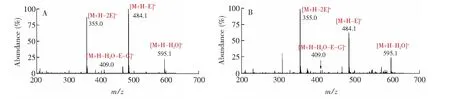
图6 (A)氧化型谷胱甘肽(GSSG)标准品m/z 613的MS/MS图;(B)还原型谷胱甘肽(GSH)溶液在电化学池施加2.0 V电压时氧化产物m/z 613的MS/MS图。图中M为GSSGFig.6 (A) MS/MS spectrum of GSSG standard; (B) MS/MS spectrum of GSH with a potential of 2.0 V applied to EC. M represent GSSG
3.3 谷胱甘肽片(阿拓莫兰)药品中GSH的含量测定
为了进一步评价此装置的性能,对谷胱甘肽片(阿拓莫兰)药品中GSH的含量进行了半定量分析。首先,利用质谱法的二级碎裂对不同GSSG的浓度进行测定。在0.04~2.00 μg/mL范围内,GSSG碎片离子m/z484.1的强度(y)与GSSG的质量浓度(x)有良好的线性关系,线性方程为y=312312x-28735(R2= 0.98)。
基于上述结果,将0.5 mg/mL GSH以4 μL/min的流速进入电化学与质谱联用系统,施加2.0 V电压,对反应生成的m/z613的GSSG进行二级碎裂,根据采集到的碎片离子m/z484.1的强度(26760),得到生成的GSSG的浓度为0.178 μg/mL。
同时,将稀释5倍的谷胱甘肽片(阿拓莫兰)药品以同样的流速进入电化学与质谱联用系统,获得的质谱图如图7A所示,m/z308.1和m/z615.1分别为[GSH+H]+和[2GSH+H]+。当电化学池施加2.0 V的恒电位后,出现了m/z613.1 [GSSG+H]+信号(图7B)。同时,对反应生成的m/z613的GSSG进行二级碎裂,采集到的碎片离子m/z484.1的强度(40931),根据上述线性方程,求出对应的生成GSSG的浓度为0.2231 μg/mL。通过电化学氧化效率的转换,得出该稀释后的样品中GSH的含量为0.6277 mg/mL,则每片谷胱甘肽片(阿拓莫兰)药品中GSH的含量为31.39 mg。

图7 实际样品溶液在电化学池(A)未加电压(B)施加2.0 V电压时质谱图Fig.7 Mass spectra of practical sample (A) without and (B) with a potential of 2.0 V applied to EC
4 结 论
提出了一种新型电化学与质谱联用系统,采用喷雾针接地的电喷雾离子源作为EC-MS的接口, 选择氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)作为典型样品,考察了联用系统的性能。结果表明,在研究巯基的氧化和二硫键的还原时,新构建的EC-MS联用系统具有明显优势:(1)在本实验过程中,无需使用有机还原剂等化学试剂,无需样品前处理,简化了实验操作;(2)使用喷雾针接地设计的ESI作为EC-MS联用的接口,无需去耦装置,既简化了仪器结构,又避免了质谱离子源处的高电压对电化学恒电位仪的损坏;(3)由于质谱定性分析能力强,可通过MS/MS直接对电化学反应产物进行表征。此电化学-质谱系统在电化学反应产物和中间体的鉴定、蛋白质组学、药物代谢等领域具有良好的应用前景。

