赶酸对微波消解-氢化物发生-原子荧光光谱法测定谷物中砷元素的影响
段 旭 韩张雄 白新悦 董亚妮 刘 隆
(陕西省矿产资源勘查与综合利用重点实验室,国土资源部西安矿产资源监督检测中心,西安 710054)
前言
砷元素普遍存在于大自然中,被认为是主要的污染重金属元素之一[1-3]。同时砷在生物体内具有富集作用。由于在农业生产中长期施用大量的含砷农药及化肥,造成农产品受到砷污染[4-5]。谷物类作物是我国主要的农作物,其受到砷污染将会威胁到食品安全和人体健康,因此砷元素的检测在农业及生态安全检测中一直被列为重点检测项目[6-8]。现阶段砷元素的检测普遍采用干法或湿法消解,氢化物发生-原子荧光光谱法[9-11]测定,在消解的过程中,由于干法或者湿法敞开式消解均有较长的流程,且湿法消解耗酸量过大,容易造成砷污染[12],而用硝酸进行消解时,如果赶酸不彻底,则会造成还原相对困难,而赶酸时间过长或温度过高则会造成砷元素损失,进而影响砷元素的准确测定[13]。因此,本研究通过微波消解后进行赶酸实验,获得最佳的消解方式、赶酸温度、赶酸时间,为准确测定谷物中砷元素提供技术保障。
1 实验部分
1.1 实验试剂
硝酸:HNO3,分析纯,西陇科学,500 mL/瓶,通过纯化处理;
过氧化氢:H2O2,优级纯,科密欧,500 mL/瓶;
盐酸:HCl,优级纯,德国默克,1 000 mL/瓶;
硫脲:H2NCSNH2,分析纯,天津天力;
抗坏血酸:C6H8O6,优级纯,成都科龙;
硼氢化钾:KBH4,分析纯,成都科龙;
氢氧化钾:KOH,优级纯,天津科密欧;
硫脲和抗坏血酸:称取10.0 g硫脲溶于80 mL水中,加入10.0 g抗坏血酸,彻底溶解,搅拌均匀,用时现配;
硼氢化钾和氢氧化钾:称取5.0 g氢氧化钾溶于1 000 mL水中,加入20.0 g硼氢化钾溶解,搅拌均匀,用时现配。
1.2 实验用标准物质及配制
小麦成分分析标准物质:GBW10011,GBW10046;大米成分分析标准物质:GBW10010,GBW10043;玉米成分分析标准物质:GBW10012(购于中国地质科学院地球物理地球化学勘查研究所)。
砷标准储备溶液:c(As)=100.0 mg/L,BW30018-100-N-50,购于坛墨质检标准物质中心。
砷标准溶液(10 mg/L):准确吸取10.00 mL砷标准储备溶液(100.0 mg/L)于100 mL容量瓶中,用硝酸溶液(2+98)稀释定容至刻度;按照稀释办法,依次获得100 μg/L、10 μg/L的标准使用液。
1.3 实验用仪器设备
AFS-2000原子荧光分光光度计(北京海光仪器公司),砷(As)空心阴极灯(西北有色研究院研制)。微波消解仪(配有聚四氟乙烯消解内罐,Milestone ETHOSE UP);
SD2000酸纯化器(北京莱伯泰科仪器有限公司);
CT351-35控温电热板:在50~300 ℃可控温,天津拓至明实验仪器技术开发有限公司;
BSA-224S电子天平:感量为0.1 mg,赛多利斯科学仪器有限公司。
1.4 仪器的工作条件
原子荧光光谱仪工作条件:砷高性能空心阴极灯,灯电流60 mA,负高压300 V,原子化器高度8 mm,炉温200 ℃。微波消解程序见表1。
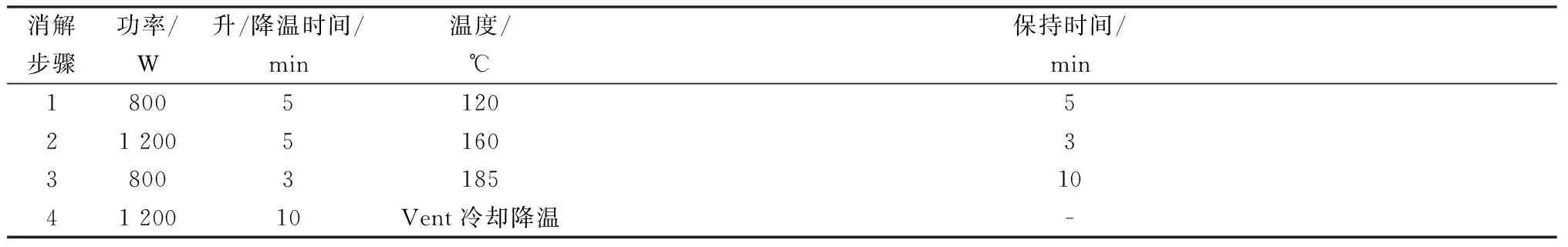
表1 微波消解样品程序Table 1 Program of microwave digestion samples
1.5 样品前处理
称取0.50 g(精确至0.000 1 g)试样于微波消解罐中,加入8 mL硝酸、2 mL 过氧化氢,放置 30 min后将样品放入微波消解仪中进行消解,微波消解程序见表1。消解完成后用去离子水洗涤微波消解罐3~4 次,合并洗液于50 mL比色管中,摇匀后抽取10 mL消解液于聚四氟乙烯烧杯内,在可控温电热板上于160 ℃加热赶酸至试液体积小于1 mL,取下,放至室温,加入5 mL硫脲和抗坏血酸溶液,摇匀后转移至刻度比色管中,定容至10 mL,摇匀后放置30 min以上充分还原,待测。试验过程中制备空白3份。
2 结果与讨论
2.1 消解条件的选择
通过设定微波消解程序,微波消解仪功率和温度过高会引起样品泄压不均,造成样品损失,而温度和功率设定太低,又达不到将样品彻底消解的目的[14],通过实验,获得谷物类样品的最佳消解程序(表1),样品通过逐级升温,消解结束后消解液呈无色透明状,可消解完全。
2.2 微波消解与其他消解方式结果对比
由表2可以得出,不同消解方式对谷物中砷元素的测定结果影响不大,且均与标准值相吻合,微波消解法结果介于干法灰化法和湿法消解之间,说明了微波消解-氢化物发生原子荧光光谱法可用于谷物样品中砷元素的测定。

表2 不同消解方法对砷元素测定结果的影响Table 2 Effect of different digestion methods on the results of As in cereal standard matters /(ng·g-1)
2.3 赶酸温度对砷元素测定结果的影响
由表3可以看出,固定赶酸时间为2 h,不同赶酸温度对微波消解-氢化物发生-原子荧光光谱法测定谷物类样品中砷的结果具有较大的影响。随着赶酸温度的升高,谷物中砷元素的测定值先增大后减小,在160 ℃时达到最大值,也与标准值最吻合,在赶酸温度为120、140 ℃时,可能由于温度太低,在两小时内未能将试液中的硝酸完全赶净,而硝酸具有氧化性,可以消耗硫脲-抗坏血酸,因此影响其还原效率,从而造成砷元素测定结果偏低[15]。而在180、200 ℃时,在赶酸时间为2 h时,由于温度过高,造成砷元素挥发损失。

表3 赶酸温度对砷元素检测结果的影响Table 3 Effect of different temperatures of acid catching on the results of As in cereal standard matters/(ng·g-1)
2.4 赶酸时间长度对砷元素测定结果的影响
在赶酸温度为160 ℃时,进行赶酸时间实验,结果如表4所示,在赶酸时间小于2 h时,由于试液中硝酸含量过高,影响了砷元素的还原效果,所以造成结果偏低;而赶酸时间过长,又会造成砷元素的损失,结果偏低。
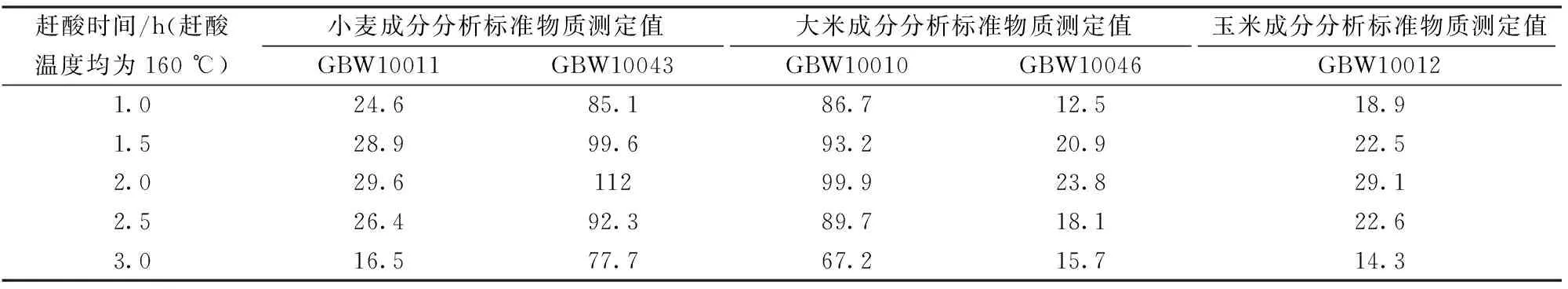
表4 赶酸时间长度对砷元素测定结果的影响Table 4 Effect of the time length of acid catching on the results of As in cereal standard matters /(ng·g-1)
2.5 标准曲线与检出限
仪器最佳工作条件下,采集空白和标准溶液系列,仪器自动绘制标准曲线。砷元素的线性范围在10 μg/L以内为线性,标准曲线拟合方程为y=0.002 8x-0.172 8,线性相关系数R2为0.999 3。在仪器工作条件下,对12份过程空白溶液进行测定,以其结果的3倍标准偏差所对应的浓度值作为方法检出限,得出砷元素的检出限为1.72 ng/g。
2.6 方法的精密度和准确度实验
按实验方法对谷物类标准物质(GBW10010、GBW10011、GBW10012、GBW10043、GBW10046)平行测定12次,对方法的精密度进行了实验,砷元素的相对标准偏差和准确度实验结果见表5。从表5可以看出测定元素的相对标准偏差RSD在4.3%~7.6%,砷元素的测定值与标准值一致,相对误差小于±6.5%。

表5 方法准确度和精密度实验Table 5 Accuracy tests and precision tests of the method(n=9)
3 结论
通过选择合适的赶酸温度及赶酸时间,利用微波消解升温程序,氢化物发生-原子荧光光谱法测定谷物类样品中的砷元素,并测定其精密度、准确度,结果显示,在本方法中控制好赶酸温度和赶酸时间,能够快速准确地测定谷物中砷元素,方法准确可靠。适用于大批量谷物类样品中砷元素的检测工作。

