猪源耐药性大肠杆菌的分离与鉴定
李 杰 杭柏林董萌萌 宁春妹 司素锦 胡建和
(1河南省新乡市畜产品质量监测检验中心,河南新乡 453003;2河南科技学院动物科技学院,河南新乡 453003)
大肠杆菌是革兰氏阴性细菌的典型代表,是人与动物及环境中的常见细菌[1-2]。某些致病性大肠杆菌菌株可导致宿主的疾病[3]。某些血清型的大肠杆菌可致仔猪的黄痢、白痢和水肿病[4-5]。使用抗生素是治疗和预防猪大肠杆菌病的常用措施。而在实际生产中,抗生素的滥用或不正确使用常常导致大肠杆菌产生耐药性或超级细菌[6-8]。耐药菌的出现给大肠杆菌病的治疗和预防带来了极大挑战。因此,必须及时关注猪体内大肠杆菌的耐药性情况,以期为猪大肠杆菌病的治疗和预防提供参考。本试验从腹泻猪体内分离、鉴定到一株耐21种抗生素的大肠杆菌,为猪大肠杆菌病的预防和治疗奠定了基础,也提出了挑战。
1 材料与方法
1.1 样品来源
2017年,5份粪便样本采集自河南省南阳市某猪场腹泻猪的十二指肠,4℃保存。
1.2 试剂与仪器
普通营养琼脂、SS琼脂、伊红美兰(EMB)琼脂、麦康凯(Maconkey)琼脂购自北京奥博星生物技术有限责任公司,胰酶解酪蛋白大豆肉汤(TSB)购自广东环凯微生物科技有限公司。绵羊血和革兰氏染色试剂盒购自北京索莱宝科技有限公司。抗菌药物药敏纸片及细菌微量生化反应管均购自杭州微生物试剂有限公司。HBI肠杆菌科细菌生化鉴定条购自青岛高科技工业园海博生物技术有限公司。2×Taq PCR Master Mix、DNA分子量标准、细菌基因组DNA提取试剂盒以及DNA纯化回收试剂盒购自北京百泰克生物技术有限公司。琼脂糖购自上海蓝季科技发展有限公司。pMD19-T载体购自宝生物工程(大连)有限公司,大肠杆菌DH5a为本实验室自行保存。其他试剂均为国产分析纯。
恒温培养箱(型号为DHP-9082),购自上海一恒科学仪器有限公司;高压蒸汽灭菌器(型号为LDFF-75KB),购自上海申安医疗器械厂;超净工作台(型号为SW-CJ-2F),购自苏州净化设备有限公司;PCR仪(型号为T-Gradient Thermoblock),购自德国Sartocon公司;电泳仪(型号为DYY-6C),购自北京市六一生物科技有限公司;凝胶成像系统(型号为Universal Hood II),购自美国BIO-RAD公司;高速离心机(型号为D-37620),购自美国热电公司;光学显微镜(型号为BA310Digital),购自麦克奥迪实业集团有限公司。
1.3 细菌的分离与培养
用灭菌的磷酸盐缓冲液(PBS,pH7.2)将粪便样品稀释100倍。将50 μL稀释液加入含有普通营养琼脂培养基的培养皿中,并用“L”型玻璃推棒涂布均匀。将接种后的培养皿置于37℃培养箱中培养约18~24 h。挑取可疑菌落在新培养基上进行划线接种。如此操作,分离和传代,革兰氏染色后判定细菌纯度。将分离的细菌与EMB琼脂培养基、绵羊血琼脂培养基、SS琼脂培养基、麦康凯琼脂培养基和胰酶解酪蛋白大豆肉汤(TSB)一起培养,观察其生长特征。
1.4 染色和形态观察
用革兰氏染色法和美兰染色法[5]对分离的细菌进行染色,用光学显微镜(BA310Digital,Motic)观察分离细菌形态,并拍照。
1.5 生理生化特性
按照生化发酵管和HBI生化鉴定条的说明书进行细菌生理生化试验。细菌在TSB培养基中于37℃培养18~24 h,再在TSB培养基中于37℃培养3 h。将新鲜培养的细菌接种入生化发酵管和生化鉴定条中,置于37℃培养24~48 h,观察实验结果。
1.6 16S rRNA PCR扩增与测序
按照细菌基因组DNA提取试剂盒说明书提取分离菌株的DNA,作为PCR扩增的模板。采用通用引物扩增分离菌株的16S rRNA基因。引物的序列为:8f:5'-AGA GTT TGA TCC TGG CTC AG-3' 和 1492r:5'-GGT TAC CTT GTT ACG ACT T-3’,预期片段大小为1 492bp。引物由生工生物工程(上海)股份有限公司合成。扩增体系 (50 μL):Rnase-free H2O 21 μL,2×Taq PCR Master Mix 25 μL,上下游引物各 1 μL,DNA模板2 μL。PCR反应参数:95℃预变性2 min,95℃变性20 s,55℃退火30 s,72℃延伸90 s,35个循环,最后72℃延伸5 min。PCR扩增产物用1%琼脂糖凝胶电泳进行检测,并使用DNA纯化回收试剂盒对PCR产物进行回收并连接pMD19-T载体,转化入大肠杆菌DH5a中,将重组菌液送上海生工有限公司测序。
1.7 系统进化树的构建
将测序所得基因序列与GenBank公布的各株大肠杆菌16S rRNA基因序列进行BLAST比对,利用DNAStar软件中Jotun Hein方法构建系统进化树。
1.8 药敏试验
按照药敏纸片说明书进行分离细菌的药敏试验。取100 μL对数期的分离细菌(1×108CFU/mL)用“L”型推棒均匀涂布于营养琼脂上,用无菌镊子贴药敏纸片于琼脂表面,37℃培养24 h,参照CLSI(2014)标准进行结果判定[9]。
2 结果与分析
2.1 细菌的分离结果
经多次分离、传代,成功从5份猪粪样本中分离、纯化得到1株细菌。分离细菌,经美兰染色后,菌体呈蓝色、杆状(如图1B),经革兰氏染色后,菌体呈红色、杆状(如图1A)。这表明,成功从样本中分离到1株革兰氏阴性杆菌。
2.2 细菌的培养特性
将分离的细菌在不同培养基上进行培养,结果如图2所示。在普通营养琼脂培养基上,分离细菌长成圆形、白色的菌落(如图2A);在伊红美兰琼脂上,分离细菌长成圆形、黑色、带金属光泽的菌落(如图2B);在绵羊血琼脂上,分离细菌长成圆形、白色的菌落,没有溶血现象(如图2C);在SS琼脂上,分离细菌长成圆形、红色的菌落(如图2D);在麦康凯培养基上,分离细菌长成圆形、红色的菌落(如图2E);在TSA液体培养基中,经18 h左右的培养,整个菌液呈均匀浑浊状(如图2F)。分离细菌的培养结果与大肠杆菌的基本特性相符合。
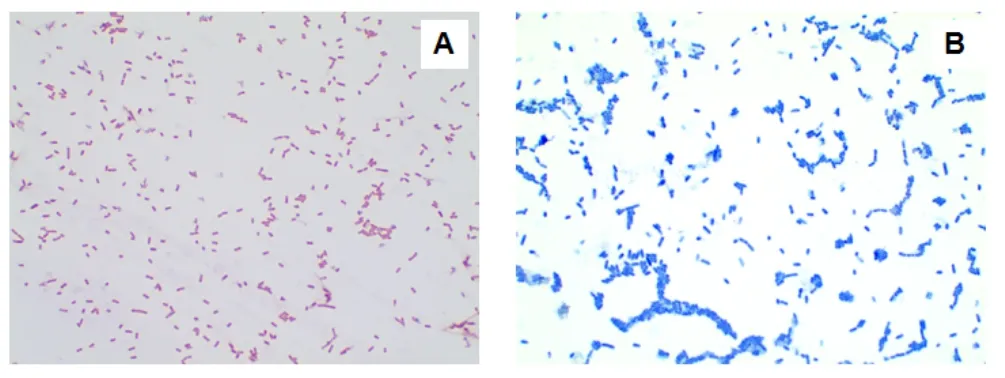
图1 细菌的染色与形态观察 (×1 000)
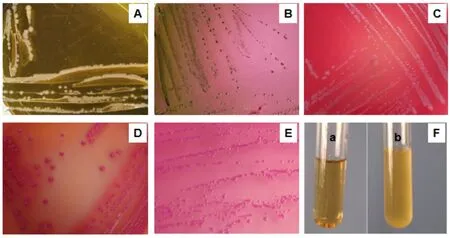
图2 分离菌株在不同培养基上的生长特性
2.3 细菌的生理生化结果
将分离细菌进行生化试验,结果如表1所示。分离细菌能发酵甘露醇、麦芽糖、蕈糖、乳糖、葡萄糖产酸产气,半固体穿刺、鸟氨酸脱羧酶、赖氨酸脱羧酶、吲哚、MR、山梨醇、蜜二糖、棉子糖、七叶苷、乳糖的试验结果呈阳性,西蒙氏枸橼酸盐、硫化氢、尿素酶、VP、苯丙氨酸、肌醇、核糖醇、水杨素、尿素的试验结果呈阴性。参照文献[10],符合大肠杆菌的生化特性。
2.4 PCR扩增及测序
通过PCR扩增分离细菌的16S rRNA基因序列,结果符合预期1 506 bp的扩增片段长度(如图3)。
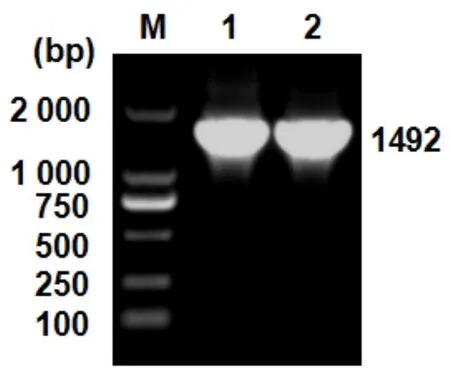
图3 分离细菌的PCR扩增结果
2.5 16S rRNA的同源性分析与系统发育树构建
将测定的分离细菌的16S rRNA基因序列输入GenBank中进行BLAST比对分析,结果与大肠杆菌猪肉源 (CP025318株)、犬源 (CP023359株、CP010134株)、人源(CP022407株、CP018948株、CP023349株)的同源性均高达99.8%。根据不同属细菌16S rRNA基因同源性为70%~90%,而同一种内不同株间基因同源性>99%[11],结合上述分离细菌的染色特征、培养特征和生理生化特征,可以认为分离细菌为大肠杆菌,暂命名为ZB17090404326。
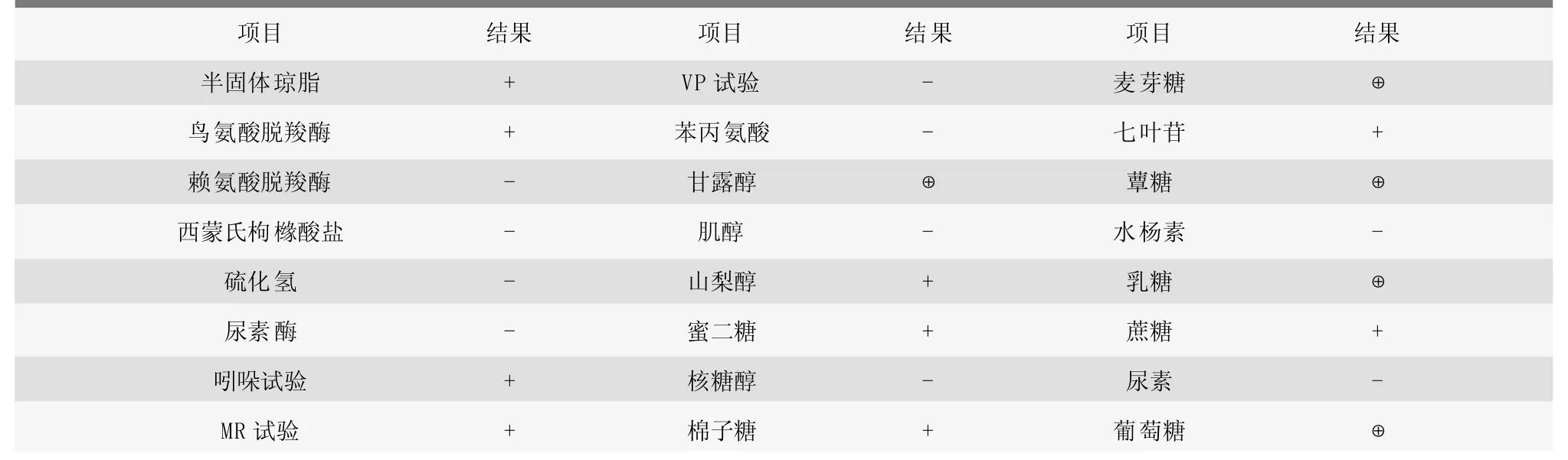
表1 分离菌株的生化试验结果
通过邻近法构建分离菌株ZB17090404326的16S rRNA基因系统发育进化树,结果如图5所示。从图5中可以看出,分离菌株ZB17090404326与猪大肠杆菌CP025753株的亲缘关系最近,所有参与构建进化树的大肠杆菌菌株形成2个主要分支,分离菌株ZB17090404326单独形成1个分支。这表明,分离菌株ZB17090404326是一个独特的大肠杆菌分离株。
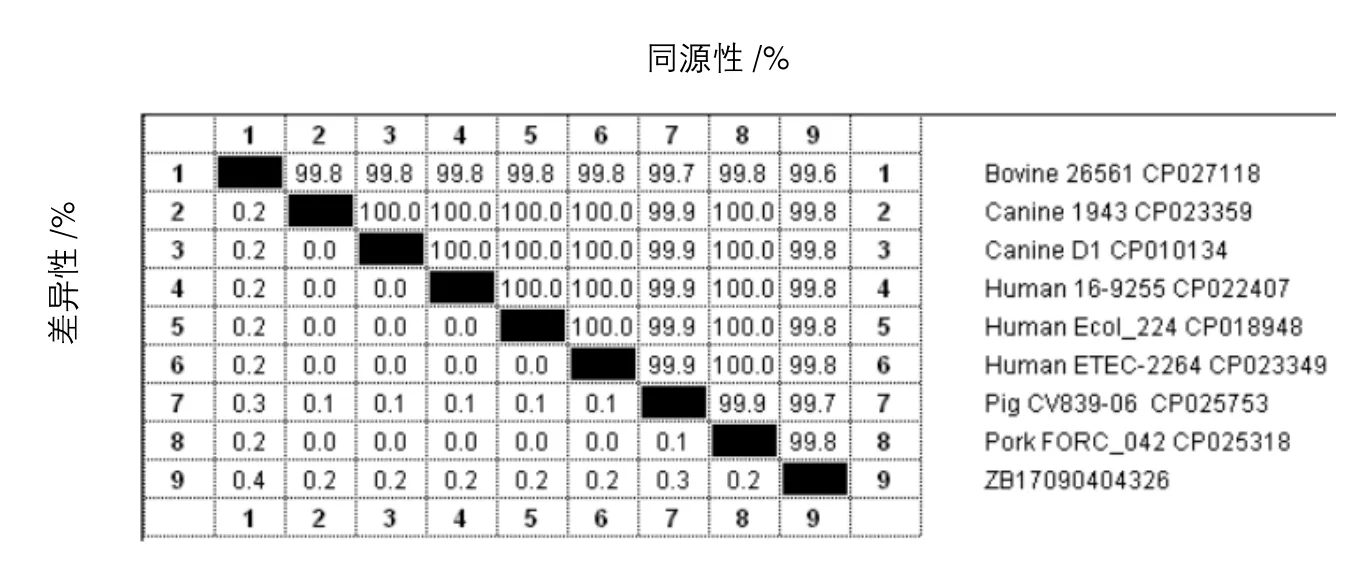
图4 分离菌株的16S rRNA基因序列同源性比较结果
2.6 药敏试验结果
将分离菌株ZB17090404326进行药物敏感性测定,结果如表2所示。从表2中可以看出,在测定的26种药物中,分离细菌对21种药物耐药,对4种药物敏感。这表明分离菌株ZB17090404326为高耐药性细菌。
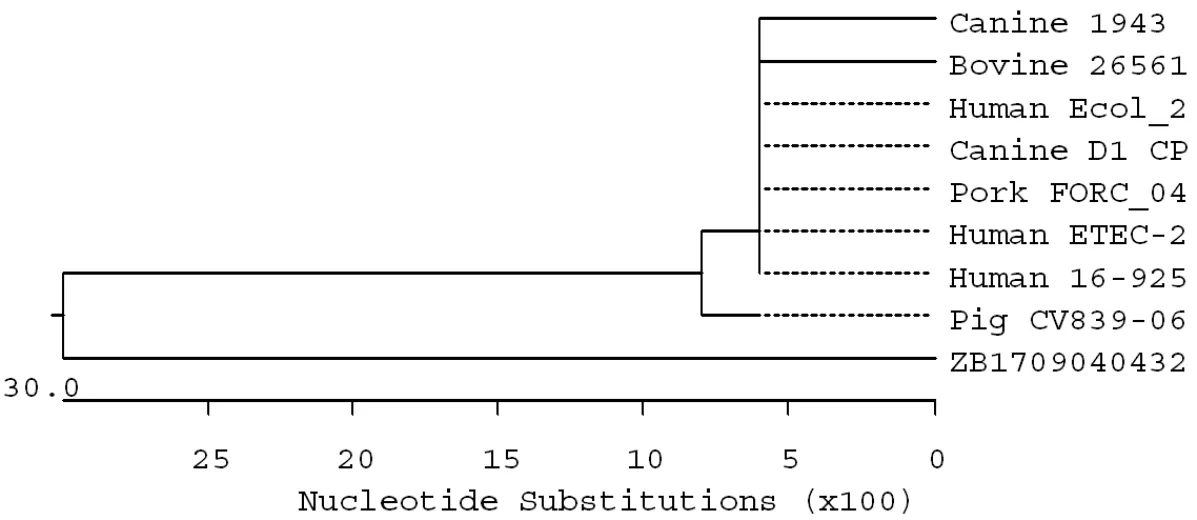
图5 分离菌株的16S rRNA基因的系统进化树
3 讨论
细菌的分离是从细菌的混合物中获得某种细菌的纯化物。只有获得纯化细菌,方可进行细菌的系统性鉴定[12]。而细菌的鉴定是一项系统工作,常需要检测许多项目,如形态观察、染色特性、培养特性、生化与生态特性、血清型鉴定、细菌毒力测定、核酸检测等。一般讲,细菌鉴定至少需要同时验证3种指标[12]。形态与染色特性、培养特性和生化特性等的观察是细菌鉴定过程中最常用的方法。但现在细菌鉴定过程中,还常借助细菌16S核糖体RNA(ribosome RNA,rRNA)的测定。因为细菌16S rRNA是细菌进化过程中最为保守的基因,是细菌鉴定时常用的PCR扩增序列[13-14]。细菌16S rRNA基因可变区因细菌不同而异,是细菌分类的分子基础,而其保守区的序列在不同细菌间基本相同,可反映细菌间的亲缘关系[15]。因此,通过细菌16S rRNA基因序列的分析,可对分离的细菌进行鉴定,同时了解其演化特征。本研究通过细菌形态与染色特性、培养特性和生化特性的观察,并结合16S rRNA序列的比对分析,鉴定从腹泻猪十二指肠中分离的细菌为大肠杆菌。
细菌的耐药性有单耐药和多重耐药。多重耐药性细菌对疾病的预防和治疗提出了挑战与考验。目前,大肠杆菌的耐药性以多重耐药为多见。贺丹丹等[16]对2011—2012年从患病和健康食品动物中分离鉴定到的935株大肠杆菌的耐药性进行调查,发现大肠杆菌对15种抗菌药物中的大部分药物的耐药率超过70%,以耐6~10种抗菌药物的菌株数量最多,并有1株大肠杆菌能耐15种抗菌药物。而在本研究中,分离的大肠杆菌能耐21种抗菌药物。细菌的耐药性主要有固有耐药和获得性耐药[17]。获得性耐药是细菌形成耐药性的主要原因[18]。而大肠杆菌耐药性的产生也与长期使用抗生素有关[19]。细菌在抗生素选择压力下,为了生存而与抗生素对抗,通过改变新陈代谢或获得耐药性元件,从而形成获得性耐药。Collignon等[20]认为减少抗生素的使用不足以控制耐药性,而耐药菌株和耐药基因的传播是耐药性严重的主要因子。耐药基因的获得是细菌获得新耐药特性的重要因素。随着时间推移,大肠杆菌的耐药率越来越高,耐药谱越来越宽,多重耐药菌株越来越多[21]。大肠杆菌的耐药性情况已经越来越严峻,对人类与动物的健康造成了巨大威胁[6]。因此,加强大肠杆菌的耐药性监测具有重要的公共卫生意义。
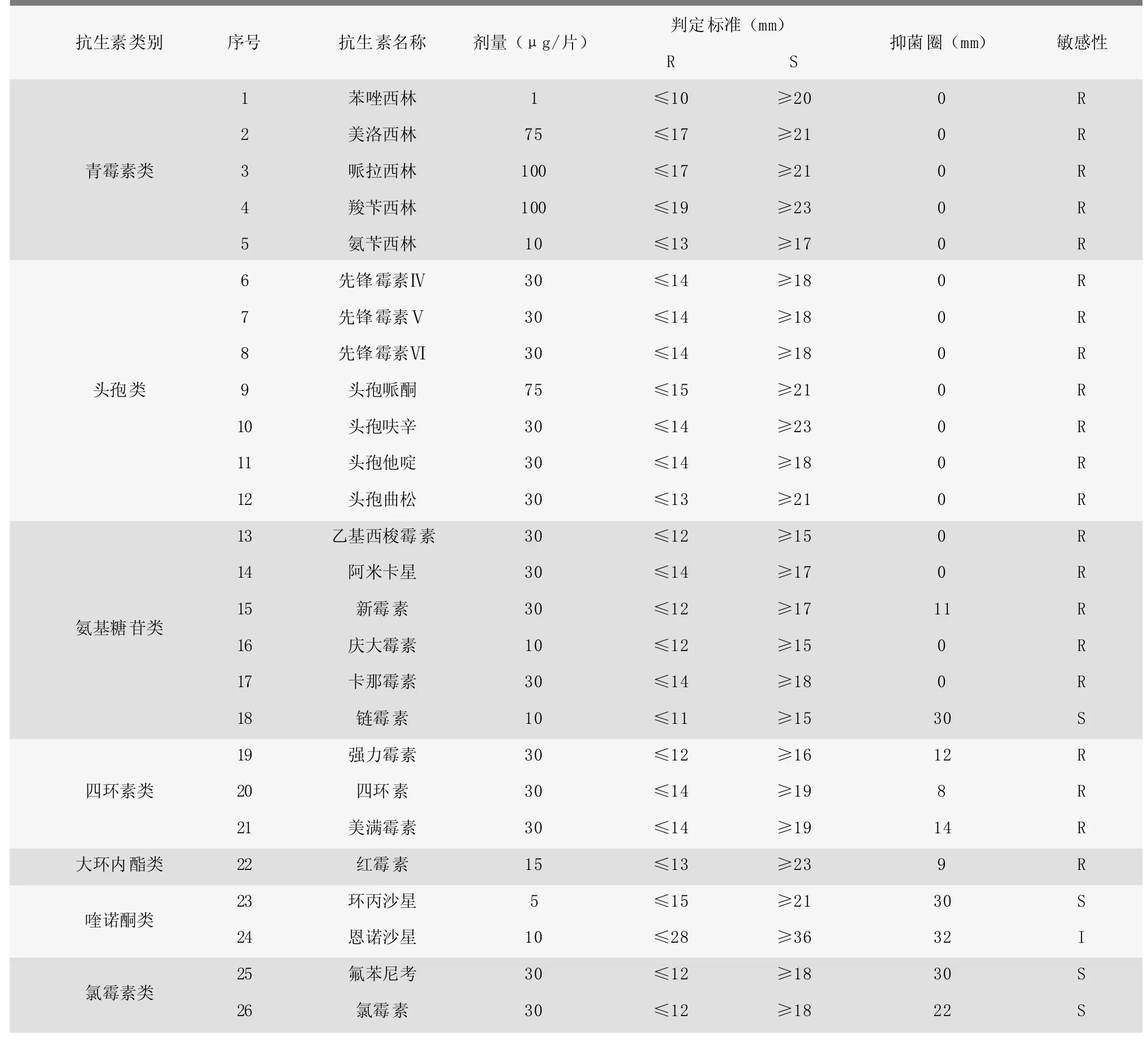
表2 细菌的药敏试验结果

