氨基功能化KIT-6两步后嫁接制备及其吸附Pb2+性能
耿琳琳 林志峰 梅德均 陈斯琪 魏建文 廖 雷
(桂林理工大学广西矿冶与环境科学实验中心,桂林 541004)
随着电镀、冶金、印染和电子行业的快速发展,重金属污染对环境造成的破坏也越来越严重。重金属具有毒性大,隐蔽性强,易迁移,持久性等特点,且可以在生物体内累积[1]。人接触重金属铅的途径有许多种,其中以燃烧石油产品造成的尾气铅污染最为广泛。水体低浓度铅不仅可以致死鱼类等水生生物,还可以影响水体的自净能力,长期低浓度铅暴露也会使人产生高血压、心悸气短、头痛、贫血等症状[2]。吸附法因其具有成本低廉、操作简单、去除效果明显等较多优点而成为处理重金属废水的最常用方法。在众多吸附剂中,介孔SiO2材料具有比表面积大、孔隙发达和易功能化等优点。将具有特殊功能的有机官能团负载至介孔材料上,进行有机功能化,可以获得具有介孔有序结构和良好的选择吸附性的吸附剂。因此,已有不少有机官能团修饰介孔材料并用于吸附水中铅离子、铜离子以及汞离子的研究[3-8]。Awual等[9]报道了一种利用有机配体DPDB嫁接介孔氧化硅制备而成的功能化介孔氧化硅吸附剂,该吸附剂能快速、高选择性地与铅离子结合形成[Pb-DPDB]n+配合物,从而实现水体中铅的去除。Gao等[10-12]通过使用3-氯丙基三甲氧基硅烷作为偶联剂将聚乙烯亚胺(PEI)固体负载到普通SiO2上,制得SiO2/PEI复合材料用于吸附铅离子。
与一步后嫁接法相比,两步后嫁接法克服了氨基硅烷种类的限制,使富含氨基的有机胺通过化学键固定到载体表面上,可以提高有机胺负载量,从而提高水中重金属离子的吸附量。目前氨基改性介孔材料KIT-6在水中重金属吸附方面的研究还鲜有报道[13]。本文以正硅酸乙酯作为硅源,三嵌段共聚物P123作为模板剂制备介孔分子筛KIT-6;再采用两步后嫁接法,即先以3-氯丙基三甲氧基硅烷偶联剂将KIT-6硅烷化,再用PEI取代氯原子的方式进行氨基嫁接,制得具备强螯合功能的新型材料PEI/KIT-6。然后进行结构表征,并考虑不同实验因素对材料吸附Pb2+的影响,研究吸附动力学和吸附等温线,为工业应用提供科学依据。
1 实验部分
1.1 试 剂
盐酸、氢氧化钠、无水乙醇、甲苯、正硅酸乙酯(TEOS)、正丁醇、聚(乙二醇)-聚(丙二醇)-聚(乙二醇)三嵌段共聚物(P123)、硝酸铅,纯度均为分析纯。3-氯丙基三甲氧基硅烷(质量分数为98%)和聚乙烯亚胺(Mr=600,质量分数为 99%)。
1.2 实验仪器与材料表征
采用 X′Pert PRO型 X射线衍射仪 (荷兰PANalytical公司)测定样品的晶体结构,辐射源Cu Kα,波长0.154 060 nm,管电流和电压分别为40 mA、40 kV,扫描范围 2θ=0.5°~8°,扫描速度 2°·min-1。采用美国Nicolet公司的Thermo Nexus 470型傅里叶变换红外光谱仪进行分析样品官能团的种类,扫描波数范围400~4 000 cm-1。采用日本Business for Enjoying Life公司的BELSORP-miniⅡ型比表面测定仪在-196℃温度下进行氮气吸附-脱附实验测定样品的孔结构,测试前样品在液氮氛和100℃下脱气3 h。采用日本Hitachi公司生产的S-4800型扫描电镜在3.0 kV加速电压、10μA工作电流和12.1 mm工作距离下将样品放大一定倍数,分析样品表面特征和孔隙结构。采用北京恒久实验设备有限公司的HCT-1型微机差热天平以10℃·min-1的速率在氮气保护下升温到850℃进行热重分析。采用美国Perkin-Elmer公司的EA2400Ⅱ型元素分析仪分析样品C、H和N元素。ICP测定采用ICAP-7400型电感耦合等离子发射光谱仪 (美国Thermo Fisher Scientific 公司)。
1.3 KIT-6的合成和改性
将4 g P123加入144 mL水中,再加入6.7 mL盐酸(浓度为36%),在35℃下混合搅拌2 h直至溶液变澄清。再加入4.94 mL正丁醇搅拌1 h后将温度升至40℃,在450 r·min-1转速下快速搅拌同时缓慢匀速滴入9.24 mL TEOS,继续搅拌24 h再将混合液全部转移至反应釜中。使用100℃烘箱晶化24 h,将反应釜取出冷却至室温,再将混合液真空抽滤,将白色粉末在100℃下干燥,记为KIT-6。
将1 g KIT-6倒入装有50 mL甲苯的250 mL圆底烧瓶中,在室温下混合搅拌10 min,再倒入1 g 3-氯丙基三甲氧基硅烷混合搅拌5 min,加入沸石,在90℃下加热回流10 h。将悬浮液冷却至室温后进行真空过滤,用无水乙醇反复冲洗白色粉末数次,在100℃下烘干12 h,得到氯丙基化的KIT-6材料。
将1 g PEI加入有25 mL无水乙醇的锥形瓶中,在室温下搅拌10 min,再加入1 g氯丙基化的KIT-6材料搅拌5 min,在90℃水浴条件下用磁力搅拌6 h。待悬浮液冷却至室温后进行抽滤,再用超纯水反复清洗得到的粉末数次后,在80℃条件下干燥,得到最终产物,记为PEI/KIT-6。
1.4 铅离子的吸附试验
每次取一定浓度含有铅离子的模拟废液20 mL,PEI改性后的KIT-6投加量为0.02 g,吸附一定时间后以4 000 r·min-1的转速离心3 min,使用ICP对溶液中含有的Pb2+浓度进行检测,吸附容量Q及吸附率 R 分别用公式(1)和(2)计算。

其中,V是吸附实验中废水的体积(L);m是吸附实验中吸附剂的量(g);C0是吸附前铅离子浓度(mg·L-1);Ce是吸附平衡后铅离子浓度(mg·L-1);Q 是计算得到的吸附剂的吸附容量(mg·g-1)。
2 结果与讨论
2.1 XRD分析
图1是改性前后KIT-6的XRD图。由图1可以看出样品 a 在 1°附近的(211)和(220)晶面都出现明显的衍射峰,以及一组非常弱的峰,说明该样品拥有Ia3d立方相介孔材料的特征,与Ryoo课题组[14]报道的KIT-6类似。样品b是用PEI改性后的KIT-6,在(211)和(220)晶面的衍射峰都有所减弱,并且向右发生了位移,这可能是PEI分子嫁接在KIT-6表面,并且占据了部分孔道所致。但嫁接PEI后样品仍有明显的特征峰(峰强仅有轻微的减弱),表明本实验中PEI的嫁接对材料结构的有序性影响不大。
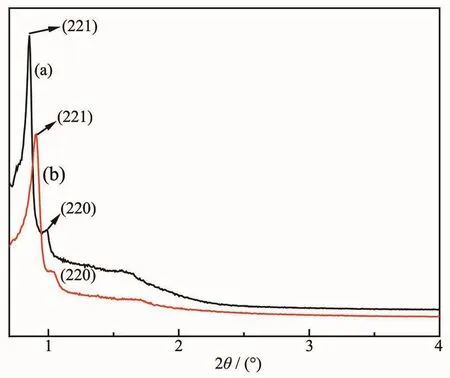
图1 KIT-6 (a)和 PEI/KIT-6 (b)的 XRD 图Fig.1 XRD patterns of KIT-6 (a)and PEI/KIT-6 (b)
2.2 热重分析
图2 是改性前后KIT-6的热重曲线图。由图2可知,KIT-6材料在200℃以下有一段失重,归因于KIT-6材料表面和孔道中所含水的去除。从200到700℃范围内发生的失重是因为模板剂的去除所造成的。由图可见,PEI/KIT-6在200℃之下发生的失重也是由脱除吸附材料附着的水引起的,从200到700℃范围内的失重可能是PEI/KIT-6表面含有的功能化基团及模板剂发生了热解。
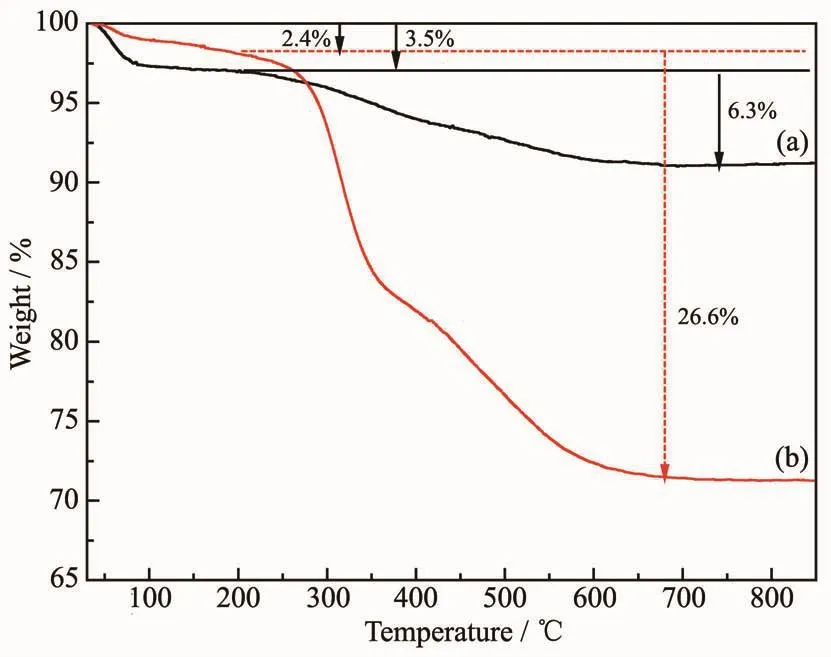
图2 KIT-6 (a)和 PEI/KIT-6 (b)的 TG 曲线图Fig.2 TG curves of KIT-6 (a)and PEI/KIT-6 (b)
2.3 元素分析
表1是3种材料的元素分析结果。通过测定硅烷偶联剂嫁接后的KIT-6与PEI嫁接后的KIT-6中的N含量,可以分析出改性后KIT-6中的氨基含量。从表1中能够看出嫁接了3-氯丙基三甲氧基硅烷后,样品中所含的C有所提高,但是N含量并未出现显著变化,这是由于硅烷偶联剂中并不含有氨基。负载PEI后,样品中C含量进一步升高,而N含量明显增加,表明PEI成功负载到KIT-6上。由元素含量计算得出,氨基在材料表面的平均负载量是0.374 mmol·g-1。该数据稍低于热重测试,也许是由于KIT-6材料吸收了环境中的水份,使得实际测量值偏大,从而使求得的氨基负载量也相应偏低。
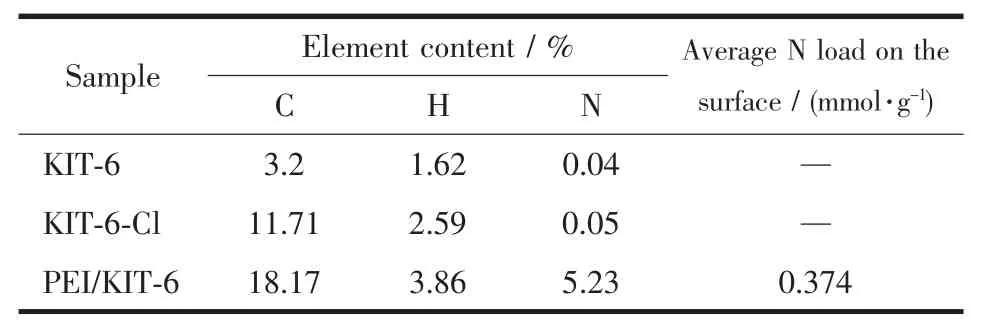
表1 样品的元素分析Table 1 Elemental analysis of the samples
2.4 比表面积与孔径分析
图3是改性前后KIT-6的孔径和N2吸附-脱附曲线。由图3可知,改性前后KIT-6的物理吸附曲线均表现为Ⅳ型等温线,保持介孔材料的结构特征[14]。PEI改性材料的孔径分布相对改性前变窄,说明改性后材料的孔径均一分布,仍保持材料的有序性,这与XRD表征结果一致。由于PEI嫁接到载体KIT-6表面,造成了比表面积、孔容和孔径发生不同程度的变化,这些物理特性变化如表2所示。KIT-6和PEI/KIT-6的最可几孔径分别为8.06和7.06 nm,表明PEI的嫁接未引起孔道堵塞。
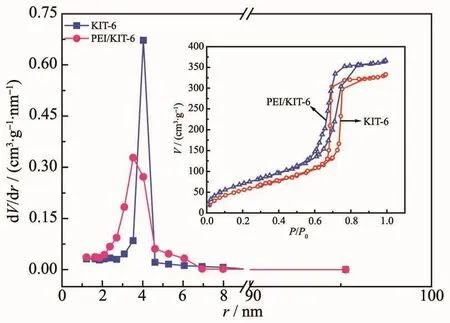
图3 KIT-6改性前后的N2吸附-脱附等温线和孔径分布Fig.3 N2 adsorption-desorption isotherm and pore size distribution of KIT-6 before and after modification

表2 样品的孔结构参数Table 2 Pore structure parameters of the samples
2.5 FT-IR分析
图4是3种材料的FT-IR分析结果。从图4可以看出,在3 300~3 500 cm-1波数内出现了一个宽度较大的吸收带,是由材料表面的Si-OH伸缩振动所引起的[15],说明3种材料都拥有羟基。在2 930 cm-1附近出现甲基的对称及反对称伸缩振动峰[16]。而在1 639 cm-1处的峰是由样品中物理吸附水的羟基形成的弯曲振动所造成[17]。合成的样品材料均有3个明显的特征峰:在1 079 cm-1位置所形成的峰强度较大,这是由Si-O-Si键的反对称振动形成的;在798 cm-1附近的峰则是Si-O-Si键的对称振动引起的;而463 cm-1附近的吸收峰则是由Si-O-Si的弯曲振动所引起的[18-20]。这些特征峰佐证了KIT-6骨架的存在,也说明经PEI改性后的材料并未破坏KIT-6原本的骨架结构。此外,1 467 cm-1为-CH2弯曲振动峰[21]。与KIT-6相比,KIT-6-Cl在990 cm-1附近的吸收峰强度减弱,而PEI/KIT-6在该位置的吸收峰消失,归因于KIT-6表面的Si-OH基分别与3-氯丙基三甲氧基硅烷和PEI发生了化学反应,导致材料表面的硅羟基减少。
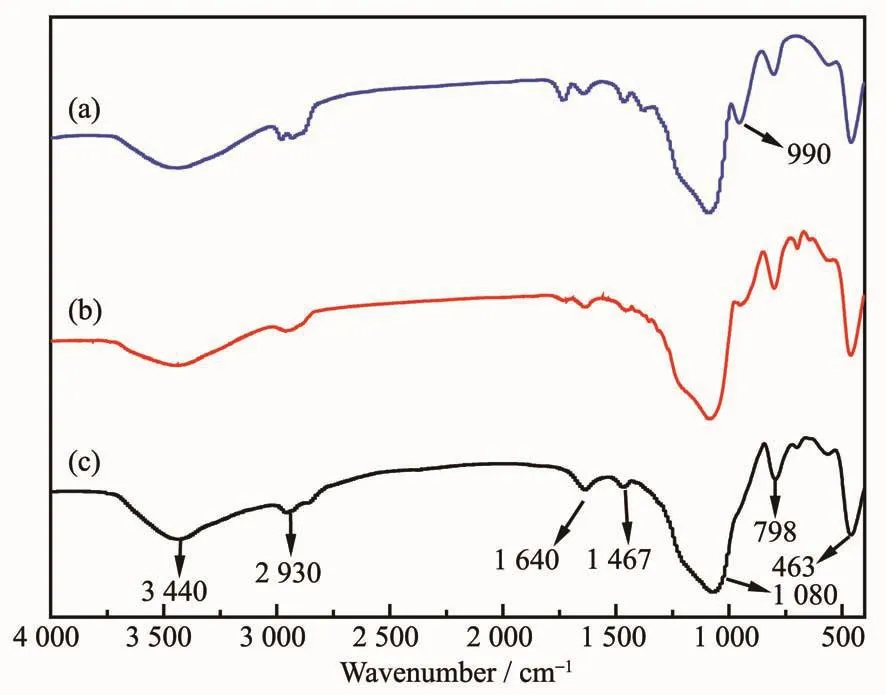
图4 KIT-6 (a),KIT-6-Cl(b)和 PEI/KIT-6 (c)的红外光谱Fig.4 Infrared spectra of KIT-6 (a),KIT-6-Cl(b)and PEI/KIT-6 (c)
2.6 改性前后KIT-6的微观形貌
图5 是KIT-6和PEI/KIT-6不同放大倍率的SEM 图,图 5(a)和图 5(b)分别是 KIT-6 放大 300 和1000倍后的SEM图,由这2张图可以看到合成的KIT-6材料呈现坚硬如岩石的无定形形貌,这与Prabhu 等[22]的报道一致。 图 5(c)和图 5(d)分别为 PEI改性后的KIT-6放大300和1 000倍的SEM图,由这2张图可以看出通过PEI改性后的KIT-6的表面形貌没有发生明显变化。KIT-6和PEI/KIT-6的平均粒径分别是47和52μm,说明PEI的嫁接轻微地扩大了材料的粒径。
2.7 不同因素对PEI/KIT-6吸附Pb2+性能的影响
图6 是不同 pH 值条件下(2.0~6.0),PEI/KIT-6的Pb2+吸附容量的变化曲线。由图6可见温度相同时(25℃),PEI/KIT-6对铅离子的吸附容量随pH值的上升显著提高,说明pH很大程度影响PEI/KIT-6对铅离子吸附性能。当pH<4.0时,PEI/KIT-6对Pb2+的吸附能力较弱;当pH≥4.0时,PEI/KIT-6对铅离子有较强的吸附能力;当pH=6.0时,PEI/KIT-6对Pb2+的吸附容量最高。当pH值较小时,水溶液中存在较多H+,H+使PEI/KIT-6表面负载的功能团质子化,导致铅离子不能被完全吸附,因此吸附容量比较小。而伴随pH值的上升,原来与PEI/KIT-6材料上有机基团结合的氢离子重新脱离,导致铅离子又可以被充分地吸附,所以PEI/KIT-6对Pb2+的吸附容量会伴随pH值的升高而不断升高。
图7是体系温度(20~45 ℃)与 Pb2+吸附容量的关系图。从图7可以看出,随着体系温度上升,PEI/KIT-6对Pb2+的吸附容量会慢慢增大,体系温度达到35℃时,吸附容量出现最大值。这可能是由于随着反应体系温度的升高,等压热效应更为明显,使得Pb2+与吸附剂PEI/KIT-6的碰撞概率增大,吸附过程由动力学控制,平衡向吸附方向移动,导致吸附量增加。这也说明该吸附过程是吸热反应。超过35℃后,虽然温度继续上升,但吸附量却减小,因为Pb2+过于活跃,吸附过程转由热力学控制,平衡转向解吸方向,使得固定在吸附剂PEI/KIT-6孔道内的Pb2+重新扩散到水中,导致吸附量减小。但考虑到工程应用,我们选择室温(25℃)为最佳温度。

图5 KIT-6 (a,b)和 PEI/KIT-6 (c,d)的 SEM 照片Fig.5 SEM images of KIT-6 (a,b)and PEI/KIT-6 (c,d)
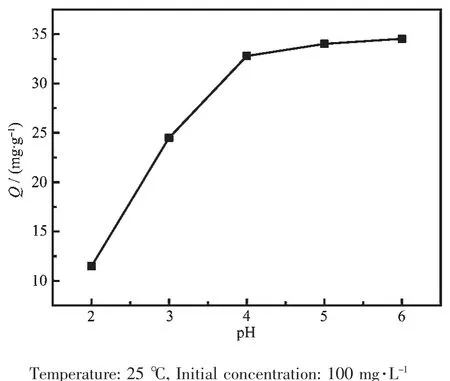
图6 PEI/KIT-6在不同pH值下对Pb2+的吸附量Fig.6 Adsorption of Pb2+by PEI/KIT-6 at different pH values

图7 PEI/KIT-6在不同温度下对Pb2+的吸附量Fig.7 Adsorption of Pb2+by PEI/KIT-6 at different temperatures
图8 是铅离子吸附量随时间(10~240 min)变化图。由图8可见,随时间增加,PEI/KIT-6对Pb2+的吸附量逐步提高。PEI/KIT-6对Pb2+的吸附可大致分成2个阶段:反应前10 min是第一阶段,这一过程主要是表面吸附,反应过程迅速,吸附量提升较大;第二阶段则以渐进吸附为主,反应开始减缓,120 min后吸附反应逐步达到平衡状态。这是由于吸附反应初期PEI/KIT-6上含有大量吸附位点,浓度差形成了较大的传质推动力,Pb2+更易被PEI/KIT-6吸附,随着时间增加,PEI/KIT-6表面堆积大量Pb2+,吸附位点减少,影响了铅离子的运动,导致吸附成非线性。
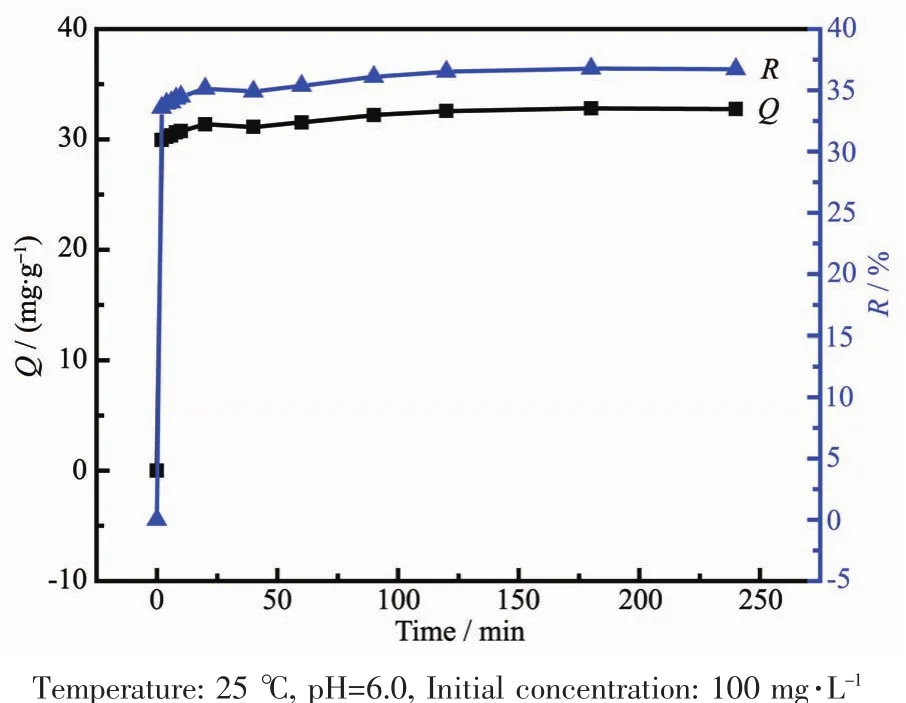
图8 PEI/KIT-6对Pb2+吸附量随时间的变化Fig.8 Effect of time on adsorption of Pb2+by PEI/KIT-6
在相似条件下(25 ℃和 100 mg·L-1),氨基修饰材料对Pb2+吸附性能也有了不少的研究。Shao等[23]用3-氨丙基三乙氧基硅烷嫁接介孔SBA-15,发现在 pH=5.0、投加量为 0.67 g·L-1的条件下,其 Pb2+吸附量接近 25 mg·g-1;Yin 等[24]用 N-氨乙基-γ-氨丙基三甲氧基硅烷修饰正硅酸乙酯包裹的四氧化三铁粒子,发现在pH=6.0、投加量为2 g·L-1的条件下,其 Pb2+吸附量接近 45 mg·g-1;Zhai等[25]用溶胶-凝胶法将氨丙基三甲氧基硅烷、正硅酸乙酯和线型聚甲基含氢硅氧烷混合制备成氨基修饰的介孔硅凝胶材料,发现在投加量为2 g·L-1的条件下,其Pb2+吸附量为42.5 mg·g-1。由以上文献对比可以看出,在相似或相同条件下,本文以两步后嫁接制备的氨基功能化KIT-6材料的吸附性能与以上材料相近。
2.8 吸附动力学研究
通过拟一级和拟二级动力学方程对图8的原始数据进行拟合。
拟一级动力学模型表达式为:

其中,qt和qe分别为t时刻和吸附饱和时PEI/KIT-6对 Pb2+的吸附量(mg·g-1),k1和 k2分别为拟一级和拟二级速率常数,单位分别为 min-1和 g·mg-1·min-1。
图9和图10分别是PEI/KIT-6的拟一级和拟二级动力学拟合曲线。
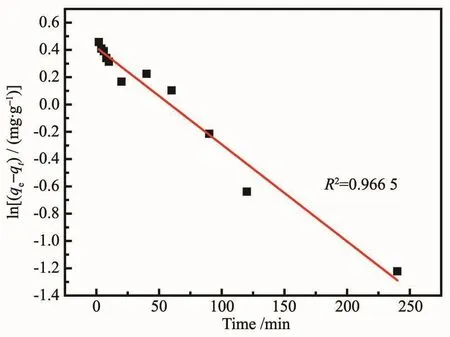
图9 PEI/KIT-6吸附Pb2+的拟一级动力学方程曲线Fig.9 Pseudo-first-order kinetic equation curve for adsorption of Pb2+by PEI/KIT-6

图10 PEI/KIT-6吸附Pb2+的拟二级动力学方程曲线Fig.10 Pseudo-second-order kinetic equation curve for adsorption of Pb2+by PEI/KIT-6
表3是2种模型分析拟合得到的动力学数据和相关系数。由图9、图10和表3可以看出,用拟一级模型分析得到的线性关系并不是很好,拟一级模型不足以阐明Pb2+在PEI/KIT-6上的吸附过程。而用拟二级模型分析得到的理论计算值(qecal)相当接近实际测试值(qeexp),而且相关系数大于 0.99,这表明PEI/KIT-6对铅离子的吸附反应与拟二级模型所对应的反应机理较吻合,是化学吸附过程控制了吸附反应的快慢。Pb2+首先通过液膜到达PEI/KIT-6的表面,然后扩散到PEI/KIT-6的内孔道,直到吸附平衡。该过程中Pb2+与氨基发生化学反应,被氨基上的氮原子所固定[26]。温度升高使吸附容量增加也表明铅离子与氨基的结合是一种化学过程。

表3 PEI/KIT-6吸附Pb2+的动力学参数Table 3 Kinetic parameters for adsorption of Pb2+on PEI/KIT-6
2.9 吸附等温线研究
图11是PEI/KIT-6对Pb2+的吸附等温线。通过Langmuir和Freundlich等温线方程对图11的原始数据进行拟合。

图11 PEI/KIT-6对Pb2+的吸附等温线Fig.11 Adsorption isotherms of Pb2+on PEI/KIT-6
Langmuir等温线模型表达式为:

Freundlich等温线模型表达式为:

其中,Qmax和b分别为最大吸附量和Langmuir吸附常数, 单位分别为 mg·g-1和 L·mg-1,Kf和 n 分别为Freundlich平衡吸附常数和特征常数,Kf单位为mg1-1/n·L1/n·g-1。图 12 和图 13 分别是 PEI/KIT-6 的Langmuir和Freundlich等温线拟合曲线。
表4是Langmuir及Freundlich型线性分析拟合数据。由图12、图13和表4可以看出,通过2类等温吸附方程分析得到的线性系数都超过0.98,这说明该2种吸附模型均可用来阐明PEI/KIT-6对铅离子的吸附过程,但是Langmuir模型的线性相关性更好,表明其吸附倾向于发生单分子层吸附。在25℃下,用Langmuir吸附模型分析所得的理论最大吸附量为52.63 mg·g-1。而且由Freundlich模型计算得到1<n<10,这说明改性后的材料PEI/KIT-6易于吸附Pb2+,与实际测试结果相似。

图12 PEI/KIT-6吸附Pb2+的Langmuir等温方程拟合Fig.12 Langmuir isotherm equation fitting for adsorption of Pb2+by PEI/KIT-6

图13 PEI/KIT-6的Freundlich等温方程拟合Fig.13 Freundlich isotherm equation fitting for adsorption of Pb2+by PEI/KIT-6

表4 PEI/KIT-6吸附Pb2+的等温线参数Table 4 Isotherm parameters for adsorption of Pb2+on PEI/KIT-6
3 结 论
以3-氯丙基三甲氧基硅烷和PEI为改性剂,采用两步后嫁接法,成功将PEI嫁接到KIT-6材料上,PEI的嫁接并未破坏材料结构的有序性。PEI的氨基负载量为0.374 mmol·g-1,负载后 PEI/KIT-6的比表面积、孔容和孔径分别为 246 m2·g-1、0.60 cm3·g-1、7.06 nm,PEI的嫁接并未引起孔道堵塞。将PEI/KIT-6用于吸附Pb2+,其吸附投加量为1 g·L-1,Pb2+起始浓度为100 mg·L-1,室温条件下吸附最佳pH值为6.0;平衡吸附时间为120 min,吸附过程符合拟二级动力学模型;吸附容量随温度的提高先增加后减小,最佳温度为35℃;Langmuir和Freundlich模型均能较好地描述PEI/KIT-6对Pb2+的吸附过程,其中基于Langmuir吸附模型分析所得的理论最大吸附量为52.63 mg·g-1;吸附倾向于发生单分子层的化学吸附。本方法制备过程相对简单,具有一定的应用前景。

