红鳍东方鲀鳍细胞系的建立及生长特性研究
,、,,,,,
(1.大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连 116023;2.大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
1962年,Wolf等[1]第一次成功建立了虹鳟Oncorhynchusmykiss生殖腺细胞系RTG-2后,越来越多的鱼类细胞系被建立。其中利用鳍组织建立的细胞系约为36种,如西伯利亚鲟AcipenserbaeriBrandt[2]、泥鳅Misgurnusanguilicaudatus[3]、稀有鮈鲫Gobiocyprisrarus[4]、斜带石斑鱼Epinepheluscoioides[5]等。细胞系作为一个研究平台在免疫学、病毒学、环境毒理学等方面有着成本低、试验条件可精确控制、试验效果直观等多种优点[6]。
红鳍东方鲀Takifugurubripes隶属于鲀形目tetraodontiformers、鲀亚科Tetraodontoidei、鲀科Tetxaodontidae、东方鲀属Takifugu,是重要的经济鱼类之一[7]。近年来,随着养殖规模的扩大,疾病时有发生,尤其是病毒病,已经给所属产业带来巨大的经济损失。迄今报道的鱼类病毒已经超过70余种,分别属于18个不同的科[8]。与红鳍东方鲀相关的病毒有淋巴囊肿病毒(Lymphocystis disease virus, LCDV)、传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus)、神经坏死病毒(Nervous necrosis virus,NNV)、双链DNA棒状病毒(ds DNA baculovirus)、野田病毒(Nodamura virus)、败血症病毒(Viral hemorrhagic septice-mia virus)和白口病病毒(即红鳍东方鲀吻唇溃烂病毒,Takifugu rubripes snout ulcer virus,TSUV)等。病毒病的研究必须依赖于对该病毒具有易感性的细胞。目前,已建立的红鳍东方鲀细胞系只有精巢细胞系,尚未见到其他组织细胞系建立的报道。细胞系的匮乏,极大地限制了红鳍东方鲀病毒病的诊断与治疗,为此,急需其他组织细胞系的建立来填补这一空白。本试验中,建立了红鳍东方鲀鳍细胞系,旨在为研究该鱼病毒的感染机理、感染途径、病毒的体外培养和疫苗的研发制备提供基础条件。
1 材料与方法
1.1 材料
试验用红鳍东方鲀采自大连市天正养鱼场,3龄,体长为11 cm。红鳍东方鲀运回实验室后在水槽(90 L)中暂养。
试验试剂:0.25%胰蛋白酶溶液、1000 IU/mL和500 IU/mL的青霉素-链霉素双抗溶液均购于Hyclone公司;硫酸软骨素购于Wolsen公司;人碱性成纤维细胞生长因子(bFGF)和I 型胰岛素样生长因子(IGF-I)购于Peprotech公司;其他化学试剂均为分析纯。试验所用的PCR扩增引物购于生工生物工程(上海)股份有限公司,基因组DNA提取试剂盒购于大连赛拓生物公司。
1.2 方法
1.2.1 原代培养 参考李霞等[3]的原代启动试验方法。将红鳍东方鲀放入含0.2% 1000 IU/mL青链霉素混合液的新鲜海水中暂养3 h,然后用0.1%的苯甲醇和浓度为0.2%的1000 IU/mL青链霉素混合液进行麻醉处理,并用75%的乙醇擦拭尾鳍和臀鳍组织。剪取尾鳍和臀鳍鳍末端组织,放入500 IU/mL的青霉素-链霉素双抗溶液中消毒处理60 min, 中间换液1次。用pH值为7.2的磷酸盐缓冲液(PBS)漂洗两次,再用5%胎牛血清培养液漂洗1次,然后加入0.25%的透明质酸酶液和0.1%的Ⅱ型胶原蛋白酶溶液处理30 min;将鳍组织块剪成1 mm3左右的小块,均匀涂布到细胞培养瓶中,每瓶20~30个。倒置24 h之后,翻转并补加培养基至5 mL/瓶。所用培养液为添加bFGF(40 μL/mL)、硫酸软骨素(10 μg/mL)和 IGF-I(10 μL/mL)的20% FBS-DMEM/F-12 高糖培养基。5~6 d后组织块中有细胞迁出,当迁出细胞铺满单层培养瓶底时开始进行传代培养。
1.2.2 传代培养 加入PBS漂洗细胞1次;吸去PBS加入1 mL的胰蛋白酶溶液,约1 min之后,吸掉胰蛋白酶。加入原培养基,吹打。待细胞脱离培养瓶底部后吸出一半悬液至新培养瓶中,补加新培养基至5 mL/瓶,置于同样的25 ℃、5% CO2浓度细胞恒温培养箱中培养。所用培养液为20% 胎牛血清DMEM/F12 培养基,添加有硫酸软骨素(10 μg/mL)、bFGF(10 ng/mL)等生长因子。 30代以后所用培养液为添加20% 胎牛血清的DMEM/F12 培养基。
1.2.3 细胞冻存与复苏 参考李霞等[3]的方法。细胞冻存液为20% FBS、60% DMEM/F-12培养基和20%二甲基亚砜混合溶液,存于 4 ℃冰箱中。取 35代细胞,以1000 r/min 离心 5 min, 弃上清液, 向沉淀中加入 1 mL 细胞冻存液,轻轻吹打制成细胞悬液, 调整细胞浓度至 1.0×106cells/mL, 再转至冻存管中。先在4 ℃下存放30 min、-20 ℃下存放2 h,然后于-80 ℃下长期保存,或24 h后放入液氮(-196 ℃)中长期保存。
60 d后,将液氮中的细胞冻存管取出,迅速放入37 ℃水中,水浴解冻,当细胞冻存液融化约2/3后转入超净工作台。吸取全部细胞冻存液置于离心管中,加入等量的 20% FBS-DMEM/F12培养基,以1000 r/min离心5 min,弃上清液,加入20% FBS-DMEM/F12培养基,用吸管轻轻吹打使细胞充分悬浮。将细胞悬液转入新细胞培养瓶,补加培养基至5 mL/瓶。同时取100 μL细胞悬液于细胞培养瓶中,再加入等量台盼蓝染液,在显微镜下使用血球计数板,观察活细胞数量并计数,通过公式计算细胞存活率,即
细胞存活率=活细胞数/细胞总数×100%。
1.2.4 生长曲线的测定 取生长状况良好的37代红鳍东方鲀鳍细胞,用胰蛋白酶进行消化后制成细胞悬液。以6.4×104cells/mL的细胞密度接种于24孔细胞培养板中,体积为1 mL,共21个孔。将培养板置于25 ℃、 5% CO2恒温培养箱中连续培养7 d。每隔24 h取3孔细胞,在显微镜下观察活细胞,并用血球计数板计数,取其平均值,以培养时间(d)为横坐标,细胞数量(104cells/mL)为纵坐标绘制生长曲线。参考戴国俊等[9]的方法,采用SPSS 19.0软件,将数据代入Logistic曲线模型表达式Nt=A/[1+B×exp(-K×t)]中进行拟合,生成生长曲线公式与相应方差。
1.2.5 细胞大小测定 选用红鳍东方鲀35代生长状况良好的鳍细胞,用0.25%的胰酶溶液消化1 min左右,形成细胞悬液,取100 μL细胞悬液至青霉素小瓶中。加入等量台盼蓝染液,在校正好的目镜测微尺的倒置显微镜下,测量100个圆形活细胞的直径,并对数据进行分析处理。
1.2.6 细胞亲缘关系分析 选用红鳍东方鲀37代生长状况良好的细胞作为试验组,以红鳍东方鲀成体鱼鳍组织与鲫Carassiusauratus鳍组织作为对照组。在超净工作台内将红鳍东方鲀与鲫解剖,分别提取出其鳍组织放入离心管中,加入胰蛋白酶将组织消化为细胞悬液。之后按照TIANGEN公司的提取DNA试剂盒步骤对红鳍东方鲀鳍细胞系细胞、红鳍东方鲀成体鱼鳍组织、鲫鳍组织进行处理,提取出各自完整的DNA。
PCR引物的制备:参考郝君等[10]的方法,设计4对引物,其退火温度均为56 ℃(表1)。
微卫星位点的PCR扩增:建立了体积为25 μL的反应体系,内含约50 ng基因组DNA,1 ng/μL引物,1 U Taq DNA聚合酶,18 μL PCR缓冲液。在PE9700型扩增仪上进行PCR反应。反应程序为:94 ℃下变性30 s,56 ℃下退火30 s,72 ℃下反应30 s,共进行40个循环;再于72 ℃下延伸7 min。
最后将扩增产物经含有1% goodview的10 g/L琼脂糖凝胶电泳分离,在紫外投射仪下观察结果并拍照。

表1 微卫星引物序列
2 结果与分析
2.1 原代培养
将红鳍东方鲀鳍组织培养3~4 d后,大量的细胞从组织块中迁出,可以观察到明显的生长晕(图1-A)。迁出的细胞成纤维样,多突起且贴壁生长,生长分裂旺盛(图1-B)。 6~7 d 后,组织块周围形成单层, 培养30 d左右铺满培养瓶底部。
2.2 传代培养及细胞系的建立
红鳍东方鲀鳍细胞系细胞在传代后6~7 d可铺满培养瓶底部。细胞透明、均质,生长状况良好,成纤维细胞样。30 代以后停止添加I 型胰岛素样生长因子(IGF-I)、人碱性成纤维细胞生长因子(bFGF)和硫酸软骨素等生长因子, 细胞生长及分裂状况仍然良好(图2)。目前, 红鳍东方鲀鳍细胞系已传代至40代,成功建立了红鳍东方鲀鳍组织细胞系。
2.3 细胞冻存与复苏
在液氮中贮藏60 d的红鳍东方鲀鳍细胞冻存复苏后,大部分细胞呈梭形或纤维型,贴壁较好,6~7 d可以长满培养瓶底部。细胞冻存复苏的存活率为84.20%±2.20%。置于超低温冰箱(-80 ℃)中的红鳍东方鲀细胞冻存复苏后,情况相似,细胞形态未有明显变化,存活率约为83.22%±4.18%。

注:A为细胞生长晕;B为迁出细胞成纤维样Note:A,growth halo is appeared;B,cells are fibroblastoid图1 原代培养第5天时的红鳍东方鲀鳍细胞Fig.1 Fin cells of redfin puffer Takifugu rubripes in primary culture at the fifth day

图2 红鳍东方鲀37代鳍组织细胞Fig.2 Fin cells in the 37 generations of redfin puffer Takifugu rubripes
2.4 细胞生长曲线
从第37代红鳍东方鲀鳍细胞的生长曲线(图3)可知,培养于25 ℃、CO2浓度为5%、20%FBS-DMEM/F12高糖培养基中的红鳍东方鲀鳍细胞在0~2 d内处于潜伏期,2~4 d时进入对指数生长期,细胞处于生长高峰,4~5 d时进入稳定期,5 d后转入衰退期,细胞数量开始减少。群体倍增时间约为50.24 h。
由SPSS 19.0软件输出结果可见,曲线拟合的相关指数 (即拟合度,R2)为
生长曲线为
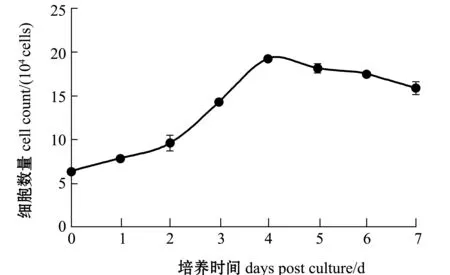
图3 红鳍东方鲀鳍细胞37代生长曲线Fig.3 Growth curve of fin cells in the 37 generations of redfin puffer Takifugu rubripes
2.5 细胞来源鉴定
本试验中扩增了4对引物,但是所选用的第1对微卫星引物能扩增出效果较好的PCR产物。其他两条未有明显条带。琼脂糖凝胶电泳结果(图4)显示,本研究中所建立的红鳍东方鲀鳍细胞系与红鳍东方鲀鳍组织电泳结果清晰,在500~750 bp位置有相同条带,而鲫鳍组织在此位置并无条带产生,说明红鳍东方鲀鳍细胞与红鳍东方鲀鳍组织为同一物种,具有相同的微卫星位点。
3 讨论
3.1 红鳍东方鲀细胞系建立方法
用于海水鱼类细胞培养使用的人工合成培养基主要有MEM、 L-15、DMEM/F12、DMEM、Medium 199等。建立线鳢Channastriatus肌肉细胞系[11]、遮目鱼Chanoschanos胚胎细胞系[5]、斜带石斑鱼Epinepheluscoioides眼细胞系[5]、红点石斑鱼Epinephelusakaara脾脏细胞系[12]时,均使用了L-15培养基。而半滑舌鳎Cynoglossussemilaevis心脏细胞系[13]的建立采用的培养基则为MEM。本试验中利用的是DMEM/F-12高糖培养基,与Chen等[14]建立的大菱鲆Scophthalmusmaximus胚胎细胞系,Holen等[15]建立的大西洋鳕Gadusmorhua胚胎细胞系,Sha等[16]建立的半滑舌鳎胚胎细胞系所用培养基相同。说明不同的鱼类细胞系对培养基的要求有所不同。
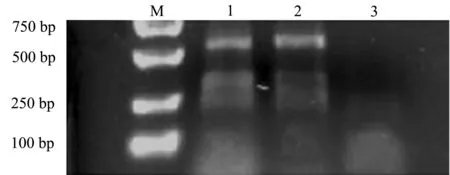
注:M为DL2000 Marker;1为红鳍东方鲀细胞样品;2为红鳍东方鲀鳍组织样品;3为鲫鳍组织样品Note:M,DL2000 Marker;1,redfin puffer fin cell sample; 2,redfin puffer fin tissue sample; 3,crucian carp fin tissue sample图4 红鳍东方鲀鳍细胞与鳍组织及鲫鳍组织PCR扩增产物电泳图Fig.4 Electrophoretogram of amplified PCR of fin cells, and fin tissue in redfin puffer Takifugu rubripes and fin tissue of crucian carp Carassius auratus
为了促进细胞的增殖和贴壁生长,在原代培养和早期传代培养的培养基中会添加促生长因子、成纤维细胞生长因子(Fibroblast growth factor,FGF)和胰岛素样生长因子(IGF)等十分常用。成纤维生长因子通过影响RNA聚合酶,加强核蛋白体基因的转录,从而加速细胞周期,促进细胞的分裂与增殖[17-18]。高首鲟鳍Acipensertransmontanus细胞系[19]和大菱鲆鳍细胞系[20]在原代培养和早期传代培养时均添加了bFGF因子。毛凝等[21]在探究欧洲鳗鲡Anguillaanguilla胸鳍细胞的最适培养条件时,也证明bFGF对该细胞的增殖与分裂有促进作用。IGFs是一类小分子的单链多肽物质,是胰岛素样生长因子家族中的一员。通过与细胞膜上的受体IGFR结合并经Ras-Raf通路来促进细胞增殖。由于bFGF作用于G2M期的细胞,IGF作用于S期、G0期和G1期的细胞,他们作用的时间不同,所以联合使用应可以达到更好的促增殖效果[18]。本试验中参考前人的工作,在原代和早期培养阶段,添加了上述两种因子,收到很好的效果,进一步证实成纤维细胞因子和胰岛素样生长因子在细胞培养中具有促进细胞分裂和生长的作用。
3.2 培养细胞的生长
生长曲线可用来测定细胞的绝对生长数值,直观的表现细胞生长过程中的数量变化,也是细胞试验中基本的试验参数之一。通过潜伏期、对数生长期、平台期等阶段的时间长短总结细胞的生长分裂规律,预测细胞的生长趋势。鱼类鳍细胞潜伏期多为1~2 d,指数生长期为2 d左右,平台期为1 d左右,之后细胞数量减少,进入衰退期。如肖艺等[22]报道的锦鲤Cyprinuscarpio鳍细胞系的生长曲线显示,0~1.5 d为潜伏期, 1.5~3.5 d处于对数期, 3.5~4.5 d为平台期, 4.5 d后进入衰退期,锦鲤鳍细胞的群体倍增时间为43.5 h。樊廷俊等[20]报道的大黄鱼Larimichthyscrocea鳍细胞系的生长曲线显示,接种后1 d为潜伏期,1~3 d为对数期,3~4 d为平台期。群体倍增时间为50.96 h。樊廷俊等[23]报道的褐点石斑鱼Epinephelusfuscoguttatus鳍细胞系的生长曲线显示,生长周期为5~6 d时,群体倍增时间为50.6 h。本试验中红鳍东方鲀鳍细胞的生长曲线显示,0~2 d内处于潜伏期,2~4 d时进入对数期。4~5 d时进入平台期,5 d后开始转入衰退期。红鳍东方鲀鳍细胞系的倍增时间为50.24 h,与已有的报道相似。说明在相近的培养条件下鱼类鳍细胞的生长基本一致。
3.3 细胞来源分析方法
微卫星DNA序列是DNA分子中一段高度重复序列,由2~6 bp的重复单位构成的DNA序列,一般有100~300 bp不等。微卫星DNA数量多且均匀分布在基因组中,具有高度的多态性、结果稳定性高等优点,是一种理想的遗传标记,已普遍应用于水生生物遗传多样性的分析、种质鉴定、亲缘关系鉴定、遗传图谱建立当中。刘海金等[24]利用微卫星分析了牙鲆Paralichthysolivaceus的遗传关系;赵程等[25]利用微卫星技术鉴定了5种不同鳜鱼属的亲缘关系远近,探究了鳜鱼的遗传潜能和遗传改良的可能性;任昆等[26]利用微卫星进行了草鱼Ctenopharyngodonidellus亲子关系的鉴定。以往对培养细胞来源的鉴定大多利用染色体制备和数量、核型分析方法,但是端粒会随着细胞有丝分裂次数的不断增加而不断地缩短,端粒的丢失会使传代细胞染色体变异的可能性增高。另外,制片过程中染色体的丢失,对试验结果准确性也会产生影响。
本试验中采用微卫星位点检测,确定红鳍东方鲀鳍细胞和红鳍东方鲀鳍组织之间的亲缘关系,试验结果误差更小,准确高效,观察直观,操作简单,实用性更好。

