扇贝裙边ACE抑制肽的分离鉴定及其降血压活性研究
,,,,,,
(大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
中国幅员辽阔,海水资源丰富,海水可养殖面积为2600.11 km2[1]。中国海水贝类养殖产量占海水养殖总产量的80%,占世界贝类总产量的60%[2], 2015年,中国扇贝产量达到 179万t,约占贝类养殖总产量的13%[3]。随着冻贝柱、干贝柱的加工和出口量越来越大,扇贝裙边数量也日益增多[4],约占扇贝总质量的27.8%。扇贝裙边的营养组成与扇贝柱相似[5],是理想的高蛋白、低脂肪、低糖类原料,故可作为开发活性肽的重要资源。
血管紧张素转化酶(Angiotensin convert enzyme,ACE)是一种含Zn2+辅基的二肽羧肽酶[6],在生物体的肾素-血管紧张素系统(Renin-Angiotensin System,RAS)和激肽释放酶-激肽系统(Kallikrein-kinin system,KKS)中可催化无活性的血管紧张素Ⅰ(AngⅠ)转化成具有收缩血管作用的血管紧张素Ⅱ(AngⅡ),促使血压升高,而血管紧张素转化酶抑制肽(Angiotensin convert enzymepeptides,ACE抑制肽)是一类具有ACE抑制活性的多肽物质,大多由2~12个氨基酸组成,极个别由更多个氨基酸组成[7],其可通过抑制ACE酶的活性,达到预防和治疗高血压等相关疾病的目的[7-8]。
目前,常见的具有ACE抑制作用的降血压药物有卡托普利、依那普利、阿拉普利和赖诺普利等,虽然此类药物的药效明显,但由于其是化学合成药物,均存在一定的副作用,如过敏反应、皮肤皮疹、咳嗽、味觉紊乱等[9-10]。所以,近年来人们开始从各种食物中不断探求具有ACE抑制活性的天然成分,用天然具有ACE抑制活性的肽作为合成药物的替代品[11]。然而,一些食源性ACE抑制肽在消化道内可能会被消化酶分解,降低其ACE抑制活性和降血压效果[12],因此,需要通过体内活性检测(即动物试验)来进一步评价ACE抑制肽的降血压效果。
本研究中,从虾夷扇贝Patinopectenyessoensis裙边酶解液中分离纯化ACE抑制肽,并通过动物试验验证ACE抑制肽的降血压效果,旨在为来源于扇贝裙边的ACE抑制肽的开发和利用提供依据,实现扇贝裙边的综合利用。
1 材料与方法
1.1 材料
1.1.1 试验原料与试剂 试验用扇贝裙边来自大连某食品加工厂下脚料,于-18 ℃下冷冻贮存。
试验用主要试剂有血管紧张素转化酶(ACE)、马尿酰-组氨酸-亮氨酸(Hip-His-Leu,HHL)、硼酸、硼砂、甲醇均购自Sigma公司;木瓜蛋白酶购自上海莲冠生物化工有限公司;氢氧化钠、冰醋酸均购自天津大茂化学试剂厂;三氟乙酸、乙腈(色谱级)均购自天津博迪化工股份有限公司。
1.1.2 试验仪器设备 匀浆机(上海标本模型厂)、Scientz-10N冷冻干燥机(宁波新芝生物科技股份有限公司)、HH-4型数显恒温水浴锅(常州国华电器有限公司)、721型紫外可见分光光度计(上海精密科学仪器有限公司)、高效液相色谱仪Aglient 1260 (安捷伦公司)、90-2低速台式离心机[上海医疗器械(集团)有限公司]、精密pH计(上海精密科学仪器有限公司)、Orbitrap Q Exactive质谱仪(美国Thermo公司)。
1.2 方法
1.2.1 扇贝裙边酶解物的制备 将扇贝裙边流水解冻后,在料液比为 1∶3(g∶mL)、木瓜蛋白酶为2%、pH为7.0、酶解温度为60 ℃的条件下酶解1 h,于95 ℃沸水中灭酶10 min,冷却至室温,调节pH至7.0,以9000 r/min转速离心20 min,取上清液冷冻干燥后即为扇贝裙边酶解物。
1.2.2 ACE抑制活性的色谱条件与测定 采用大连依利特Hypersil BDS C18色谱柱,检测波长为228 nm,流动相流速为1.0 mL/min,柱温为25 ℃,进样量为30 μL。
RP-HPLC系统流动相的配制: 300 mL甲醇中加入0.5 mL冰醋酸和1 mL三氟乙酸(TFA),用蒸馏水稀释定容至1000 mL后,用NaOH调节pH值至3.3。
底物(HHL)的配制:用含有608 mmol/L NaCl的0.2 mol/L硼酸盐缓冲液(pH 8.3),将底物Hip-His-Leu配制成7.6 mmol/L的溶液。
在0.5 mL的Eppendof管中分别加入5 μL扇贝裙边酶解物(5 mg/mL)和15 μL ACE(60 mU/mL),置于37 ℃下保温5 min后,再加入25 μL HHL(7.6 mmol/L)在37 ℃下反应25 min,加入5 μL 0.1% TFA溶液终止反应,冷却至室温,经孔径为0.22 mm的醋酸纤维膜过滤后,采用RP-HPLC定量ACE与底物反应生成马尿酸的量,来判断ACE抑制活性。ACE抑制率计算公式为
ACE抑制率=(对照马尿酸峰面积-样品马尿酸峰面积) / 对照马尿酸峰面积×100%。
1.2.3 Sephadex LH-20凝胶层析 扇贝裙边酶解产物采用Sephadex LH-20层析柱进行分离,流动相为30%的甲醇溶液,流速为0.6 mL/min,样品浓度为0.5 g/mL,上样体积为10 mL,检测波长为280 nm,自动收集器以10 min/管的速度收集样品。
1.2.4 RP-HPLC分离纯化 将ACE抑制活性高的组分冻干收集,经反相高效液相色谱分离纯化。第一次RP-HPLC分离样品质量浓度为5 mg/mL,上样量为20L,色谱柱为Hypersil BDS C18(250 mm×4.6 mm,5 μm),流动相为含有0.1% TFA的20%乙腈,流速为1 mL/min,柱温为25 ℃,检测波长为215 nm,多次收集分离组分,冻干后进行ACE抑制活性检测。第二次RP-HPLC分离条件中,除流动相为含有0.1% TFA的10%乙腈外,其余条件与第一次均相同。
1.2.5 ESI MS/MS鉴定 ESI MS/MS条件:采用电喷雾正离子扫描模式,质量扫描范围(质荷比 m/z)为 100~1500,分辨率为 70 000;选择其中强度较高的5个母离子峰采用高能碰撞诱导解离(HCD)的方式碎裂母离子,同时在静电场轨道阱(Orbitrap)内进行二级MS/MS 碎片离子扫描分析,其分辨率为 17 500。其中,一级谱的自动增益控制(AGC)为 3e6,最大离子注射时间设置为 100 ms,动态排除时间为10 s;二级谱的自动增益控制(AGC)为 5e5,最大离子注射时间设置为 120 ms。系统的操作和数据的采集都使用Xcalibur 2.1软件(Thermo 公司)完成。
1.2.6 动物试验样品的制备与分组 将扇贝裙边酶解液通过截留相对分子量3000的超滤膜,获得相对分子量范围为3000以下(含上述ACE抑制肽)的酶解液组分,冷冻干燥后,进行动物试验。
试验用雄性原发性高血压大鼠(Spontaneously hypertensive rats,SHR)购自北京维通利华实验动物技术有限公司,SPF级,体质量为240~280 g,12周龄,心脏收缩血压(Systolic blood pressure,SBP)均高于180 mmHg。SHR适应环境3 d后,随机分成空白对照组、阳性对照组(卡托普利)和酶解物组(表1),采用灌胃法进行试验。
动物饲养条件:SHR饲养房间要保持SPF级,12/12 h明暗室,温度为(23±2)℃,自由摄食且饮水,每5 d更换一次垫料,每天早8:00—9:00和晚20:00—21:00,各灌胃一次,灌胃28 d后,持续观察7 d SHR的心脏收缩压变化。

表1 试验动物分组Tab.1 Grouping of the test animals
1.2.7 心脏收缩血压(SBP)的测定 采用尾套法测定SHR的心脏收缩压。每天上午灌胃结束后,开始检测SHR的尾部动脉心脏收缩压。检测血压前,先将固定笼子预热到37 ℃,再将SHR固定在尾部测压仪上,分别在第0、1、3、5、9、14、23、26、28、30、32、35天时测定SHR的心脏收缩压,对每只SHR测定3次,取其平均值,整个饲养过程中记录其体质量。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0软件进行单因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 Sephadex LH-20层析柱对酶解产物的分离
如图1所示,扇贝裙边酶解产物通过Sephadex LH-20层析柱分离,得到7个组分峰(F1~F7),对Sephadex LH-20分离的组分每隔一管测ACE抑制活性,发现组分峰F5、F6、F7具有ACE抑制活性,ACE抑制活性在70%以上。
对其半抑制浓度(IC50)进行测定,结果如表2所示,F5、F6、F7的IC50值分别为1.4、2.3、1.7 mg/mL。因此,对F5、F6、F7进行进一步分离。

图1 扇贝裙边酶解物经Sephadex LH-20层析柱分离及ACE活性测定的结果Fig.1 Separation of scallop soft part excluding adductor hydrolyzate by Sephadex LH-20 and ACE activity determination
表2SephadexLH-20分离组分的IC50值
Tab.2IC50valuesofcomponentsseparatedbySephadexLH-20

峰号peak相关指数R2半抑制浓度IC50/(mg·mL-1)F50.991.4F60.992.3F70.991.7
2.2 RP-HPLC对活性组分的纯化
将Sephadex LH-20层析柱分离得到的具有ACE抑制活性的F5、F6、F7组分,通过RP-HPLC C18分离,结果如图2所示。经测定发现,F5-3、F7-4有ACE抑制活性。

图2 具有ACE抑制活性组分的RP-HPLC图谱Fig.2 RP-HPLC analysis of ACE inhibitory components
对图2所得F5-3、F7-4组分通过RP-HPLC(10%乙腈)进一步纯化,结果如图3所示。其中F5-3、F7-4中仅有F5-3-3、F7-4-3经检测有ACE 抑制活性,根据出峰时间相同推测,F5-3-3和F7-4-3有可能含有同种序列的ACE 抑制肽,因此,仅对F5-3-3组分进行质谱分析。

图3 F5-3和F7-4 组分RP-HPLC图谱Fig.3 RP-HPLC analysis of F5-3 and F7-4 portions
2.3 ACE抑制肽的ESI MS/MS鉴定
F5-3-3经一级质谱图(图4)和二级质谱(图5)鉴定获得多肽序列,根据质谱结果和肽段序列可信度及构效关系筛选出一个二肽,相对分子质量为304.17,氨基酸序列为Val-Trp(VW)。经合成后测定其ACE活性,相关指数R2为0.99,IC50为86.9 μmol/L。

图4 F5-3-3组分的一级质谱图Fig.4 Mass spectrum of F5-3-3 portion
2.4 动物试验
2.4.1 SHR体质量的变化 如图6所示,空白组、阳性对照组、扇贝裙边酶解物组3组SHR的体质量随时间的变化均有所增加,其中,扇贝裙边酶解物组体质量增加最多,在第28天停止灌胃后取试验鼠血液进行相关指标检测,可能导致3组SHR的体质量一定程度地下降,而后体质量又继续增加。
试验过程中,SHR正处于生长期,其体质量随时间延长而增加。然而,不同给药组SHR的体质量变化存在着较大的差别。如表3所示,空白对照组在第28天时体质量增加了(17±9)g,阳性对照组增加了(9±5)g,酶解物组增加了(22±12)g,但各组间均无显著性差异(P>0.05)。通过对SHR体质量的监测,说明灌胃的扇贝裙边酶解物不会损害SHR的正常生长状态。

图5 F5-3-3组分的二级质谱图Fig.5 Tandem mass spectrum of F5-3-3 portion

注:*表示与空白对照组有显著性差异(P<0.05)Note: *means significant difference compared with the blank control (P<0.05)图6 雄性原发性高血压大鼠的体质量随时间的变化Fig.6 Changes in SHR body weight with time after treatment
表328d中雄性原发性高血压大鼠的体质量变化
Tab.3ChangesinbodyweightSHRofmalewithin28days
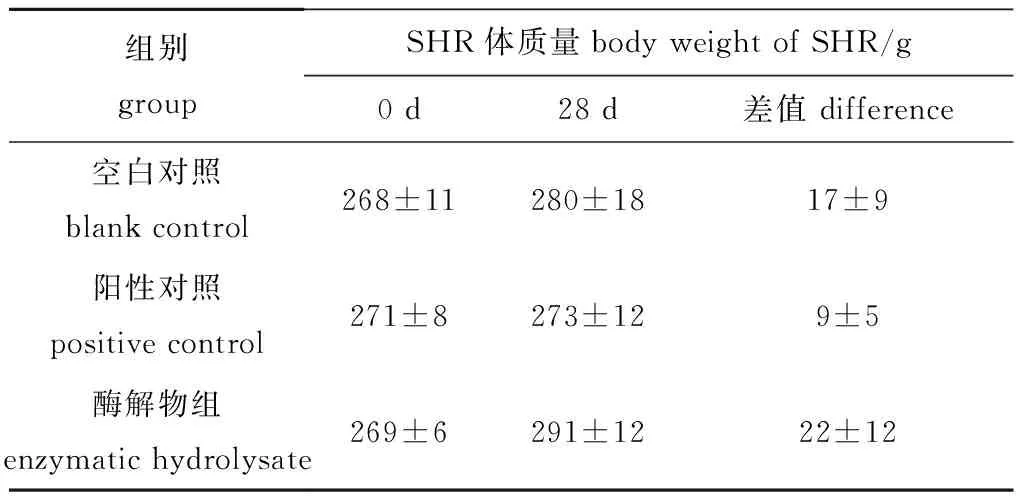
组别groupSHR体质量body weight of SHR/g0 d 28 d 差值 difference空白对照blank control 268±11280±1817±9阳性对照positive control 271±8273±129±5酶解物组enzymatic hydrolysate 269±6291±1222±12
2.4.2 SHR心脏收缩压的变化 从图7可见:空白对照组SHR的心脏收缩压在整个检测中无明显变化,始终保持在(191±3) mmHg;阳性对照组的心脏收缩压在28 d中随时间的延长而逐渐降低,在灌胃5 d时降低到(164±5)mmHg,之后保持恒定并同空白对照组相比一直表现出极显著性差异(P<0.01),在第28天时其心脏收缩压降到了(140±3)mmHg;酶解物组的SBP在28 d中随时间的延长也逐渐降低,在灌胃9 d时达到(172±7)mmHg,之后基本保持恒定并同空白对照组相比一直表现出极显著性差异(P<0.01),在第28天时其心脏收缩压降到(161±3) mmHg,与阳性对照组保持着基本相同趋势,但心脏收缩压却一直高于阳性对照组。
停止灌胃后,继续跟踪观察SHR的心脏收缩压变化情况。阳性对照组和酶解物组的心脏收缩压在停止灌胃后随时间的延长而开始上升,但在持续观察的7 d内,同空白对照组的心脏收缩压相比仍都表现出了极显著性差异(P<0.01),此结果与Wang 等[13]研究结果相似,Wang等将牡蛎蛋白酶解物进行长效动物试验,第28天时心脏收缩压降低到(158±4)mmHg,而在停药后第7天时心脏收缩压上升到(171±8) mmHg。

注:**表示与空白对照组有极显著性差异(P<0.01)Note: **means very significant difference compared with the control(P<0.01)图7 雄性原发性高血压大鼠的SBP随时间的变化Fig.7 Changes in SBP of male SHP with time
3 讨论
目前,以水产品为原料的ACE抑制肽研究较多,已发现以大海马Hippocampusramulosus[14]、刺参体壁Apostichopusjaponicus[15]、沙丁鱼Sardinamelamosticta[16]、青柳蛤Mactrachinenesis[17]等为原料,通过酶解手段获得具有ACE抑制活性的降血压肽,如海马蛋白来源的组分PH-I3,其IC50为0.896 mg/mL,该组分具有良好的pH稳定性;刺参酶解产物小于相对分子量为3000的组分具有较高的ACE抑制活性,IC50为0.8 mg/mL,对ACE表现为非竞争性抑制。此外,很多学者对以贝类为原料的ACE抑制肽的结构鉴定也展开研究。Wang等[13]从牡蛎酶解液中分离纯化出VVYPWTORF九肽,其IC50为66mol/L;吴秉宇等[18]也以扇贝裙边为原料通过酶解制备ACE抑制肽,发现一个LVIVP五肽具有较强的ACE抑制活性。本研究中从扇贝裙边中鉴定出VW二肽,IC50为86.9 μmol/L,由于其肽链短,在化学合成制药过程中具有一定优势。
鉴于ACE抑制肽可能在消化道中被消化酶酶解,其降血压效果需要通过动物试验进行验证。目前,以水产品为原料的ACE抑制肽表现为短效的降压活性,如用刺参ACE抑制肽灌胃SHR 4 h后,心脏收缩压下降26 mmHg,此后血压逐渐回升,24 h后与空白组大鼠无显著性差异[15];而长效动物试验多采用含有ACE抑制肽的酶解组分进行研究,如沙丁鱼酶解产物和青柳蛤酶解产物表现出长效的降压活性,连续灌胃28 d,SHR心脏收缩压均明显低于对照组大鼠[16-17]。本研究中以扇贝裙边酶解产物连续灌胃SHR 28 d后,又继续观察停药后大鼠的心脏收缩压情况,结果表明,停药7 d内,SHR的心脏收缩压保持稳定,显著低于空白对照,说明以扇贝裙边为原料的ACE抑制肽降压效果良好,并在停药后仍表现出降压持效性,因此,以扇贝裙边酶解产物开发降压药物或降压保健食品具有一定的优越性。此外,对扇贝裙边酶解产物的降压机制进行分析时发现,给SHR灌胃后,能引起RAS系统中如ACE、AngⅡ(血管紧张素Ⅱ)、ATG(血管紧张素原酶)、ALD(醛固酮)等相关指标下降(数据尚未发表),结果与鬼针草水提物[19]、牡蛎配伍葛根[20]、水解酪蛋白肽粉[21]等成分的降血压机制类似,进一步说明扇贝裙边酶解产物是开发降压药物或保健食品的良好原料。
综上所述,扇贝裙边酶解产物具有良好的降血压效果,扇贝裙边资源丰富、价格低廉,可作为开发降血压肽的良好原料,对其进行开发利用,能极大地提高扇贝裙边附加值,具有广阔的应用前景。

