低氧胁迫与常氧条件下斑马鱼鳃中热休克蛋白基因家族的表达差异比较
,,、、、
(1.上海海洋大学 海洋科学学院,上海 201306;2.上海海洋大学 大洋渔业资源可持续开发教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海 201306;4.远洋渔业协同创新中心,上海201306)
水体中氧含量是鱼类生存的关键因素之一,影响着鱼体的生长发育、新陈代谢、繁殖等生命过程。水体中正常的氧浓度为6.5~7.0 mg/L,当水体中的溶解氧浓度低于2.0 mg/L时为低氧/缺氧(Hypoxia)状态[1-2]。氧分子是真核细胞线粒体有氧能源的终端电子受体。氧含量的减少会降低细胞的能量代谢,从而激发活性氧的产生,导致细胞损伤和凋亡[3]。过强、持续时间过长的低氧刺激会打破生物体与环境间的平衡,对机体产生危害,但轻度、较长时间的低氧环境则可以增加生物体对低氧的耐受力[2-4]。
热休克蛋白(Heat shock proteins, HSPs)是生物受到环境中的物理、化学、生物等刺激时发生应激反应而大量产生的蛋白质,又称应激蛋白,从细菌到哺乳动物等各种有机体均广泛存在,是机体自我保护的物质基础[5-7]。当生物体受到外界刺激时,细胞便会自动关闭正常蛋白的合成进而迅速诱导合成一系列HSP蛋白来快速地调整应激发生过程中细胞的存活性能,提升细胞的抗损伤能力,帮助细胞适应应激环境,恢复正常的生理活动[8]。HSP家族中,根据蛋白分子量的大小通常划分为4类:HSP90家族[9]、HSP70家族[10-11]、HSP60家族和HSP40小分子家族。每个HSP家族成员均具有各自功能,但在生命活动过程往往又相互协调,共同发挥作用。
斑马鱼Daniorerio是一种小型鲤科热带鱼[12],自20世纪70年代美国俄勒冈大学的George Streisinger教授利用斑马鱼进行遗传学及发育生物学方面的研究以来,斑马鱼已越来越多地被应用于科学研究,成为继小鼠后又一重要的模式生物[12-13]。为研究热休克蛋白应对低氧胁迫的生物学功能,本研究中以斑马鱼为研究对象,对低氧胁迫与常氧条件下斑马鱼鳃组织进行转录组测序,比较了低氧胁迫与常氧条件下斑马鱼鳃中热休克蛋白家族基因的表达差异,以期为揭示斑马鱼的低氧适应机制提供新线索。
1 材料与方法
1.1 材料
试验样本为大洋渔业资源可持续开发教育部重点实验室(以下简称本实验室)培育多代的野生型斑马鱼(WT),养殖温度为28 ℃,饲养水体溶解氧浓度为6.7 mg/L。每日8:00、19:00喂食丰年虫。
试验用试剂:RNA提取试剂盒NucleoZOL由吉泰生物公司提供;RNA测序建库试剂盒VAHTS Stranded mRNA-seq Library Prep Kit for Illumina©由诺维赞生物公司提供;RNA反转录试剂盒购于天根生物公司;荧光定量PCR试剂盒FastStart Universal SYBR Green Master购于Roche公司;组织蛋白裂解液与Anti-ACTIN抗体购于生工生物工程(上海)股份有限公司;Anti-HSP47抗体与Anti-HSP90ab1抗体分别购于Proteintech蛋白公司和Abcam公司。
1.2 方法
1.2.1 样本低氧处理 将野生型斑马鱼(WT)置于低氧驯化箱(长沙华晓电子科技有限公司)进行不同低氧条件胁迫处理。低氧胁迫的预试验发现:低氧胁迫初期,斑马鱼的游泳速度减慢,且成群聚集在水面,出现轻微浮头现象。随着低氧胁迫时间的延长,鱼群浮头现象逐渐消失。低氧胁迫两周后,斑马鱼恢复正常运动和生理状况。故选取低氧驯化两周后的斑马鱼来进行后续试验。低氧胁迫时,水体中的溶解氧浓度按照每两小时1.0 mg/L的速度降低,6 h后溶解氧浓度降低至2.0 mg/L(记为中度低氧);历经8 h将常氧浓度(6.7 mg/L)降低至1.0 mg/L氧浓度(记为重度低氧)。保持2.0 mg/L(中度低氧)、1.0 mg/L(重度低氧)的水体养殖环境,驯化斑马鱼两周。每种溶解氧浓度条件(6.7、2.0、1.0 mg/L)下,养殖的斑马鱼至少为30尾。取常氧、低氧驯化两周后的斑马鱼各30尾,冰上麻醉,解剖获得各组织。以15尾斑马鱼为一个单位进行后续试验,且每组样本均设两个重复,以常氧条件下的斑马鱼样本作为对照。
1.2.2 鳃组织的转录组建库与测序 利用NucleoZOL试剂盒提取常氧(6.7 mg/L)、中度低氧(2.0 mg/L)、重度低氧(1.0 mg/L)条件下鳃组织的总RNA。具体步骤按照NucleoZOL试剂盒使用方法严格执行。分别制备中度低氧、重度低氧下的斑马鱼鳃的RNA样本各2个,每个RNA样本的制备包括15尾斑马鱼,共制备4组低氧斑马鱼RNA样本,分别为中度低氧(2.0 mg/L)的总RNA样本(2.0 G1、2.0 G2)和重度低氧(1.0 mg/L)的总RNA样本(1.0 G1、1.0 G2),随后将总RNA样本放于冰箱(-20 ℃)中保存,用于后续建库试验。4个总RNA样本制备好后,按照VAHTS Stranded mRNA-seq Library Prep Kit for Illumina©试剂盒说明书进行转录组建库,将4个转录组库送北京诺禾致源生物信息科技有限公司进行转录组测序。而对照组常氧斑马鱼鳃的转录组测序数据已由本实验室报道[14]。
1.2.3 实时荧光定量RT-PCR 对在常氧、低氧(1.0、2.0 mg/L)条件下驯化两周的斑马鱼,提取鳃、心脏、皮肤、肾和肌肉组织的总RNA。按照反转录试剂盒提供的步骤将RNA反转录成cDNA,以cDNA为模板进行qRT-PCR试验。所得数据进行溶解曲线分析及计算其2-△△Ct值,并用SPSS 22.0 软件进行One Way ANOVA 分析。比较低氧和常养条件下斑马鱼各组织中Hsp47、Hsp90ab1 基因的表达水平差异。以β-actin作为qRT-PCR的内参基因,基因的引物设计如表1所示。
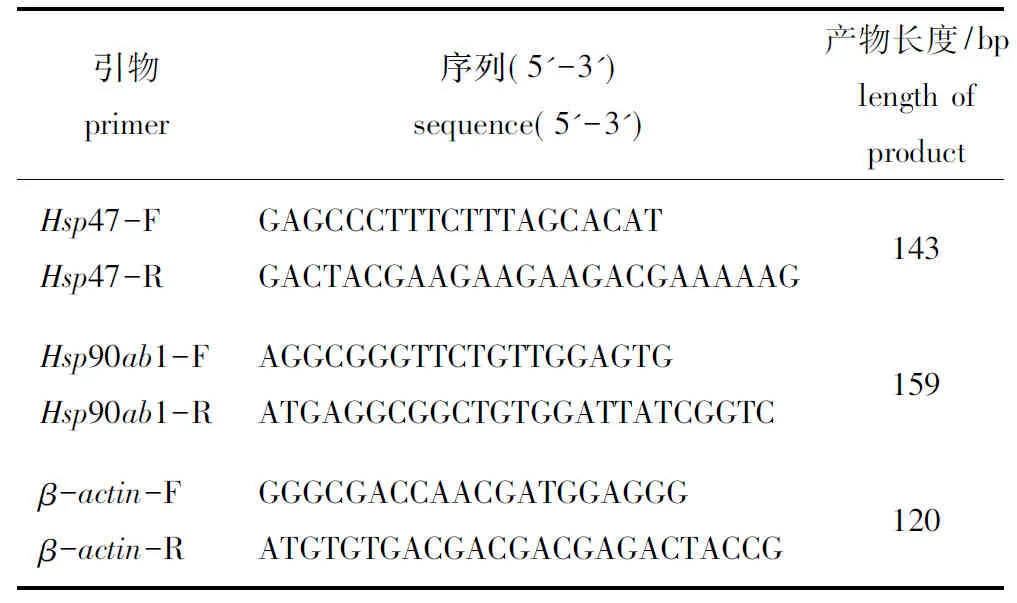
表1 实时荧光定量PCR引物Tab.1 Primers for qRT-PCR
1.2.4 Western Blot法分析 分别提取常氧、中度低氧、重度低氧条件下的斑马鱼鳃组织蛋白,加入组织蛋白裂解液(强裂解液A∶液B=100∶1),充分裂解后离心提取上清,加入含有巯基乙醇的上样缓冲液,沸水煮10 min变性。从每个样本提取30 μg的蛋白进行10% SDS-PAGE 蛋白胶电泳。用孔径为0.45 μm 的PVDF 膜(Millipore) 在250 mA 下转膜1 h。封闭后分别用Anti-HSP47抗体(1∶1000)、Anti-HSP90ab1抗体(1∶1000)和Anti-ACTIN抗体(1∶2000) 孵育过夜。再用PBST 洗涤3 次(每次5 min),二抗孵育(1∶2000),室温下静置1 h。用PBST 洗涤3次,加入显影液,使用化学发光成像仪成像,检测蛋白的表达。
2 结果与分析
2.1 转录组测序与基因差异表达分析
对从低氧斑马鱼鳃中提取的4个RNA(2.0 G1、2.0 G2、1.0 G1、1.0 G2)进行建库、测序,得出数据后与本实验室已发表的常氧斑马鱼鳃转录组数据进行对比[14](常氧斑马鱼鳃转录组数据来源于http://asia.ensembl.org/info/data/ftp/index. html)。 对比后选取P<0.05、|lgFC|>2的基因作为差异基因进行后续分析。
斑马鱼转录组用于比较的基因共17 813个,在两个低氧胁迫条件下发生显著改变的基因数目各不相同。其中,共有1582个基因表达量在两个低氧胁迫下均显著上调,2134个基因表达量在两个低氧胁迫下同时显著下调。在两种低氧浓度下表达量均发生显著改变的基因中,筛选出全部HSP蛋白家族基因进行分析。结果发现,在两种低氧胁迫下,斑马鱼HSP蛋白家族基因中产生显著变化的基因共28个,其中16个HSP蛋白家族基因表达量显著上调,12个HSP蛋白家族基因的表达量显著下调(P<0.05)。表达量增加最多的是Hsp47基因,除分子量较大的Hsp90ab1基因外,其他表达量上升的热休克蛋白基因均为Hsp40的同源基因,均为小分子量HSP蛋白基因(图1)。
2.2 低氧胁迫下Hsp47与Hsp90ab1基因的表达
低氧胁迫下,在表达显著上升的HSP家族基因中挑选出表达量增加最大的Hsp47基因、分子量最大的Hsp90ab1基因进行qRT-PCR验证。按照前述低氧处理方法进行中度低氧(2.0 mg/L)、重度低氧(1.0 mg/L)驯化。提取常氧、中度低氧和重度低氧3个培养环境下的试验组斑马鱼鳃、心脏、皮肤、肾脏、肌肉组织的总RNA,电泳检测后进行后续qRT-PCR试验。
从图2可见:与常氧相比,在重度低氧胁迫(1.0 mg/L)时,斑马鱼鳃、肌肉和心脏中的Hsp47基因表达极其显著升高(P<0.001);在中度低氧胁迫(2.0 mg/L)时,斑马鱼肌肉中Hsp47基因表达比常氧条件下极其显著升高(P<0.001),

注:热图中每个方格表示HSP蛋白家族基因在低氧胁迫下的表达量丰度,丰度随颜色由绿到黑到红依次增加。绿色代表低氧胁迫下表达量下调的基因,红色代表低氧胁迫下表达量上调的基因Note:Heat map indicates HSP family genes expression abundance during increase from green color,then black to red color hypoxia stresses in a pane.Green indicates the down-regulated genes while red indicates up-regulated genes during the hypoxia stress图1 低氧胁迫下HSP蛋白家族基因差异表达热图Fig.1 Heat map of the differential expression of HSP genes during hypoxia stress
在鳃中的表达也比常氧下的表达极显著升高(P<0.01)。与常氧条件下相比,两种低氧胁迫下,Hsp47基因在皮肤和肾脏中的表达量均极显著下降(P<0.01)。
低氧胁迫下,在各组织中的大分子量蛋白基因Hsp90ab1表达量与Hsp47基因有明显差异。从图3可见:与常氧时相比,在重度低氧胁迫(1.0 mg/L)时,除心脏之外,斑马鱼鳃、肌肉、皮肤和肾脏中的Hsp90ab1基因表达极其显著升高(P<0.001);在中度低氧胁迫(2.0 mg/L)时,仅有鳃与肌肉中的Hsp90ab1基因表达量比常氧时极其显著升高(P<0.001),而心脏与肾脏中的Hsp90ab1基因表达量表现出显著或极显著下降(P<0.05或P<0.01)。
综上所述,低氧胁迫下的斑马鱼,其Hsp47和Hsp90ab1基因在各组织中均有表达,且斑马鱼鳃和肌肉组织中两种热休克蛋白基因的表达量均为显著增加。可以推测,斑马鱼鳃和肌肉中的热休克蛋白在低氧应激中发挥重要作用。

注:*表示与对照组差异显著(P<0.05);**表示与对照组差异极显著(P<0.01);***表示与对照组差异极其显著(P<0.001),下同Note:*means significant difference compared with the control(P<0.05); **means very significant difference compared with the control(P<0.01); ***means very significant difference compared with the control(P<0.001),et sequentia图2 常氧与低氧胁迫下Hsp47基因在各组织中的表达量比较Fig.2 Relative expression of Hsp47 gene in different tissues in the zebrafish exposed to normoxia and hypoxia
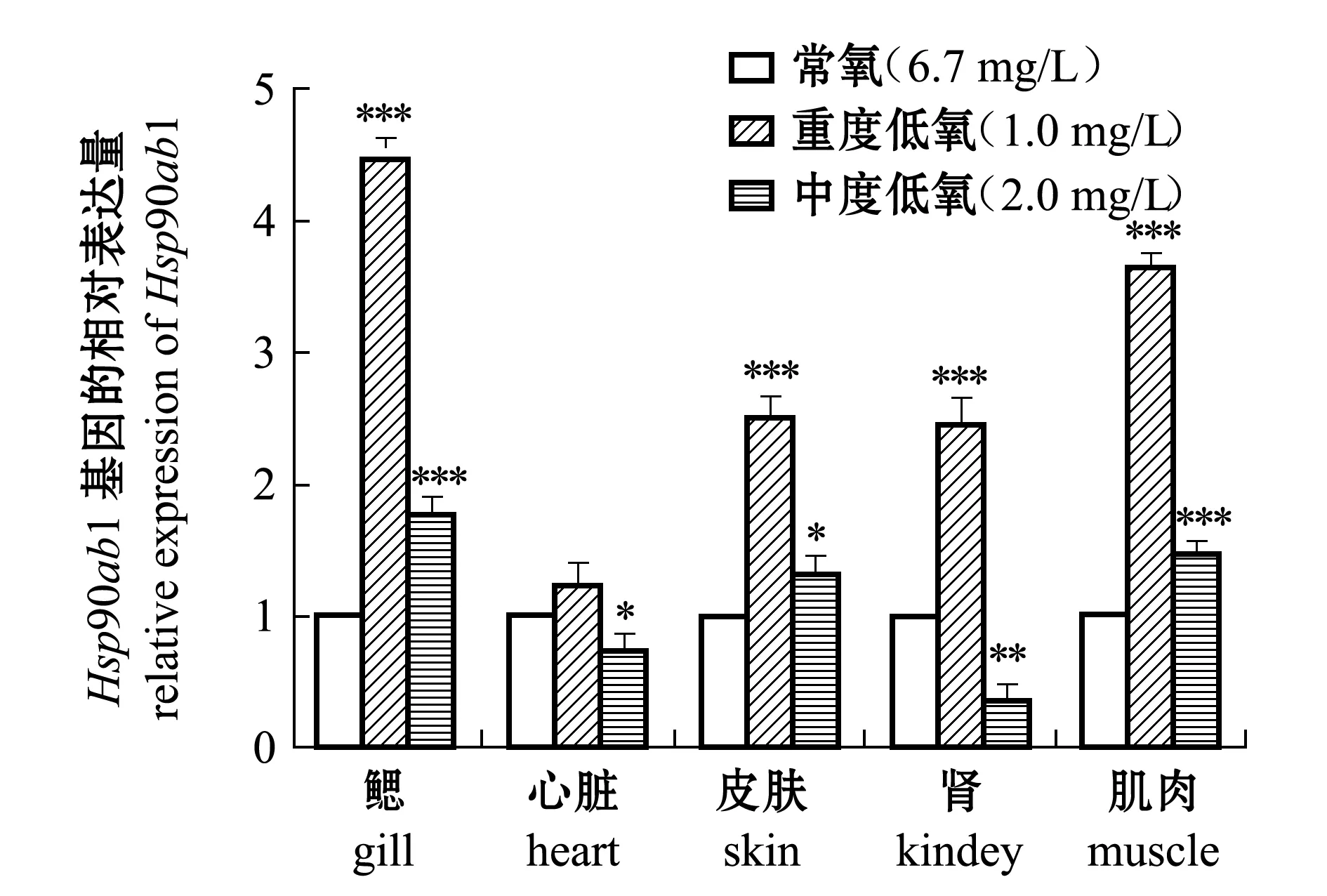
图3 常氧、低氧胁迫下Hsp90ab1基因在各组织中的表达量比较Fig.3 Relative expression of Hsp90ab1 gene in different tissues in zebrafish exposed to normoxia and hypoxia
本试验中用Western Blot方法,检测了常氧与低氧胁迫下斑马鱼鳃中HSP47和HSP90ab1蛋白的表达。如图4所示,在中度低氧(2.0 mg/L)与重度低氧(1.0 mg/L)胁迫下,斑马鱼鳃中的HSP47和HSP90ab1蛋白表达量均显著高于常氧条件下的蛋白表达量(P<0.05)。
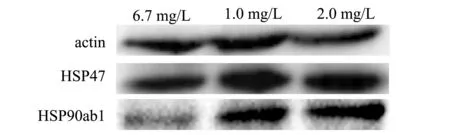
图4 常氧与低氧胁迫下鳃中HSP47和HSP90ab1蛋白的表达Fig.4 Protein expressions of HSP47 and HSP90ab1 in the gills of zebrafish exposed to normoxia and hypoxia
3 讨论
3.1 低氧环境下热休克蛋白的调控作用
氧浓度变化对生物体生存影响较大,在应对生存环境的氧气条件改变时,生物体会产生热激蛋白来应对这一变化,包括Hsp70、Hsp90和Hsp27等基因[15]。研究表明,当小鼠急速运动后处于低氧状态时,检测小鼠腓肠肌中Hsp70的表达,发现低氧与常氧相比,其表达量明显上升;进一步将急性低氧处理后的小鼠放在低氧环境和常氧环境中观察,发现小鼠腓肠肌中Hsp70在低氧环境下表达量更高[16]。HIFs低氧诱导因子,在低氧状态下会大量表达,而HSPs热激蛋白基因中大多数是HIFs基因的靶基因。低氧状态下HIF-1可以诱导Hsp70的转录[17-18];HSP70蛋白也可通过VHL途径调控HIF-1α使其降解[19-20]。还有研究发现,果蝇在经过低氧处理后,血红细胞中HSP70蛋白过表达的果蝇更耐低氧[21]。HSP90也是一种重要的应对氧气改变的应激蛋白。研究显示,急性低氧处理大鼠后,大鼠心肌细胞内的Hsp90 mRNA表达量明显增加[22],而对大鼠先进行慢性间歇性低压低氧处理,再进行急性低氧处理,可检测到大鼠心肌细胞中的Hsp27、Hsp70 mRNA的表达量显著升高[23]。可见,大鼠的心肌细胞通过增加Hsp27、Hsp70、Hsp90 mRNA的表达来保护心肌细胞免受低氧损伤[24]。面对水体中溶解氧含量的降低,鱼类也会通过调节自身的生理活动来应对环境的改变,其中应激蛋白起到不可忽视的作用[25]。
3.2 低氧环境下斑马鱼热休克蛋白基因的表达差异
本研究中选取模式生物斑马鱼作为研究对象,将其分别放于重度低氧(1.0 mg/L)和中度低氧(2.0 mg/L)的环境中驯化两周,运用高通量测序测定斑马鱼在两个低氧浓度下鳃组织中热应激蛋白基因的变化情况,检测到在整个斑马鱼体内由低氧引起显著改变的热激蛋白基因有28个。在表达量上升的16个基因中,除Hsp90ab1基因的分子量较大外,其他基因均为Hsp40同源基因,均为小分子HSPs蛋白家族基因(图1)。而在表达量下降的热休克蛋白基因中,除Hsp90aa1.2和Hsp70.3两个基因属于大分子热休克蛋白基因外,大多数是小分子的HSPs蛋白家族基因(图1)。可以推测,斑马鱼在面对低氧应激时,小分子HSPs显得更为重要。其他类似研究也表明,小分子HSPs在应对胁迫时,由于其特殊的分子结构和较强的分子伴侣功能,所起到的作用更大[26-27]。
热休克蛋白HSP47是热休克蛋白家族中唯一具有胶原特异性的小分子蛋白,首次在小鼠的内胚层细胞中分离出来[28]。大多数研究表明,HSP47主要分布在生物体的内质网中,参与胶原前体的加工、折叠、合成和分泌等过程,它同时参与了细胞生长、增殖等生理活动[29]。当生物体遭遇外界刺激时,HSP47通过调节蛋白运输、聚集和解离等活动来起到保护细胞的作用[28]。HSP90ab1属于大分子的热休克蛋白,不仅参与细胞信号传导、细胞增殖和分化等调控过程,也参与细胞的氧化损伤保护等调控[30]。同时也有研究表明,Hsp47与Hsp90ab1基因是低氧应答基因HIF的靶基因,参与HIF低氧作用下的调控机制,在生物体面对低氧刺激时起到必不可少的作用[19]。
本研究中发现,低氧胁迫下,Hsp47和Hsp90ab1基因在鳃和肌肉中的mRNA 表达量显著高于其他组织(皮肤、心脏和肾脏)中的表达量(图2、图3),这表明鳃和肌肉中的热休克蛋白在低氧应激中起着重要作用。鳃是大多数水生生物直接与水环境接触,进行氧气交换的器官,在应对环境中氧气改变时,表现出强烈的改变。本研究中还发现,在应对重度低氧(1.0 mg/L)胁迫时,Hsp47、Hsp90ab1基因在大多数组织中的表达量明显高于中度低氧(2.0 mg/L)胁迫与常氧组(图2,图3)。可以推测,氧浓度越低,组织应对低氧浓度的反应越强烈。有研究检测到,在子痫患者体内随病情的加重其体内的低氧应答基因HIF和热激蛋白基因Hsp70的表达量均呈正相关。可见,低氧胁迫下,氧浓度越小,其热激蛋白的表达量也会随之增加[31]。
由此可知,当生物体的生存环境发生改变时,热激蛋白是机体应对环境变化时所产生的最重要蛋白之一。本研究结合转录组测序、生物信息学、Western blot等手段,挖掘出HSP47和HSP90ab1蛋白可能是斑马鱼低氧应激中最重要的热休克蛋白成员,具有重要的适应功能。这些研究结果也为后续进一步描绘斑马鱼低氧应答网络奠定了基础。

