大型海藻的降血压活性研究进展
高枫宇,吴晗琪,高秀君,曹立新,周莹,闫培生,*
(1.哈尔滨工业大学(威海)海洋科学与技术学院,山东威海264209;2.威海威高生物科技有限公司,山东威海264209)
高血压(hypertension)是常见的慢性心血管疾病,是心脑血管疾病的最重要危险因素,目前全球因患高血压死亡人数每年超过700万,也是人类总死亡率的第一危险因素[1]。二十世纪六十年代以来,因患高血压而死亡的人数逐年增加,现在临床常用的降血压药物有卡托普利、苯那普利、氯沙坦、缬沙坦、依那普利和赖诺普利等,它们是通过抑制血管紧张素转换酶(angiotensin-converting enzyme,ACE)起到降血压的作用,但它们都是化学合成药,长期服用后会对身体产生副作用,如咳嗽,味觉障碍,高钾血症和皮疹等[2],所以需要开发天然的、安全无副作用的降压药。随着社会的发展和科学技术的进步,人们把研究的目光从陆地转向海洋,希望从海洋生物中获得有效的降血压活性物质。海洋中的大型海藻种类丰富,容易获得,而且具有很高的营养价值和应用价值,成为开发降压食品和药品的重要来源。
大型海藻主要包括红藻门、绿藻门和褐藻门等门类,我国大型海藻物种超过1 300种[3]。常见的种类,如红藻门的紫菜、石花菜、江蓠、龙须菜、海萝等,现从海洋红藻中已分离鉴定了包括各种骨架的单萜、倍半萜、二萜、三萜、甾体、C15聚乙酰类、酚类化合物,以及其它类型代谢产物,并且部分化合物显示特殊的生理活性[4];绿藻门的石莼、浒苔、小球藻等,富含多不饱和脂肪酸、蛋白质、多糖等多种生物活性物质,具有降血脂、降血压、抗肿瘤、抗感染等功效[5];褐藻门的海带、裙带菜、羊栖菜和鹿角藻等,目前研究发现褐藻中主要的活性成分包括多糖类、蛋白类、萜类、多酚类、氨基酸类,还有多种维生素、矿物质和微量元素,这些活性成分使之具有抗癌、降血压、降血脂、抗病毒、抗肿瘤、抗凝血等多种生理活性[6-9],对褐藻多酚、褐藻多糖、褐藻胶等物质的抗菌抗肿瘤、降血糖、降血压等活性的研究也是目前的热点。
本文首先对降血压机制和降血压活性的检测方法进行了归纳总结,然后,重点对不同大型海藻的降血压活性进行了评述,并展望了大型海藻降血压研究的未来方向和重点内容,以期为大型海藻的深度开发利用提供借鉴。
1 降血压机制
血液从心脏流经血管到达全身各处时对血管壁产生的压力,叫做血压。患有高血压的人由于病变使血管变窄,使血液流经全身变得困难,为了使血液能通过血管导致血流压力升高,这就使动脉血压超过正常值而形成高血压。人体内调节血压受多种因素影响,主要包括升压系统和降压系统、内皮依赖性血管收缩因子和舒张因子系统以及一些其他具有调节血压的因子。
1.1 肾素-血管紧张素系统与激肽释放酶-激肽系统
升压系统,即肾素-血管紧张素系统(renin-angiotensin system,RAS)和降压系统,即激肽释放酶-激肽系统(kallikrein-kinin system,KKS)之间的平衡是调节血压最重要的环节,系统中存在的血管紧张素转化酶(angiotensin converting enzyme,ACE)则是影响 2个系统平衡的主要因素,ACE是RAS系统中将血管紧张素Ⅰ(AngⅠ)转换为血管紧张素Ⅱ(AngⅡ)的关键物质[10],而AngⅡ是活性很强的血管收缩剂,导致血压升高;另一方面,ACE也能作用于KKS系统中的降血压物质缓激肽使其失活,从而使KKS系统处于抑制状态,同样导致血压的升高[11]。经研究发现,能对ACE起抑制作用的物质能够有效地防治高血压,其中包括具降血压功效的多肽(angiotensin converting enzyme inhibitory peptides,ACEIP)。ACE是一种含锌二肽羧基肽酶,有2个结合Zn2+的位点,即ACE催化反应的活性基团部位。降血压肽能够与ACE活性部位的Zn2+竞争性结合,导致ACE的活性受到抑制,阻止ACE水解血管紧张素Ⅰ转变为血管紧张素Ⅱ,减少血管紧张素Ⅱ的生成;同时,阻止催化水解激肽,减缓激肽的破坏,从而发挥降低血压的作用[12]。
1.2 内皮依赖性血管收缩因子/舒张因子系统
内皮依赖性舒张因子主要包括一氧化氮(nitric oxide,NO)、环氧合酶 1(cyclooxygenase-1,COX-1)、环氧合酶 2(cyclooxygenase-2,COX-2)、C 型利钠肽(ctype natriuretic peptides,CNP)。一氧化氮是体内最重要的舒血管物质[13],内皮细胞中的一氧化氮需要有左旋精氨酸(L-Arg)作为底物,在四氢叶酸辅助下,由内皮细胞表达的一氧化氮合成酶(endothelialnitric oxide synthase,eNOS)生成,eNOS是NO的重要来源。NO在血管舒张状态和血压调节中的作用主要有调节血小板凝聚、白细胞与内皮细胞的黏附、血管平滑肌细胞增殖和血管形成,因此一氧化氮产生异常在动脉硬化和高血压中扮演着重要角色。COX-1和COX-2分别作用于血小板膜磷脂的花生四烯酸和内皮细胞膜磷脂的花生四烯酸后主要产生血栓素A2(human thromboxane A2,TXA2)和前列环素(prostaglandins I2,PGI2)[14]。其中TXA2具有收缩血管、诱导血小板聚集等作用,而PGI2的作用与它相反,两者在血管稳态和血小板聚集中发挥着重要作用。C型利钠肽由血管内皮细胞分泌,可调节血管张力,是强有力的非内皮依赖性外周静脉扩张剂。内皮依赖性收缩因子主要包括内皮素、不对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)、尾加压素Ⅱ(urotensinⅡ,UⅡ)、耦联因子 6(cou plingfactor6,CF6),其中ADMA是一氧化氮合酶(eNOS)竞争抑制剂,血浆ADMA水平升高,NO合成减少,导致内皮受损和动脉粥样硬化形成。这些因子是高血压发生、发展的重要因素,通过影响内皮细胞的相关因子可以调节血压。除此之外,还有凝血因子、黏附因子和生长因子也与血压的调节有一定的关系[15]。
2 降血压活性的检测方法
降血压活性的检测主要包括分子水平、细胞水平和动物水平。
2.1 分子水平的降血压检测方法
分子水平检测降血压活性的方法最常用的是通过对ACE抑制活性的测定来确定其降血压效果。原理是利用一些血管紧张素Ⅰ的模拟底物,在一定条件下通过与ACE作用产生具有特异吸收特性的物质,而血管紧张素转化酶抑制剂(ACEI)可以抑制ACE的活性。通过对加入ACEI前后吸收特性的差异变化来计算ACEI的抑制率的大小,该ACEI的抑制率就表示了降血压物质的活性。根据测量方法与仪器的不同,测定手段包括:紫外分光光度计法、可见光分光光度计法、高效液相色谱法、高效液相色谱-电喷雾质谱法和高效毛细管电泳法等[16]。
2.1.1 紫外分光光度计法
虽然多年来一直都有对从天然产物中提取、制备ACEI的研究,但检测对ACE的抑制活性多采用Cusmhan的活性检测方法。Cushman DW和Cheung HS在1971年提出了紫外分光光度法[17],其原理是ACE与马尿酰组氨酰亮氨酸(N-hippuryl-his-leuhydrate,HHL)作用生成马尿酸(hippuric acid,Hip)和甘氨酰-甘氨酸(glycylglycine,Gly-GLy),其中 HHL 是血管紧张素Ⅰ的代替物,研究发现马尿酸在228 nm处有吸收峰,通过测定加入抑制剂前后所生成马尿酸紫外吸光度值的差值来计算模拟物对ACE活性的抑制率的大小。该方法对仪器要求不高,但对操作要求较高,试验结果误差难以控制,而且除了生成的马尿酸外,未反应的组氨酰亮氨酸在228 nm处也有吸光度,导致结果偏大,故需要对生成的马尿酸进行萃取再进行测定。
2.1.2 可见光分光光度计法
这种方法是1979年Holmquist创立的,比Cushman法更快速和高效[18]。骆琳等测定了商品血管紧张素转化酶抑制剂Captopril的IC50值,结果表明该值与文献报道的测定结果一致,进而说明该方法测定ACE抑制率的可行性[19]。该方法是用呋喃丙稀酰三肽(faphe-gly-gly,FAPGG)作为ACE的底物,将其水解成相应的氨基酸(fa-phe,FAP)和双甘氨肽(GG),然后在波长为340 nm下测定吸光度。GG在340 nm处没有吸收峰,随着FAPGG的分解,将会使其在特定波长的吸光度下降,故可通过测定加入ACE抑制剂前后吸光度的差值来计算对ACE抑制率大小。
2.1.3 高效液相色谱法
高效液相色谱法的测定原理与紫外分光光度法的一样,只是在其基础上引入高效液相色谱系统,通过测定加入ACE抑制剂前后在228 nm处吸光度值的变化值来确定其抑制率的大小。与其他测定方法相比,这种方法具有检测效果好、精确等优点,成为目前检测ACE抑制活性最常用的一种方法。
2.1.4 高效液相色谱-电喷雾质谱法
这种方法是在高效液相色谱法的基础上连接了电喷雾质谱,该方法中的反应产物能够很好的从混合物中分离出来,可以提高试验的准确性和可重复性,同时还可降低底物浓度,简化预处理过程[20]。
2.2 细胞水平降血压活性的检测
2.2.1 人脐静脉内皮细胞产NO模型
原发性高血压的早期会出现血管内皮功能的障碍,从而导致某些舒血管物质,如NO释放减少,某些缩血管物质,如内皮素(endothelin,ET)释放量增加。所以可以通过测定降血压物质作用的人脐静脉内皮细胞的NO产生情况和能力来检测其降压活性[21]。Wajp Wijesinghe等测定了腔昆布提取物对ACE的抑制效果,并采用该模型研究提取物中二鹅掌菜酚对内皮细胞产NO的作用,结果表明它能诱导细胞产生NO,是具有ACE抑制活性物质的可能来源[22]。
2.2.2 巨噬细胞炎症因子表达抑制模型
炎症因子如白细胞介素-1β(IL-1β)、前列腺素(PGE2)、环氧化酶-2(COX-2)、肿瘤坏死因子(TNF-α)等在高血压及其并发症的发生和发展中起重要的作用[23]。通过检测药物对炎症因子表达的抑制来确定药物的降血压和预防效果。
2.3 动物水平降血压活性的检测
该方法主要是通过单次给药或连续给药高血压大鼠,测定它们的收缩压变化来确定物质的降血压效果。高血压大鼠模型主要可分为两大类,一是原发性高血压大鼠(SHR),二是继发性高血压大鼠模型。其中,根据动物模型的制备方法不同,继发性高血压大鼠模型又经常分为:1)单肾单夹肾血管性高血压大鼠模型;2)两肾一夹肾血管性高血压大鼠模型;3)双肾双夹肾血管高血压大鼠模型;4)药物诱发高血压大鼠模型;5)高盐饮食诱导的高血压大鼠模型;6)DOCA-盐诱导的高血压大鼠模型;7)腹主动脉结扎法高血压大鼠模型;8)高果糖饮水诱导高血压大鼠模型等[24]。根据不同试验目的可采用不同的高血压大鼠模型,在检测某物质在动物水平对ACE的抑制效果时,SHR是最常用的模型。
3 大型海藻的降血压活性
大型海藻中每一个门中都有多种藻类,不同藻类的降压有效物质不一样,有的藻类多肽具有降压活性,而有的则是通过多酚类化合物或者碳水化合物来达到降压效果,除此之外,它们发挥作用的机制也不一样,近几年已从大型海藻中发现了多种具有降压活性的物质(见表1)。目前对降压肽的研究比较多,有的藻种已明确有效成分分子量的范围、分子结构以及抑制ACE的方式(竞争性抑制、非竞争性抑制)等,为海藻降血压活性的进一步研究提供了依据。
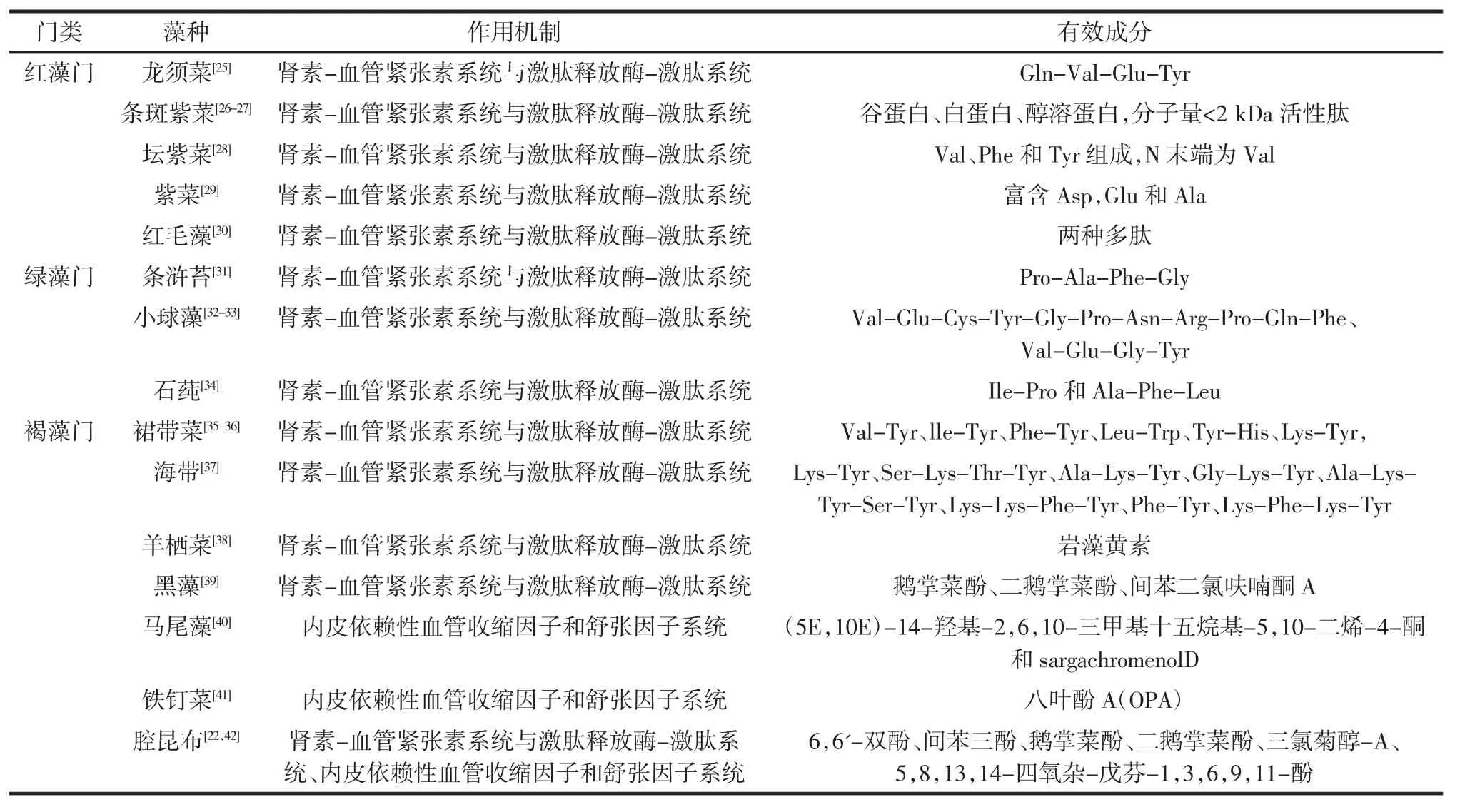
表1 国内外研究中常见大型海藻降血压活性作用机制及成分Table 1 Mechanisms and components of hypotensive activity of common large seaweeds in studies at home and abroad
3.1 红藻降血压活性
龙须菜和紫菜是我国主要的养殖海藻,数量庞大,现在对红藻门降血压作用研究主要集中在龙须菜和紫菜这些易得可食用的藻种,经研究表明从龙须菜和紫菜蛋白中获得的生物活性肽可能是降血压食品的潜在来源。Dequn Cao等用复合风味蛋白酶,胰蛋白酶,木瓜蛋白酶和碱性蛋白酶将龙须菜水解,其中胰蛋白酶的水解产物对ACE表现出最高活性,而且该产物分子<3 kDa部分对ACE的抑制活性最高,在产物浓度为2.0 mg/mL时其抑制率为(78.15±1.56)%,并从中鉴定出的多肽序列为Gln-Val-Glu-Tyr,它的IC50值为 474.36 μmol/L(0.255 mg/mL)[25]。
Wenjuan Qu等用酶将条斑紫菜水解,得到对ACE具有抑制效果的蛋白,主要有谷蛋白、白蛋白和醇溶蛋白3种,其中谷蛋白的降血压活性最强[26]。姚兴存等优化了用木瓜蛋白酶水解条斑紫菜来制备ACE抑制肽的条件,得到的产物对ACE的抑制率达30%以上,IC50值为4.48 mg/mL[27]。刘淑集等从坛紫菜制备的、分子量在860 Da左右的组分对ACE的抑制率达89.54%,经测定该降压肽中含有3个Val、2个Phe、1个Tyr组成,N末端为Val[28]。Raúl E.Cian等水解Pyropia columbina获得分子量为2 300 Da,富含Asp,Glu和Ala这3种氨基酸的肽,经测定其对ACE的IC50为(1.2±0.1)mg/mL[29]。
Qiang Wu等对红毛藻中的藻红蛋白进行酶解产生 ACE 抑制肽,其 IC50为(0.191±0.004)mg/mL,大多数成分的分子量低于2 kDa,经过分子对接试验检测和分析,得到了两种纯化产物多肽ALLAGDPSVLEDR和VVGGTGPVDEWGIAGAR,以及它们的作用结合位点[30]。
3.2 绿藻的降血压活性
绿藻降血压活性研究近几年主要集中在浒苔、小球藻及石莼等藻种,研究者们分别确定了活性肽的分子量范围以及序列,为后续研究奠定了基础。Pan S等从条浒苔中分离出了对ACE具有抑制作用的多肽,其中ACE抑制活性较高的成分分子量低于10 kDa,并确定了活性肽的序列为Pro-Ala-Phe-Gly,其IC50值为35.9 μmol/L,是降压作用的高效成分[31]。而Sheih I C等从小球藻废弃蛋白中分离到具有降压活性的11肽,经测定其序列为Val-Glu-Cys-Tyr-Gly-Pro-Asn-Arg-Pro-Gln-Phe,IC50值为 29.6 μmol/L,并揭示了该多肽与ACE的结合模式是非竞争性的[32]。相类似的,Seok-Chun Ko用不同的酶水解椭圆小球藻得到水解产物,结果显示用碱性蛋白酶水解椭圆小球藻得到的产物具有最高的ACE抑制活性,而且从低于5 kDa的组分中分离出了有效ACE竞争性抑制肽,其序列为Val-Glu-Gly-Tyr(分子量:467.2 Da,IC50值:128.4 μmol/L),并且通过饲喂致病原发性高血压小鼠发现其可以显著降低高血压症状[33]。Lisete Paiva等也用酶解法从石莼中提取得到具有ACE抑制活性的水解产物,经测定效果明显,其IC50值为0.483 mg/mL,并从小于1 kDa组分中分离出两种具有热稳定性的ACE抑制肽,序列分别为 Ile-Pro 和 Ala-Phe-Leu,而且表明 IP(Ile-Pro)作为一种非竞争性抑制剂起作用,而AFL(Ala-Phe-Leu)则是一种竞争性抑制剂,其IC50值分别为0.020 mg/mL和0.023 mg/mL[34]。
3.3 褐藻降血压活性
在大型海藻中,褐藻是研究最多的,它含有很多营养物质,也具有各种生物功能,成为保健品和药物的潜在来源。对褐藻降血压活性研究中,裙带菜、马尾藻、海带、墨角藻、羊栖菜等是研究较多的藻种,具降血压作用的物质主要有肽类、氨基酸类(如褐藻氨酸、牛磺酸)、脂肪酸、多酚类、酮类、多糖等[43]。
从褐藻中已经分离鉴定出几十种具有降血压活性的肽类,Minoru Sato等从裙带菜中分离出7种ACE抑制肽,经测定其序列及IC50分别为Ile-Trp(1.5μmol/L),Val-Trp(3.3 μmol/L),lle-Tyr(6.1 μmol/L),Ala-Trp(18.8 μmol/L),Leu-Trp (23.6 μmol/L),Val-Tyr(35.2 μmol/L)和 Phe-Tyr(42.3 μmol/L),将这些二肽单次给药高血压小鼠,发现 Val-Tyr、lle-Tyr、Phe-Tyr、Leu-Trp这4种二肽对小鼠血压的下降有明显的效果[35]。Suetsuna Kunio等从裙带菜中提取粗肽物质,并分离出10个二肽,其氨基酸序列分别为Tyr-His,Lys-Trp,Lys-Tyr,Lys-Phe,Phe-Tyr,Val-Trp,Val-Phe,Ile-Tyr,Ile-Trp 和 Val-Tyr,然后合成 Tyr-His,Lys-Tyr,Phe-Tyr和Ile-Tyr二肽,单次给药和反复口服给药自发性高血压大鼠,结果显示显著降低了大鼠的血压,在这4种二肽中,服用Lys-Tyr的大鼠具有较低的ACE抑制活性,但在体内表现出更大的降血压作用,所以Lys-Tyr可以在体内以完整的结构被吸收并显示其生理活性[36]。Ji-Cheng Chen测定了海带蛋白经酶水解后产生的8种短肽的ACE抑制活性,它们的序列及IC50分别为 Ala-Lys-Tyr-Ser-Tyr(2.42 μmol/L),Phe-Tyr(4.83 μmol/L),Lys-Tyr(5.24 μmol/L),Ala-Lys-Tyr(7.52μmol/L),Gly-Lys-Tyr(7.94 μmol/L),Lys-Phe-Lys-Tyr(10.73 μmol/L),Lys-Lys-Phe-Tyr(15.33 μmol/L)及Ser-Lys-Thr-Tyr(20.63 μmol/L),并揭示了相应的二肽或三肽比其四肽具有更强的ACE抑制活性,表明海带蛋白是降血压肽的良好来源[37]。
褐藻中的类胡萝卜素类主要包括胡萝卜素、叶黄素、虾青素、褐藻黄素等,也具有一定的降血压作用。Hemlatha Nagappan等从两种马尾藻(Sargassum siliquosum、Sargassum polycystum)得到甲醇粗提物,经进一步纯化后获得富含岩藻黄素的馏分,经测定粗提物和岩藻黄素都表现出对ACE的抑制活性,但是粗提物对ACE抑制率比岩藻黄素的抑制率低[38]。
褐藻多酚化合物是褐藻的次级代谢产物,具有多种生物活性,一般通过形成糖蛋白类和蛋白质类化合物抑制ACE活性达到降血压功效。Hyun Ah Jung等用乙醇对5种褐藻、4种红藻和1种绿藻进行提取,然后对粗提物进行ACE抑制效果测定,结果发现有4种褐藻和4种红藻(嫩杉藻)在163.93 μg/mL的浓度下抑制率超过50%,而且他们从1种褐藻(黑藻)提取物中分离出4种多酚,其中有3种对ACE的抑制效果很显著,分别是鹅掌菜酚、二鹅掌菜酚以及间苯二氯呋喃酮A(phlorofucofuroeckol A),其IC50分别是(70.82±0.25)、(34.25±3.56)、(12.74±0.15)μmol/L[39]。Byong-Gon Park等从马尾藻中分离出了(5E,10E)-14-羟基-2,6,10-三甲基十五烷基-5,10-二烯-4-酮和 sargachromenol D,其中sargachromenol D对内皮素-1(ET-1)诱导的基底动脉收缩显示有血管舒张作用,还可以作为L型Ca2+通道和内皮素A/B2受体的双重拮抗剂,可以作为新型高血压药物,特别是针对严重的II型糖尿病,盐敏感性和代谢性疾病诱发的高血压[40]。Wajp Wijesinghe等用乙醇、乙酸乙酯、氯仿、己烷、和乙醚作为溶剂对腔昆布进行物质提取,测定它们对ACE的抑制活性,结果表明乙醇提取物的抑制活性最强,其IC50为0.96 mg/mL,并从提取物中分离出5种对ACE具有抑制作用的多酚,其IC50分别是间苯三酚[(2.57±0.09)μmol/L]、三氯菊醇-A[(2.01±0.36)μmol/L]、鹅掌菜酚[(2.27±0.08)μmol/L]、二鹅掌菜酚[(1.47±0.04)μmol/L]及5,8,13,14-四氧杂-戊芬-1,3,6,9,11-酚[(2.95±0.28)μmol/L][22]。Seok-ChunKo等从铁钉菜(Ishige sinicola)中分离出八叶酚A(octaphlorethol A,OPA),发现 OPA 对 ACE 的 IC50值是59 μmol/L,可以使SHR的血压降低,而且在人内皮细胞中,OPA通过内皮细胞中蛋白激酶B(Akt)和AMP-蛋白激酶(AMPK)的激活使内皮一氧化氮合成酶(eNOS)磷酸化,促使NO含量增加,从而起到降低血压的作用,所以OPA可以作为高血压治疗剂开发[41]。此外,Seok-Chun Ko等研究发现了从腔昆布(Ecklonia cava)分离的6,6'-双酚的ACE抑制活性主要归因于ACE与6,6'-双酚之间的氢键和Pi相互作用,而且6,6'-双酚通过磷酸化人体内皮细胞中的一氧化氮合酶而使一氧化氮(NO)的含量显著增加[42]。Alex Olivares-Molina等用酶法(α-淀粉酶、纤维素酶)和浸渍法(丙酮)对淡黑巨海藻(幼苗和成苗)、巨型海带和南极海茸3种褐藻进行物质提取,评估提取物对ACE的抑制效果,结果表明提取方法会影响产物的提取率及其对ACE的抑制率,经α-淀粉酶处理的淡黑巨海藻幼苗的提取率最高,而且ACE抑制率最高为(95.61±0.33)%,经研究推测提取物中抑制ACE的主要成分为多糖和酚类[44]。同时,Yasantha Athukorala等测定了7种褐藻的酶解产物对ACE的抑制效果,结果显示虽然每种褐藻对ACE都有较好的抑制效果,但其中腔昆布的抑制活性最好,而且发现其活性成分主要集中在分子量>30 kDa的部分中,因为这部分的蛋白质含量和多酚含量最高,这就说明蛋白质和多酚组成的高分子复杂化合物对降血压有明显的效果[45]。而且,Lisete Paiva等将墨角藻的甲醇粗提物超滤得到分子量为<1 kDa、1 kDa~3 kDa和>3 kDa的 3种组分,其中>3 kDa组分对 ACE的抑制率最高,为(88.8±2.4)%,而且证明对ACE具有抑制作用的褐藻多酚也存在于该组分中,此外还发现如果将提取物在-80℃和-13℃保存15 d,对ACE的抑制率会分别下降28.8%和78.2%[46],所以提取物的储存条件与活性保持关系密切,要保存在合适的环境尽量避免抑制活性下降。
除了褐藻中的多肽多酚类物质外,氨基酸类也具有降压作用。任丹丹等对海带根部、中部、假根的提取液进行ACE抑制活性测定,其抑制率分别为66.7%、22.8%及80.7%,经分析表明在假根提取液中氨基酸含量最多,这可能是其对ACE抑制活性最高的一个原因[47]。褐藻氨酸通过降胆固醇、降血脂、抗血小板凝聚等作用来降低血压和防止血管粥样硬化[48],而牛磺酸通过抑制RAS系统、抑制交感神经的兴奋性、刺激KKS系统、舒张血管也能起到降低血压的作用[49]。安建强等观察褐藻氨酸对实验动物Wistar大鼠、犬和猫的降血压作用,认为其降血压作用较稳定,不产生快速耐受性[50]。臧东莲等研究了不同剂量的褐藻氨酸对肾性高血压大鼠的降血压作用,发现其对大鼠的降压作用随着剂量的增大和作用时间的延长而增强[51]。Hu等发现给予小鼠2%牛磺酸后,增加了血清一氧化氮含量和一氧化氮合酶水平,抑制了RAS系统,起到降低血压的作用[52]。
海藻多糖主要包含褐藻糖胶(岩藻聚糖硫酸酯)、褐藻胶以及褐藻淀粉,目前对褐藻多糖功效的研究主要集中在抗肿瘤、抗菌、降血糖、抗氧化等方面[53],但其对降血压也有一定的作用。张全斌指出给糖尿病小鼠服用昆布多糖可以对抗由糖尿病引起的心血管并发症,降低糖尿病小鼠的高血脂和高血压,并减轻内皮损伤程度[54]。同样,Wentong Cui等通过研究也发现褐藻糖胶对GKⅡ型糖尿病大鼠的血管内皮具有明显的保护作用,能剂量依赖性诱导内皮血管舒张、主动脉eNOS磷酸化、NO合成以及降低小鼠的基础血压,表明褐藻糖胶成为糖尿病并发症中保护血管内皮的潜在药物来源[55]。付雪艳等通过给肾血管性高血压大鼠喂食12.5、25、50 mg/kg剂量的岩藻聚糖硫酸酯低聚糖,发现其能降低肾血管高血压大鼠的血压,且在给药后5 min后血压达到平稳[56]。王亚芳等对羊栖菜褐藻多糖硫酸酯和日本厚叶海带、真海带、大连厚叶海带、裙带菜的褐藻多糖硫酸酯的降血脂作用进行了研究,结果表明这5种褐藻多糖硫酸酯可以降低患动脉粥样硬化的风险[57];廖敏也研究发现岩藻聚糖硫酸酯在抗血栓和抗凝血方面有很好的效果,而且能保护血管内皮细胞[58]。所以岩藻聚糖硫酸酯除了本身具有降血压的作用以外,还可通过其在降血脂、抗凝血、抗血栓等方面的功效一定程度上降低高血压的发生几率。
4 展望
近年来,因为高血压死亡的人越来越多,已然成为人类健康的一大杀手,而现有临床的降血压药剂都是化学合成的,长期服用会产生许多副作用,所以开发高效、安全无毒副作用的降血压药物和功能食品就具有重要意义。海藻这个种类繁多、容易获得、价格便宜、生长环境特殊的物种就成为其降血压活性的重要来源,为了充分利用海藻资源,继续筛选具有高效降血压活性的海藻种类及其活性物质,仍是将来的重点研究内容之一。目前对大型海藻降血压活性的研究主要是活性物质的提取、降血压活性测试和分子结构鉴定等,而对降血压机制和构效关系的研究很少,尤其是对不同降血压活性物质的研究就更少,随着基因组学、蛋白质组学和代谢组学等技术的发展,很有必要将这些技术运用到降血压机制和构效关系的研究中,进而为降血压海藻的开发利用提供科学依据。

