玉米液化清液发酵生产柠檬酸工艺研究
张鸿飞,秦郦,蒋水星,毕付提,刘玲,张建华,王德培,*
(1.工业发酵微生物教育部重点实验室,天津300457;2.省部共建食品营养与安全国家重点实验室,天津300457;3.天津科技大学生物工程学院,天津300457;4.山东日照金禾博源生化有限公司,山东日照276800)
柠檬酸是一种重要的有机酸,在食品工业、精细化工洗涤和化妆品行业,医药业[1-4]等市场需求大,并以每年3%~5%需求量递增。我国是柠檬酸生产大国,2017年产量达到152万吨,是全球重要的柠檬酸生产国和出口国。
目前柠檬酸发酵大都以玉米为原料,经过高温喷射液化,以带渣玉米液化液为培养基进行柠檬酸发酵生产。由于每批玉米营养成分存在很大差别,从而造成柠檬酸生产不稳定;此外,带渣玉米液化液黏稠溶氧较差,需加大通风压力,生产能耗大[5];由于玉米渣中存在大量不被发酵利用的固形物,影响发酵过程精细控制,也造成提取相对困难。因此,带渣玉米液化液发酵工艺亟待改变。以玉米清液进行柠檬酸发酵,有其独特的优点。玉米粉液化去渣后,液化液中脂肪、蛋白质含量低,发酵醪液黏度低利于溶氧,降低能耗缩短发酵周期,提高转化率;发酵液固形物少,滤液清,油脂少,有利于从柠檬酸发酵液中提取柠檬酸,提高回收率和产品质量;且液化后得到的滤渣可用于制备高品质的玉米蛋白饲料[6],增加企业经济收益。因此,进行柠檬酸清液发酵新型工艺研究,降低柠檬酸生产成本,具有重大意义。
本论文以营养成分相对稳定的玉米液化清液为原料,确定了柠檬酸生产的最佳生产条件,并进行中试生产,为大规模生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
黑曲霉(Aspergillus.niger)CGMCC1042:由天津科技大学微生物保藏中心保藏。
1.1.2 试剂
无水葡萄糖、酵母粉、琼脂粉、(NH4)2SO4、KH2PO4、MgSO4、CuSO4、ZnSO4、CaCl2、KCl、大豆蛋白胨 (分析纯):天津市北方天医试剂公司;FeSO4(分析纯):天津市四通化工厂;肌醇(分析纯):上海权旺生物科技有限公司;玉米浆(试剂级):金丰玉米有限公司;α-淀粉酶(40 000 U/mL):诺维信(中国)生物技术有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯削皮切块,称取200 g,加入适量蒸馏水煮沸30 min,4层纱布过滤除渣,取清液加蒸馏水定容至1 L,加入2%葡萄糖充分溶解,加入琼脂粉20 g,加热充分溶解分装斜面后,121℃,20 min灭菌。
玉米液化清液的制备:玉米粉与水以1∶4(g/mL)的比例混合,搅拌均匀后加热到70℃,加入耐高温的α-淀粉酶(0.5 kg/t),保温10 min后加热到90℃保温4 h~5 h,趁热经两层纱布过滤得糖化清液。过滤清液冷却后加水调整总糖到要求的浓度[7]。
种子基础培养基:总糖10%的玉米液化清液,0.25%(NH4)2SO4,0.15%KH2PO4,500 mL 三角瓶装液量 40 mL,121℃灭菌20 min。
发酵基础培养基:总糖17%的玉米液化清液,0.2%KH2PO4,0.15%(NH4)2SO4,0.025%MgSO4,500 mL三角瓶装液量50 mL,121℃灭菌20 min。
1.2 仪器与设备
OLYMPUS 719068光学显微镜:OLYMPUS公司;LDZX-50FB立式压力蒸汽灭菌锅、SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;FA2004N电子天平:上海精密科学仪器有限公司;DELTA320 pH计:梅特勒-托利多仪器(上海)有限公司;HZQ-QX恒温振荡器:中国哈尔滨市东联电子技术开发有限公司;WYT-J总糖计(0~32%):成都豪创光电仪器有限公司;HDL超净工作台:北京东联哈尔滨仪器制造有限公司;30 L发酵罐:上海高机生物工程有限公司。
1.3 方法
1.3.1 发酵培养基成分优化试验
1.3.1.1 发酵培养基有机氮源种类单因素试验
初糖浓度为17%的玉米液化清液添加0.15%(NH4)2SO4,在氮含量相同的前提下,以0.92%玉米浆、0.5%大豆蛋白胨、0.65%酵母粉、0.6%饲料蛋白作为有机氮源分别加入发酵培养基中。按10%接种量,330 r/min,36.5℃,摇床培养72 h,每组做两个平行试验,以最终产酸量及菌丝球形态为因变量,得出最佳的有机氮源并优化其添加量。
1.3.1.2 发酵培养基添加玉米浆单因素试验
以初始发酵培养基为基础,在玉米液化清液中添加 0.1%、0.3%、0.5%、0.7%、0.9%、1.0%、1.2%、1.4%的玉米浆,另外添加0.15%(NH4)2SO4。按10%接种量,330 r/min,36.5℃,摇床培养72 h,每组做两个平行试验,测定最后的产酸量,确定玉米浆最终添加量。
1.3.1.3 发酵培养基添加(NH4)2SO4单因素试验
糖浓度为17%的玉米液化清液,分别添加0.06%、0.08%、0.10%、0.12%、0.14%、0.16%、0.18%、0.20%(NH4)2SO4。按 10%接种量,330 r/min,36.5℃,摇床培养72 h,每组做两个平行,以最终产酸量为因变量,得出最佳的(NH4)2SO4添加量。
1.3.1.4 发酵培养基添加肌醇单因素试验
糖浓度为17%的玉米液化清液,分别添加肌醇终浓度0、0.001%、0.003%、0.005%、0.007%、0.009%。按10%接种量,330 r/min,36.5℃,摇床培养 72 h,每组做两个平行,以最终产酸量及菌丝球形态为因变量,得出最佳的肌醇添加量。
1.3.1.5 发酵培养添加不同金属离子正交试验
对发酵培养基中 MgSO4、CuSO4、ZnSO4、CaCl2、KCl、FeSO46种金属元素进行L27(36)正交试验。按10%接种量,330 r/min,36.5℃,摇床培养72 h,每组做两个平行,以最终产酸量为因变量,通过方差分析以确定6种金属元素的最佳配比。正交试验因素及水平表见表1,正交试验因素的水平由单因素试验确定。

表1 正交试验设计各因素及水平Table 1 Levels of factors used in the orthogonal experimental design
1.3.2 玉米清液最佳发酵条件试验
1.3.2.1 初糖含量对柠檬酸产量的影响
调整玉米液化清液初糖浓度分别为16%、17%、18%、19%、20%,按10%的接种量,控制发酵温度36.5℃,搅拌转速 400r/min,通风 400L/h,罐压 0.1 MPa,进行发酵。发酵开始每隔8小时分别从各个不同初糖浓度的发酵罐中取样,测定柠檬酸产量和发酵液pH值,放罐后进行菌丝体净重测量,记录净重变化,以及残还原糖测定。
1.3.2.2 种龄对柠檬酸产量的影响
选取培养 18、20、24、27 h 的种子液进行试验,接种量为10%,测定最终柠檬酸产量,放罐后进行菌丝体净重测量,记录净重变化以及残还原糖测定。
1.3.2.3 溶氧对柠檬酸产量的影响
采用30 L全自动通风机械搅拌发酵罐进行发酵,调整发酵液初始糖浓度18%,调节初始pH 3.5。通风量调整如下:
方案A分三段控制通气量:0~16 h:300 L/h,转速300 r/min;17 h~48 h:450 L/h,转速 450 r/min~500 r/min;49 h~58 h:350 L/h,转速 300 r/min。
方案B发酵全程大通风量:0~60 h:450 L/h,转速450 r/min~500 r/min;61 h~64 h:350 L/h,转速 300 r/min。
1.3.2.4 柠檬酸产量的测定
取1mL发酵上清液于250mL三角瓶中,添加1滴~2滴酚酞做指示剂,用浓度为c的NaOH标准溶液滴定至淡粉色,30 s后不褪色[85],读取消耗NaOH标准溶的体积为V,则柠檬酸产量计算公式为:

式中:Y为柠檬酸产量,以一水柠檬酸计量,g/100 mL;c为NaOH标准溶液物质的量浓度,mol/L;V为NaOH标准溶液消耗体积,mL;0.142 9为滴定系数。
1.3.2.5 还原糖的测定
本试验采用费林试剂热滴定法,费林试剂由甲、乙两种溶液组成,滴定时以亚甲基蓝为指示剂。
1)空白滴定
准确吸取费林试剂甲液和乙液各5 mL于250 mL锥形瓶中,滴加约19 mL葡萄糖标准溶液,加热使其在2 min内沸腾,准确沸腾30 s,趁热以每2秒1滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去为终点。记录消耗葡萄糖标准溶液的总体积。平行操作3次,取其平均值V1。
2)发酵液还原糖的测定
样品溶液测定:取费林试剂甲液、乙液各5 mL,置于250 mL锥形瓶中,用移液管吸取经适当稀释后发酵滤液0.1 mL置于锥形瓶中,加入2滴次甲基蓝指示剂,从滴定管中加入比与测试样品溶液消耗的总体积少1 mL的样品溶液,加热使其在2 min内沸腾,准确沸腾30 s,趁热以先快后慢的速度从滴定管中滴加样品溶液,滴定时要保持溶液呈沸腾状态。待溶液由蓝色变浅时,以每2秒1滴的速度滴定,直至溶液的蓝色刚好褪去为终点。记录样品溶液消耗的体积,平行操作3次,取其平均值V2,计算公式为:

式中:V为标定时平均消耗还原糖样品溶液的总体积,mL;N为还原糖样品溶液的稀释倍数;1 000为mg换算成g的系数。
1.3.2.6 产酸率的测定

式中:产酸率为柠檬酸生产速率,g/(100 mL·h);Y为柠檬酸产量以一水柠檬酸计量,g/100 mL;t为发酵时间,h。
2 结果与分析
2.1 有机氮源对柠檬酸清液发酵的影响
2.1.1 不同有机氮源种类的选择
不同有机氮源[8]对黑曲霉柠檬酸发酵,菌丝球形态,糖酸转化率等具有显著的影响,结果如图1、图2所示。

图1 不同有机氮源对柠檬酸产量的影响Fig.1 The influence of different types of organic nitrogen sources on the production of citric acid

图2 添加不同有机氮源发酵液菌丝球形态Fig.2 The mycelium pellet morphology after adding different organic nitrogen sources
由图1可知,4种氮源对于产酸量的影响先后顺序为玉米浆>大豆蛋白胨>蛋白饲料>酵母粉,添加玉米浆时产酸量最高可达9.27 g/100 mL,糖酸转化率均高于其它氮源,并且残还原糖相对较少,大豆蛋白胨次之,添加玉米浆和大豆蛋白胨发酵性能优于添加其他有机氮源。由图2可知,添加玉米浆和大豆蛋白胨时的菌丝球形态较好,菌丝球大小较为均一,菌丝扩散较少;添加酵母粉时的菌丝球形态不规则,且菌球直径偏大;添加饲料蛋白时的菌丝球直径一致性差,且菌丝扩散较多。综合以上产酸量、转化率、残还原糖以及菌球形态考虑,4种有机氮源中,玉米浆与大豆蛋白胨发酵性能最好,但从生产成本问题考虑,最终选取玉米浆为柠檬酸玉米清液发酵最适有机氮源。
2.1.2 玉米浆加入量的确定
2.1.1试验确定玉米浆为最佳有机氮源,玉米浆的浓度是关系柠檬酸是否能够高效发酵的重要因素之一,通过测定最后的产酸量以及糖酸转化率,确定玉米浆最适浓度。结果如图3所示。
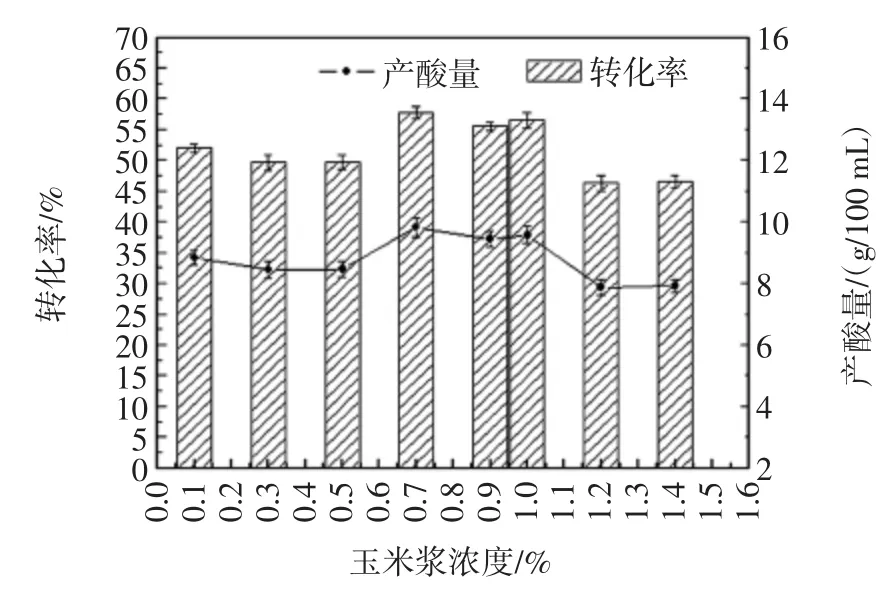
图3 不同玉米浆含量对柠檬酸产量的影响Fig.3 The influence of different corn syrup content on the production of citric acid
由图3可知,当玉米浆浓度为0.7%时黑曲霉产酸量及糖酸转化率均最高,继续增加玉米浆产酸量不再增加。综合比较产酸量和转化率指标,选取0.7%玉米浆作为发酵培养基的最佳有机氮源添加量。
2.2 不同浓度(NH4)2SO4对柠檬酸清液发酵的影响
研究表明[9],在柠檬酸发酵过程中,添加一定量的(NH4)2SO4对柠檬酸产量有较明显的提高。在发酵培养基中添加0.7%玉米浆后加不同终浓度的(NH4)2SO4,通过测定最后的产酸量和糖酸转化率,从而确定玉米液化清液发酵培养基中(NH4)2SO4的最适浓度,结果如图4。

图4 不同(NH4)2SO4含量对柠檬酸产量的影响Fig.4 The influence of different(NH4)2SO4concentration on the production of citric acid
由图4可知,发酵液中(NH4)2SO4的总浓度0.1%时,产酸量及糖酸转化率均为最高。在添加其他浓度的(NH4)2SO4时,产酸量及糖酸转化率均不理想,所以选择0.1%作为(NH4)2SO4的最适总浓度。
2.3 不同浓度肌醇对柠檬酸清液发酵的影响
在发酵培养基中添加不同浓度的肌醇[10],最终测定最后的产酸量并观察菌丝球形态从而确定清液发酵培养基中肌醇的最适添加量,结果如图5、图6。
由图5可知,从产酸量以及糖酸转化率方面看,添加一定量的肌醇对提高产酸量有明显作用,添加一定量肌醇的发酵产酸量均高于未添加肌醇的发酵产酸量,其中添加总浓度0.007%的肌醇时产酸量以及糖酸转化率最高。从发酵完成后镜检图6可知,未添加肌醇的菌丝球菌丝扩散,菌丝球不致密,当添加0.007%肌醇时,可明显看出菌球缠绕的很紧密,向外伸展的菌丝较少,菌丝球形态规整,继续增加肌醇浓度时,产酸量不再增加且菌丝球一致性下降,菌丝扩散较多。综合以上因素考虑选取0.007%的肌醇为最优浓度。

图5 不同肌醇含量对柠檬酸产量的影响Fig.5 The influence of different inositol content on the production of citric acid
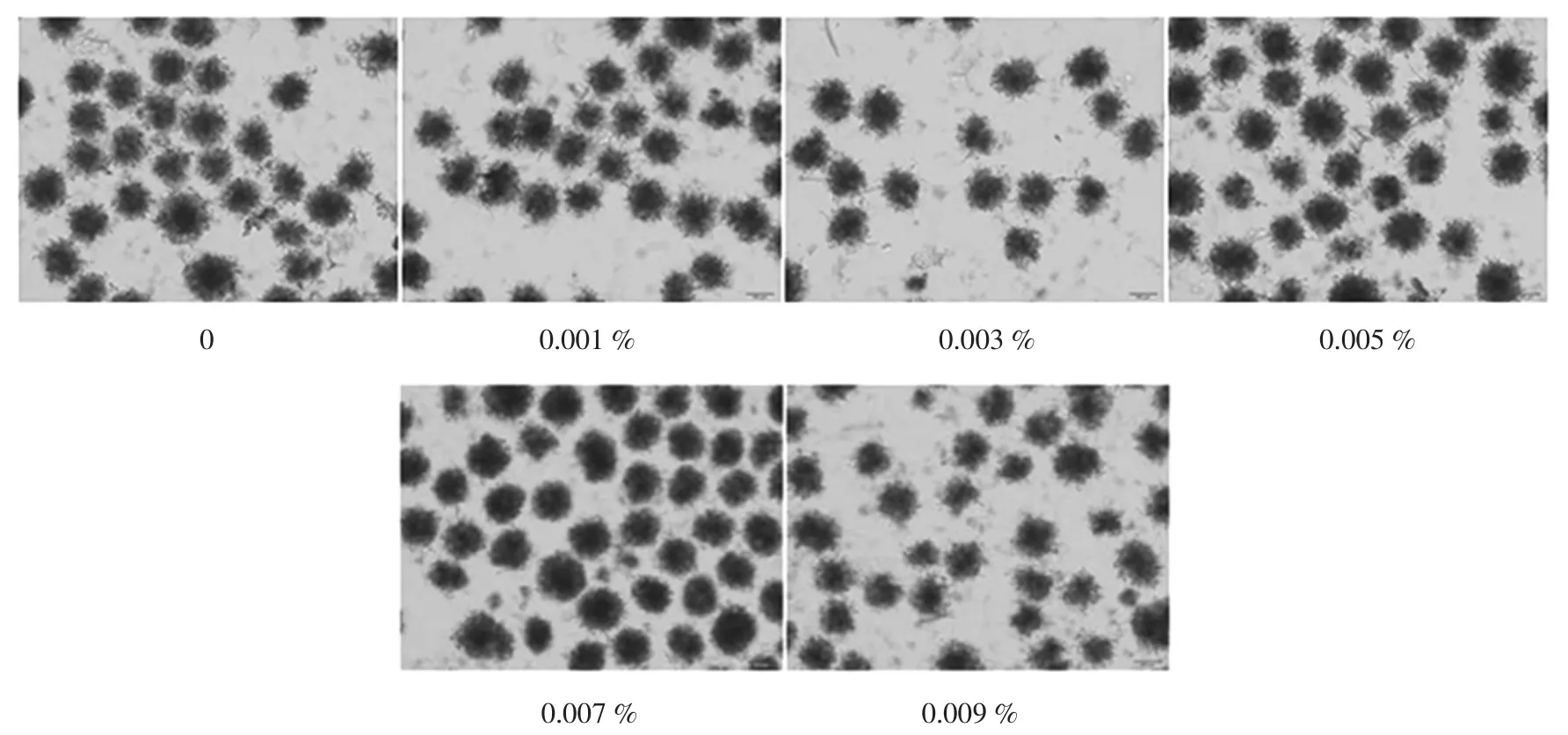
图6 添加不同浓度肌醇发酵液菌丝球形态Fig.6 The mycelium pellet morphology after adding different content of inositol

表2 正交试验结果Table 2 Results of orthogonal experiment
2.4 6种金属离子的浓度正交试验及验证
选取 MgSO4、CuSO4、ZnSO4、CaCl2、KCl、FeSO4[11-12]多种浓度进行正交试验,正交试验结果见表2,方差分析见表3。
由表 2 可知,MgSO4、CuSO4、ZnSO4、CaCl2、KCl、FeSO4这6个因素的不同水平中,通过极差分析可知,影响因子的主次顺序为:CaCl2>MgSO4>KCl>FeSO4>ZnSO4>CuSO4,最优组合为 A1B1C1D1E1F3,优化后的最优浓度:MgSO40.1 g/L,CuSO40.8 mg/L,ZnSO40.02 g/L,CaCl22.0 g/L,KCl 0.1 g/L,FeSO40.34 mg/L。
在最优浓度培养条件下,对优化结果进行验证试验,500 mL三角瓶装液量 50 mL,36.5℃,330 r/min进行柠檬酸发酵72 h。验证结果产酸量为9.96 g/100 mL,高于正交试验中任何一组产酸量,验证了最佳组合的优势效应。
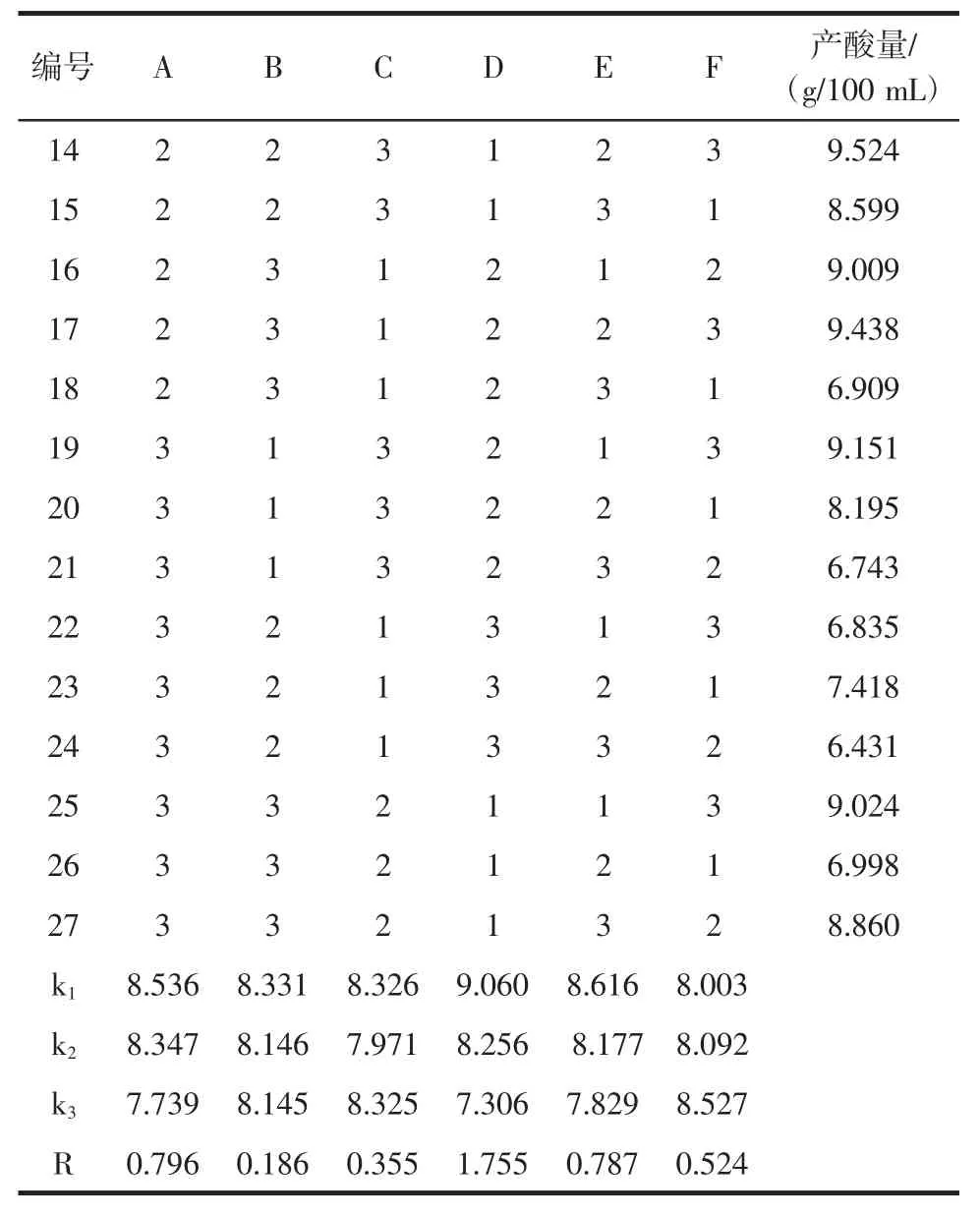
续表2 正交试验结果Continue table 2 Results of orthogonal experiment

表3 正交试验方差分析Table 3 Variance analysis of orthogonal test
2.5 玉米液化清液最佳发酵条件
2.5.1 不同初糖浓度对柠檬酸清液发酵的影响
选取不同初糖浓度玉米液化清液发酵进行发酵后,测定柠檬酸产量,残还原糖及固形物含量,结果见表4。
由表4可知,当初糖浓度为18%时发酵结束时产酸量最高,糖酸转化率最高,且残还原糖浓度处于较低水平。由放罐后固形物含量可知,当初糖浓度18%以上时,固形物含量明显升高,考虑到发酵液固形物含量对下游提取的影响,综合以上因素,最终选取18%初糖浓度进行下一步研究。
2.5.2 种龄对柠檬酸清液发酵的影响
接种不同种龄的种子液进行发酵试验,测定最终柠檬酸产量,残还原糖并记录相应发酵周期,结果见表5。

表4 发酵结束柠檬酸产量Table 4 The production of citric acid at the end of fermentation

表5 种龄对柠檬酸发酵的影响Table 5 The effect of different inoculation time on citric acid fermentation
由表5可知,随着种龄的增大,柠檬酸酸产量逐渐增大,其中菌龄27 h时产酸量最高,因此选择种龄27 h为黑曲霉菌种最佳移种时间。
2.5.3 不同工艺控制对柠檬酸清液发酵的影响
不同工艺控制,使发酵过程发酵液中溶氧浓度差异较大,而溶氧浓度[13-17]对柠檬酸发酵有极大的影响。从发酵开始每隔8小时取样,测定发酵液中柠檬酸浓度、pH值的变化情况,每隔1小时记录溶氧。结果如图7、图8所示。

图7 不同工艺发酵柠檬酸溶氧曲线Fig.7 Different process fermentation citric acid dissolved oxygen curve

图8 不同工艺对8 h柠檬酸积累的影响Fig.8 The influence of different processes on accumulation of citric acid for 8 hours
由图7可知,0~16 h时,大通风量溶氧优于分段通风;16 h~64 h时,方案A溶氧高于方案B。结合图8来看,方案B中,发酵前期溶氧过高,易引起菌体增殖过剩,导致黑曲霉过早进入柠檬酸累积期,pH值下降过快。低pH值会影响糖化酶活性,进而影响原料的利用率,使发酵液残还原糖含量过高,故发酵后期方案B产酸量不如方案A。最终选取方案A三段式通风量进行下一步研究。
分段通风对柠檬酸发酵的影响见图9。
由图9可知,在发酵前期(0~16 h)控制通风量为300 L/h,菌体大量增殖,代谢正常,发酵液pH值为3.5,该pH值有利于保持发酵液糖化酶活力,使还原糖含量上升,发酵16 h之后黑曲霉进入快速产酸量期,17 h~48 h通风量调整为450 L/h,转速450 r/min~500 r/min,此时黑曲霉菌丝球代谢更加旺盛,更多的还原糖转化为柠檬酸,此时还原糖含量开始大幅度下降,产酸量开始大量增加;48 h以后接近发酵结束,49 h~58 h通风量调整为:通风350 L/h,转速300 r/min,此时还原糖处于较低水平,溶氧较高,pH值相对稳定,可降低通风和转速。在58 h发酵结束时,柠檬酸产量为18.33 g/100 mL,糖酸转化率为101.8%,残还原糖量为0.5%。而相同发酵工艺玉米带渣发酵液发酵水平17.5 g/100 mL,转化率99.5%,此清液发酵水平已高于带渣发酵产量水平。

图9 分段通风对柠檬酸发酵的影响Fig.9 The effect of segmented ventilation on citric acid fermentation
3 结论
本研究对玉米液化清液发酵生产柠檬酸的发酵培养基及培养条件进行优化,通过对氮源,营养因子,金属离子的多次单因素试验及正交试验,最终确定发酵培养基成分为:玉米清液糖浓度为18%,玉米浆0.7%,(NH4)2SO41.0 g/L,MgSO40.1 g/L,CuSO40.8 mg/L,ZnSO40.02 g/L,CaCl22.0 g/L,KCl 0.1 g/L,FeSO40.34 mg/L,肌醇0.007%。在种龄27h,分段通风转速控制的发酵条件下,发酵周期为60 h,柠檬酸产量达到18.33 g/100 mL,糖酸转化率为101.8%,残还原糖量为0.5%,而相同发酵工艺玉米带渣发酵液发酵水平17.5 g/100 mL,转化率99.5%,由此,玉米清液发酵有望成为柠檬酸新型发酵方式。

