基于CO2传输阻力解析的土壤水分调控番茄光合生理机制
张大龙 柳玉平 李 洋 冯改利 李清明 魏 珉
(1.山东农业大学园艺科学与工程学院, 泰安 271018; 2.农业农村部黄淮海设施农业工程科学观测实验站, 泰安 271018;3.山东蓝奥生物技术有限公司, 济南 250001)
0 引言
灌溉制度是作物生理生态、作物栽培和农田水利等学科的重要研究内容,通过优化灌溉频率、灌水时间和灌溉定额可以挖掘作物生产潜力,提高水资源利用效率[1]。光合作用是作物生长的基本驱动力,土壤水分与植物个体及组织细胞的水分平衡密切相关,决定叶片解剖结构和保卫细胞行为,进而决定CO2的吸收、运输与同化进程。因此,解析土壤水分调控光合作用的机理是优化灌溉设计和高效栽培的理论基础。在植物光合作用过程中,底物CO2首先从外界大气扩散到叶片表层,然后穿过气孔到达气孔下腔,克服叶肉阻力到达叶绿体羧化位点,由羧化酶进行同化。每克服一个阻力,细胞内的CO2浓度都会相应降低[2]。番茄是重要的蔬菜作物,设施及露地栽培广泛。番茄为C3植物,CO2传输阻力较大,其叶绿体内有效CO2浓度显著低于胞间,远远不能满足叶绿体内羧化反应的需求,是提高光合CO2同化能力和挖掘产量潜力的重要限制因子[3]。
CO2需要克服阻力从大气传输到羧化位点,构成“源-流-库”模式[4]。气孔仅为CO2由大气传输至叶绿体羧化位点的第一步。早期的光合作用研究中,由气孔传输至叶绿体羧化位点的叶肉阻力对光合作用的限制一般忽略不计。基于作物生命需水信息的亏缺灌溉、分根交替灌溉等节水理论与技术不断发展,在大田作物与设施栽培中得到广泛应用,但传统节水理论仍以气孔作为光合CO2吸收传输唯一限速节点[5-6]。大量研究集中于以气孔功能为契点,从水分动力传输和水分平衡角度解析了气孔保卫细胞响应土壤水分的前馈和反馈调节机制,揭示土壤水分调控番茄光合CO2吸收的第一道“门户”的机制,为全面定量解析CO2传输“源-流-库”的阻力构成及分布奠定了基础,但对CO2传输过程缺乏系统和全面认知。随着碳同位素测量和荧光技术的发展,叶肉阻力已被证明是CO2传输总阻力的重要组成部分,是除气孔阻力和羧化反应之外的第3个光合效率限制因素,叶肉阻力与气孔阻力相当甚至要大于气孔阻力,是光合CO2传输同化的重要限制因子[7-10]。气孔限制和非气孔限制已经很难精准描述土壤水分调控番茄光合CO2吸收同化机理,而需要从气孔阻力、叶肉阻力和羧化反应限制3个限制因素解析,但相关研究鲜见报道。不同土壤水分梯度下番茄光合CO2吸收与传输的阻力分布、关键限速位点和调控机制仍不清晰。
本研究基于叶绿素荧光、气体交换和响应曲线相结合的方法,解析不同土壤水分梯度下番茄光合CO2传输的各支段阻力及权重,量化各支段阻力抑制光合CO2吸收的相对贡献率,基于“源-流-库”总路径阐明土壤水分胁迫限制番茄CO2传输与供应的关键步骤及位点。
1 材料与方法
1.1 试验区概况
试验于2018年5—7月在山东农业大学园艺试验站进行(北纬36°09′,东经117°09′,海拔126 m)。该试验区属黄淮海平原,温带大陆性湿润季风气候区。全年平均气温12.9℃,平均日照时数2 627.1 h,平均降水量697 mm。选用番茄品种为圣罗兰,于四叶一心期定植到塑料盆内(高40 cm,直径30 cm)。栽培基质由菜园土与有机肥按照2∶1(体积比)配制而成,每盆装基质10 kg。基质容重为1.37 g/cm3,田间持水率为25.8%(质量分数)。盆内表面用地膜覆盖防止土面蒸发。根据水量平衡原理和称量法[11]将土壤相对含水率控制到40%、50%、60%、70%、80%和90% 6个水平。试验于日光温室内进行,长度43 m,跨度10 m,全镀锌钢管桁架结构。
1.2 原理
CO2“源-流-库”传输模式及阻力分布如图1所示。图中,Ca、Cb、Ci、Cc分别表示大气、叶面、胞间和羧化基的CO2浓度,rb、rs、rm分别表示边界层、气孔和叶肉阻力。CO2在不同位点分压梯度的驱动下,由高分压位点克服阻抗向低分压位点扩散。根据物理学中表征流体及物质扩散的一般法则,阻力(R)为分压差ΔP与通量的比值。

图1 叶片CO2“源-流-库”扩散过程梯度驱动力及阻力分布Fig.1 Distribution of driving force and resistance for CO2transport through “source-path-sink”
1.3 气孔CO2传输导度及光合参数测量
根据叶绿素荧光、气体交换和响应曲线拟合相结合的方法测定并估算不同水分梯度下“源-流-库”的CO2分压梯度,根据气体扩散定律计算气孔和叶肉导度。在环境控制良好的室内测定,环境温度设30℃,相对湿度70%,光强1 000 μmol/(m2·s),CO2浓度400 μmol/mol。光合气体交换及叶绿素荧光采用Li-Cor6400XT型光合作用测量系统所配置的叶室测定。CO2初始浓度设为400 μmol/mol。待系统稳定后,调用自动程序测定荧光Pn/Ci曲线。测定过程中CO2浓度依次设定为400、300、200、150、50、400、600、800、1 000、1 500 μmol/mol。叶绿素荧光测定设定为多闪饱和脉冲模式。待测定完成后,将系统接入低氧环境,并将光强调成2 000 μmol/(m2·s),测定低氧光合荧光响应曲线以校正电子传递效率。气孔对CO2的传输导度(gsc)根据气体交换测量的对水汽传输的气孔导度(gsH2O)进行换算,由于H2O在空气中的传播能力为CO2的1.6倍,gsc=gsH2O/1.6[12]。最大羧化速率Vc,max以及最大电子传递速率Jmax根据CO2响应曲线及FvCB模型进行估算[13],羧化效率CE为初始阶段CO2浓度小于200 μmol/mol时曲线的斜率[14]。
1.4 叶肉CO2传输导度计算
根据气体扩散定律,叶肉导度gm可以由光合CO2同化速率(Pn)与胞间至叶绿体内CO2分压梯度(Ci-Cc)计算[15],即
(1)
胞间CO2浓度Ci和净光合速率Pn由气体交换测得,由于CO2同化的能量可以通过电子传递速率进行量化,从而可以反推得到Rubisco酶(1,5-二磷酸核酮糖羧化酶)羧化反应底物叶绿体内CO2浓度
(2)
其中
J=ΦPSⅡPαβ
(3)
式中J——电子传递速率
Rd——光照下线粒体呼吸速率(光照下暗呼吸速率)
Γ*——无线粒体呼吸时叶绿体CO2补偿点
P——光合光量子通量密度
α——叶片对光量子的吸收效率
β——光量子在光系统间的分配比例
ΦPSⅡ——光系统Ⅱ的光量子效率

Fs——稳态荧光值

1.5 阻力权重和光合限速分析
类比电流,CO2通过气孔传输至羧化位点“源-流-库”动力传输路径为串联电路,因此总传输阻力(1/gtot)可计算为气孔阻力(1/gsc)与叶肉阻力(1/gm)之和:1/gtot=1/gsc+1/gm。因此,CO2总传输导度可计算为
(4)
依据光合经典理论,将光合限速步骤划分为气孔限制(Ls)、叶肉限制(Lm)和羧化反应限制(Lb),可通过权重分析确定关键限速位点和步骤[16]为
(5)
∂A/∂Cc根据光合速率-叶绿体内CO2浓度响应曲线(Pn-Cc,Cc=4×10-5~1.1×10-4)的斜率进行估算[17]。
2 结果分析
2.1 土壤水分对光合参数的影响及模拟
番茄光合参数对土壤水分的响应呈现相似趋势:光合速率(Pn)、最大羧化速率(Vc,max)、最大电子传递速率(Jmax)及初始羧化效率(CE)在土壤水分充足时达到最大值,在土壤相对含水率80%~90%范围内波动较为平缓,随着土壤水分胁迫的增大,光合参数迅速下降,在重度土壤水分胁迫状况下(40%~50%),光合参数最小,且变化趋势趋于平稳(图2)。光合参数随土壤水分变化整体呈现出“S”形变化曲线,初期缓慢增长,中期迅速增长,末期达到最大值并趋于稳定,可用logistic模型模拟为
(6)
式中a——增长极限,表征土壤水分充足时光合的极限速率
b——截距系数,为基础状态参数
c——增长率系数,表征系统状态趋近于顶级的速度
模型均通过显著性检验,光合速率(Pn)、最大羧化速率(Vc,max)、最大电子传递速率(Jmax)及初始羧化效率(CE)的模型参数如表1所示。

图2 土壤水分对光合速率(Pn)、最大羧化速率(Vc,max)、最大电子传递速率(Jmax)及初始羧化效率(CE)的影响Fig.2 Effect of soil moisture on photosynthesis rate(Pn), rubisco carboxylation capacity (Vc,max), maximum electron transport capacity (Jmax) and carboxylation efficiency (CE)
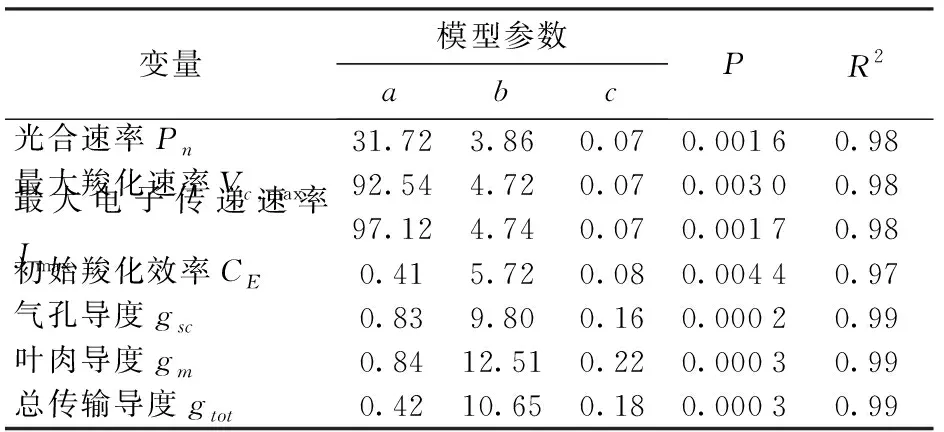
变量模型参数abcPR2光合速率Pn31.723.860.070.00160.98最大羧化速率Vc,max92.544.720.070.00300.98最大电子传递速率Jmax97.124.740.070.00170.98初始羧化效率CE0.415.720.080.00440.97气孔导度gsc0.839.800.160.00020.99叶肉导度gm0.8412.510.220.00030.99总传输导度gtot0.4210.650.180.00030.99
2.2 土壤水分对CO2传输导度的影响及模拟
气孔、叶肉对CO2的传输导度及总传输导度与光合参数的响应规律相似,随土壤水分变化均呈现明显的“S”形变化曲线(图3),气孔导度、叶肉导度及总CO2传输导度随水分胁迫加重而逐渐减小,这种下降趋势在土壤相对含水率由70%降到50%时表现最为明显;当土壤水分饱和时,气孔和叶肉对CO2的传输导度为最大值,且趋于稳定。

图3 土壤水分对气孔导度(gsc)、叶肉导度(gm)及总CO2传输导度(gtot)的影响Fig.3 Effect of soil moisture on stomatal conductance (gsc), mesophyll conductance (gm) and total conductance (gtot) for CO2 transport

图4 气孔阻力、叶肉阻力和羧化反应限速光合速率的相对贡献率随土壤水分的变化趋势Fig.4 Effect of soil moisture on proportion of stomatal limitation, mesophyll limitation and biochemical limitation on photosynthesis
2.3 光合限速步骤解析
在番茄光合CO2吸收与传输过程中,各支段阻力及限速光合速率的权重与土壤水分状态密切相关。如图4所示,气孔阻力与叶肉阻力对光合速率限制的相对贡献率变化趋势相似,随着水分胁迫的加重,其贡献率逐渐增大,可以用指数函数模拟(Ls=0.871 8e-0.02x,P<0.01;Lm=0.791e-0.021x,P<0.01)。羧化反应对光合速率限制的相对贡献率与气孔和叶肉导度相反,随着水分胁迫的加重,其贡献率逐渐减小,可以用对数函数模拟(Lb=0.698 7lnx-2.378 8,P<0.01)。因此,在土壤水分充足时,羧化反应限速光合的相对贡献率最大,是光合速率的关键限制因子;在水分胁迫状况下,气孔阻力和叶肉阻力对光合速率的限制作用占主导地位,羧化反应的相对贡献率较低。
2.4 气孔与叶肉阻力的影响因素
气孔由保卫细胞构成,叶片水分状况通过调控膨压决定气孔开放程度,进而决定CO2传输阻力。本研究中,气孔对CO2的传输导度与叶水势呈正相关,随叶水势的下降,气孔导度也呈线性下降趋势 (图5a)。叶水势与土壤含水率关系密切,叶水势随着土壤含水率的下降而下降;气孔开度受植物水分状况影响,与叶水势变化趋势一致,随水分胁迫加重,气孔开度逐渐变小(图5b),是导致气孔CO2传输导度下降的重要原因。比叶重是叶片重要经济性状,在本研究中与叶肉导度密切相关,是土壤水分影响叶肉导度的重要途径。叶肉导度与比叶重呈线性负相关关系,叶肉导度随比叶重的增大而线性减小(图6a);比叶重随土壤水分胁迫程度的加剧而逐渐增大(图6b)。
3 讨论

图5 叶水势与气孔导度的关系及对土壤水分的响应Fig.5 Response of leaf water potential to soil moisture and relationship with stomatal conductance

图6 比叶重对土壤水分的响应及与叶肉导度的关系Fig.6 Response of leaf mass area to soil moisture and relationship with mesophyll conductance
基于气体扩散理论全面解析CO2“源-流-库”传输总路径阻力构成及各支段阻力权重,量化了气孔限制、叶肉限制和羧化反应限制的相对贡献率,揭示了不同土壤水分梯度下番茄光合CO2传输的关键限速位点,突破了设施栽培研究中将气孔作为光合CO2吸收传输唯一限速节点的局限性,拓展并丰富了光合理论,对番茄节水高效栽培具有重要意义。本研究表明,除气孔行为以外,叶肉阻力对番茄叶绿体内光合底物CO2的供应同样有重要影响;气孔、叶肉和羧化反应对光合限速的相对贡献率在不同水分状况下亦有所不同。在土壤水分胁迫状况下,气孔和叶肉阻力限制是光合的关键限制因子,而且其相对贡献率随土壤水分胁迫的加剧而增大,叶绿体基质的羧化反应限制对光合的抑制作用较小。在土壤水分充足时,气孔和叶肉阻力限制对光合速率的抑制作用较小,羧化反应限制则成为光合抑制的主导因子。
气孔控制水流和CO2流,与溶质流和能量流以及营养物质循环有着密切联系。气孔运动受植物生理和环境要素变化的共同影响,气孔的调控存在两个机理,即保卫细胞膨压的前馈和反馈调节[18]。气孔能对环境波动迅速响应,进而调控CO2的吸收阻力,气孔运动的直接原因是保卫细胞的膨压变化,当保卫细胞膨压增大时,保卫细胞膨胀,气孔开度增大,气孔对CO2吸收传输的导度亦随之增大[19]。在土壤水分胁迫状况下,根系吸水与供水能力不足,叶片水势和细胞膨压低,气孔关闭,气孔对CO2的传输导度低,因此,土壤水分胁迫情况下,气孔限制对光合抑制的相对贡献率较大。随着土壤含水率增加,胁迫逐渐缓解,叶片水势和膨压逐渐升高,气孔开度增大,气孔对CO2的传输导度亦随之增大,气孔限制对光合抑制的相对贡献率较小,此时叶绿体内CO2浓度较高,光合速率主要受叶绿体基质的羧化反应限制。
CO2由气孔下腔传输至叶绿体羧化位点的过程,虽然路径较短,但叶肉阻力对光合抑制的相对贡献率较大,对CO2吸收传输具有重要调控作用。叶肉导度的变化及相对贡献率与气孔相似,均呈“S”形变化曲线,在土壤水分亏缺时,叶肉导度较小,CO2传输阻力大,对光合抑制的相对贡献率较大,是光合速率提高的限制因子。当土壤水分充足时,叶肉导度大,对CO2传输的限制作用较小。与气孔迅速响应环境变化的膨压调控机制不同,叶片解剖结构是影响叶肉导度的重要因子[20]。在结构层面上影响叶肉导度的依次是叶片厚度、叶肉细胞孔隙度、细胞壁厚度、细胞膜通透性等[21]。叶片厚度增加是植物适应干旱胁迫的响应机制之一,可以有效防止过度水分散失[22]。比叶重是表征叶片厚度的重要指标,比叶重较大的叶片可能具有较多细胞或单个细胞具有较大生物量,叶片较厚,细胞组织间隙较为紧密,不利于水分散失[23]。虽然比叶重可以保持水分抵御干旱胁迫,但CO2吸收传输的阻力相应增大,叶肉对CO2的传输导度降低。因此,在本研究中,水分亏缺时,叶片比叶重大,叶片厚度大,CO2吸收传输阻力大,对光合速率的抑制作用明显。随着土壤含水率的增大,叶片比叶重降低,叶面积大而薄,叶肉组织分化程度低,气腔和通气组织发达,叶肉组织间隙疏松。CO2在叶肉组织中的传输阻力较小,因而在水分充足时对光合速率的限制作用较小。CO2以被动运输方式跨越细胞膜和叶绿体膜,水通道蛋白在CO2跨膜运输过程中显得尤为重要[24-25]。目前已发现,水通道蛋白能够促进跨膜快速CO2传输,主要由质膜水通道蛋白PIP1s小家族负责,其表达量与叶肉阻力和光合速率密切相关[25-26]。解析质膜通道蛋白在不同水分梯度下的活性以及对叶肉导度的调控机理仍需深入探讨,将是本研究的下一步工作。
4 结论
(1)番茄光合速率(Pn)、最大羧化速率(Vc,max)、最大电子传递速率(Jmax)及初始羧化效率(CE)随土壤含水率变化呈“S”形变化曲线,初期缓慢增长,中期迅速增长,末期达到最大值并趋于稳定,可用logistic函数模拟。
(2)气孔、叶肉对CO2的传输导度及总传输导度随土壤含水率变化均呈明显的“S”形变化曲线,气孔导度、叶肉导度及总CO2传输导度在土壤水分充足时趋于稳定并达到最大值;随着土壤水分胁迫的加重,各支段导度及总CO2传输导度逐渐降低,并在重度土壤水分胁迫状况下达到最低,可用logistic函数模拟。
(3)气孔导度与叶肉导度对光合速率限制的相对贡献率变化趋势相似,随着水分胁迫的加重,其贡献率逐渐增大,可以用指数函数模拟;羧化反应对光合速率限制的相对贡献率与气孔和叶肉导度相反,随着水分胁迫的增大,其贡献率逐渐减小,可以用对数函数模拟;在土壤水分充足时,叶绿体内CO2浓度充足,羧化反应限速光合速率的相对贡献率最大,是关键限制因子;在水分胁迫状况下,气孔限制和叶肉限制占主导地位,羧化反应的相对贡献率较低。
(4)气孔对CO2的传输导度与叶水势呈正相关,随叶水势的下降,气孔导度也呈线性下降趋势;叶肉导度与比叶重呈线性负相关关系,叶肉导度随比叶重的增大而线性减小,比叶重随土壤水分胁迫程度的加剧而逐渐增大。

