不同温度下喷施油菜素内酯对香椿幼苗的影响
杨超臣 ,李 泽 ,李建安 ,刘书彤 ,张帆航 ,李艳丽
(中南林业科技大学 a.经济林育种与栽培国家林业局重点实验室;b.经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
香椿Toona sinensis,楝科Meliaceae香椿属Toona(Endl.)Roem落叶乔木,在我国栽培历史悠久,原产于我国中部和南部,除东北、西北外,全国各地均有分布。香椿喜光,较耐寒,能在钙质土、酸性土及中性土上生长,但在土层深厚、肥沃的砂壤土上生长迅速。木材赤褐色带红,材质坚硬,为造船、建筑、家具良材,有“中国桃花心木”之称;嫩芽可食用,味鲜美;根、皮及果可入药[1]。
油菜素内酯(Brassinolide,简称BR)又称芸苔素内酯或芸苔素,它是一种甾体化合物,广泛存在于植物界,对植物的生长发育有多方面的调节作用,在第16届国际植物生长调节物质(IFGSA)会议上,BR被列入“植物激素”的范畴,一些植物生理学家也将之称为“第六大植物生长激素”。Grove等[2]在1979年确定其化学结构,属于甾醇内酯,故命名为油菜素内酯(Brassinolide)。随后,具有相似活性及结构的固醇类物质在不同植物中相继被鉴定出,并且都被归为油菜素内酯类似物,其中以油菜素内酯的生理活性最强,被认为是一种新的植物激素[3]。
近年来,全球气候逐渐恶劣,极端气温的出现导致植物受到一定的逆境胁迫。而油菜素内酯作为一种新型高效的广谱植物生长调节剂,在促进植物生长、提高作物的抗逆性等方面已有大量的研究:杨慧杰等[4]发现0.1 mg·L-1的油菜素内酯可以通过提高光合色素含量、增加气孔导度、提高PSⅡ光化学活性、促进碳水化合物的卸出、维持蔗糖代谢平衡等来缓解阔世玛对谷子光合作用的抑制;王舒甜等[5]发现BR处理可以不同程度地提高盐胁迫下香樟幼苗植株相对含水率,增加其比叶面积、干鲜比以及叶肉质化程度,降低盐害指数;吴杨等[6]发现,在盐碱胁迫下,施加外源BR通过提高抗氧化酶活性和脯氨酸及叶绿素含量,降低了活性氧(ROS)的积累,维护了细胞结构的完整,促进了幼苗生长,增强了大豆幼苗耐盐碱胁迫的能力;袁凌云等[7]发现外源BR能够通过调控AsA-GSH 循环及热耗散,增强黄瓜幼苗叶绿体抗氧化能力,从而抵抗Ca(NO3)2胁迫。本研究以盆栽5月龄香椿幼苗为材料,探究在不同温度下喷施油菜素内酯对香椿幼苗生物量、光合作用、叶片叶绿素荧光特性指标的影响,旨在探究油菜素内酯对香椿幼苗受到温度胁迫时的缓解作用及生理调节机制,以期为香椿设施栽培提供理论依据和参考。
1 材料与方法
1.1 试验材料
香椿种子于2017年1月购自河南农业科学院,常温避光下保存。
1.2 试验设计与方法
试验于2017年3ü9月在中南林业科技大学校内进行,2017年3月播种于人工气候室,成苗后移栽至装有50%土壤、50%基质的塑料盆(20 cmh20 cmh16 cm)中,放置于生科楼平台,培养至2017年8月,然后选取生长一致的香椿幼苗,于8月4日开始,每日早晨7:00气孔刚打开时,在香椿叶面均匀喷施0.1 mg·L-1的油菜素内酯,对照喷施等量的水,持续一周。8月11日移栽至人工气候室,设置3个温度处理:8、28、38 ℃。每个处理放置12盆,共72盆。试验期间进行相同的水肥管理,持续21 d后测量生长、生理、光合等各项指标。
1.3 生长指标的测定
株高和地径分别用卷尺和游标卡尺测量,均9次重复。试验最后测定植物鲜质量和干质量,参照李卫国等(2007)的方法,从盆中取植株,用自来水冲洗根系泥土后用滤纸吸干水分,测定植物地上部分和地下部分鲜质量,计算根冠比,然后在105 ℃杀青15 min,80 ℃下烘24 h至恒质量后,称地上部分和根系干质量,以上鲜质量和干质量都做3次重复。仪器是精确度为0.01的电子天平(衡展,深圳)。用显微镜(OLYMPUSDP73,日本)观察叶片和叶片栅栏组织的厚度。
1.4 叶绿素指标的测定
叶绿素含量参照张宪政(1986)丙酮乙醇法,用打孔器切取0.1 dm2鲜叶剪成细丝,浸泡在10 mL丙酮乙醇(V∶V=1∶1)溶液中提取24 h。按照Arnon(1949)方法用分光光度计测定663 nm和645 nm处读光密度(OD)值,计算叶绿素a、叶绿素b及叶绿素总量,每个处理重复测定3次。
1.5 光合指标的测定
1.5.1 光合生理特征参数的测定
光合指标测定于8:00ü11:00,自顶端向下选取成熟的功能叶片,用Li-6400XT便携式光合仪(LI-COR,美国)测定叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)等参数。测定时用红蓝光源叶室,光照强度设为1 800 μmol·m-2s-1,CO2气体由小钢瓶提供,控制浓度为 400 μmol·m-2s-1,每个测定重复 3 次。
1.5.2 叶绿素荧光参数的测定
叶绿素荧光参数的测定用LI-6400XT光合仪(LI-COR,美国)荧光叶室测定,参考LI-6400XT操作手册,测定当天的下午,在每个处理选取成熟的功能叶,挂好标签标记,21:00ü23:00 测定初始荧光 Fo,然后施加饱和脉冲为 7 200 μmol·m-2s-1的光强下0.8 s,测得暗适应下最大荧光 Fm,根据Fo和Fm,计算Fv/Fm=(Fm-Fo)/Fm。荧光参数的计算参照Roheck(2002)的方法。天亮后在叶室内光活化30 min以上,直接测定表观电子传递效率ETR、实际光化学量子效率ΦPSII、光化学淬灭系数qP及非光化学淬灭系数qN等参数[8]。
1.6 数据处理
用Excel 2016对数据进行处理并作图,用SPSS 22.0软件进行统计分析和差异显著性检验(Duncanÿs 新复极差法)。
2 结果与分析
2.1 不同温度下油菜素内酯对香椿幼苗生长的影响
由表1可知,在同一温度下,BR处理的苗高增量、地径增量、根冠比、地上干质量、地下干质量均大于CK。其中8 ℃-BR处理的苗高增量、根冠比分别比8 ℃-CK处理增加了60%、21.85%,差异显著(P<0.05);28 ℃-BR处理的根冠比、地上干质量分别比28 ℃-CK处理增加了39.13%、22.18%,差异显著(P<0.05);38 ℃-BR处理的地径增量、地上干质量分别比38 ℃-CK处理增加了35.29%、14.47%,差异显著(P<0.05);地下干质量在各温度下虽然BR大于CK,但未达到显著水平。在同一激素处理下,苗高增量、地径增量、地上干质量、地上干质量都是28 ℃时最大,说明38、8 ℃时香椿幼苗生长遭到胁迫,而BR可有效缓解温度胁迫造成的香椿幼苗生物量的下降,促进干物质的积累。
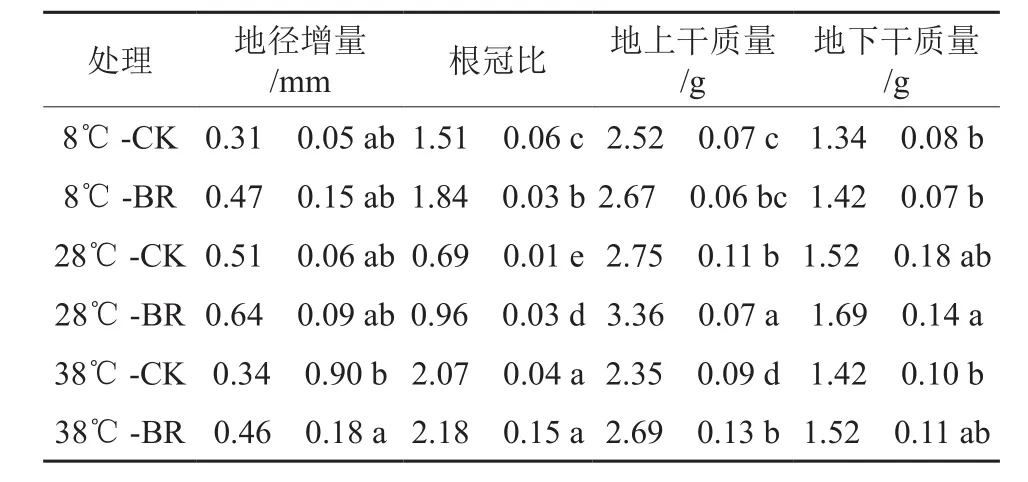
表1 不同温度下喷施油菜素内酯对香椿幼苗生物量的影响†Table 1 Effects of spraying Brassinolide on biomass of seedlings of Toona sinensis in different temperatures
2.2 不同温度下喷施油菜素内酯对香椿幼苗叶片叶绿素含量的影响
由图1可知,在同一激素水平下,香椿幼苗叶片的叶绿素a、叶绿素b、叶绿素总量8 ℃和38 ℃都低于28 ℃。叶绿素a、叶绿素b、叶绿素总量在相同温度时BR处理都高于CK,叶绿素a在8℃时BR比CK提高最多,为9.97%;叶绿素b在28 ℃时提高最多,为34.72%,达到显著水平(P<0.05);叶绿素总量在8 ℃时提高最多,为19.61%,达到显著水平(P<0.05)。叶绿素a/叶绿素b在3个温度时都是BR低于CK,且在38 ℃时最大,38℃-CK处理时,叶绿素a/叶绿素b为5.948,38 ℃-BR处理时叶绿素a/叶绿素b为 5.558。
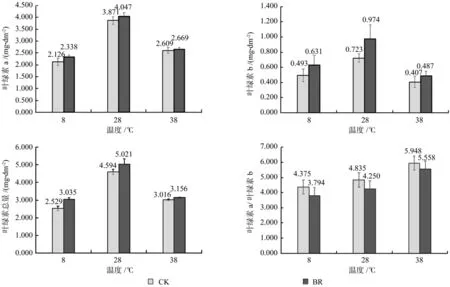
图1 各处理对香椿幼苗叶片叶绿素含量的影响Fig.1 Effects of each Brassinolide treatment on leaf chlorophyll content of seedlings of Toona sinensis
2.3 不同温度下喷施油菜素内酯对香椿幼苗叶片形态的影响
由表2可知,在同一激素处理下,28 ℃时的栅栏组织厚度及叶片组织总厚度都显著大于38 ℃、8 ℃时的,表明38、8 ℃时叶片生理生长受到胁迫。叶片含水率在38 ℃-CK时最小,为77.08%;28 ℃-BR时最大,为94.01%。而在同一温度下,油菜素内酯(BR)处理的叶片含水率、栅栏组织厚度、叶片组织总厚度都大于对照(CK)处理。在8、28、38 ℃时叶片含水率BR处理比CK分别提高了8.65%、14.52%、13.66%;栅栏组织厚度增大了24.17%、77.22%、27.13%;叶片组织总厚度增大了37.34%、54.50%、13.45%。表明BR处理的香椿幼苗可以通过增加栅栏组织和叶片组织厚度来减缓温度胁迫带来的伤害。
2.4 不同温度下喷施油菜素内酯对香椿幼苗光合特性的影响
由图2可知,在同一激素水平下,28 ℃时净光合速率(Pn)和气孔导度(Gs)都高于8、38 ℃,且达到显著水平(P<0.05),说明8、38 ℃时香椿幼苗光合作用受到抑制。在同一温度下,经BR处理的净光合速率(Pn)和气孔导度(Gs)显著高于CK,净光合速率(Pn)在8、28、38℃时,BR比CK分别提高了44.23%、34.96%、90.40%,Gs分别提高了32.85%、20.27%、82.13%。而胞间CO2浓度(Ci)、蒸腾速率(Tr)在同一激素水平下,都是38 ℃最高,28℃次之,8 ℃最低。在同一温度下经BR处理的胞间CO2浓度(Ci)和蒸腾速率(Tr)显著低于CK,胞间CO2浓度(Ci)在8、28、38 ℃时,BR比CK分别降低了13.73%、24.06%、32.41%,Tr降 低 了 16.13%、1.67%、27.84%。说明BR处理通过增加香椿幼苗叶片的净光合速率、气孔导度和降低胞间CO2浓度、蒸腾速率来缓解温度胁迫带来的伤害,并且BR处理对高温胁迫的缓解作用明显好于低温胁迫。
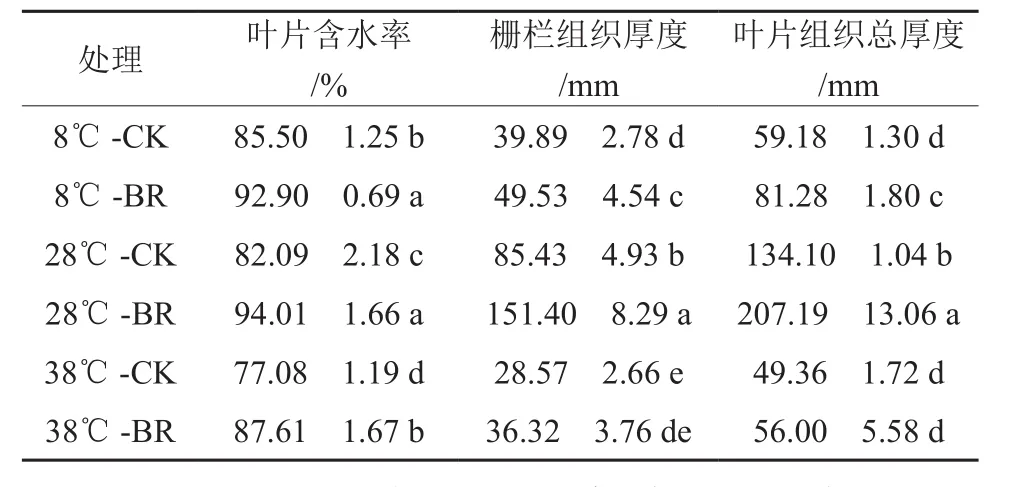
表2 不同温度下喷施油菜素内酯对香椿幼苗叶片形态的影响†Table 2 Effects of spraying Brassinolide treatments on leaf morphology of seedlings of Toona sinensis in different temperatures
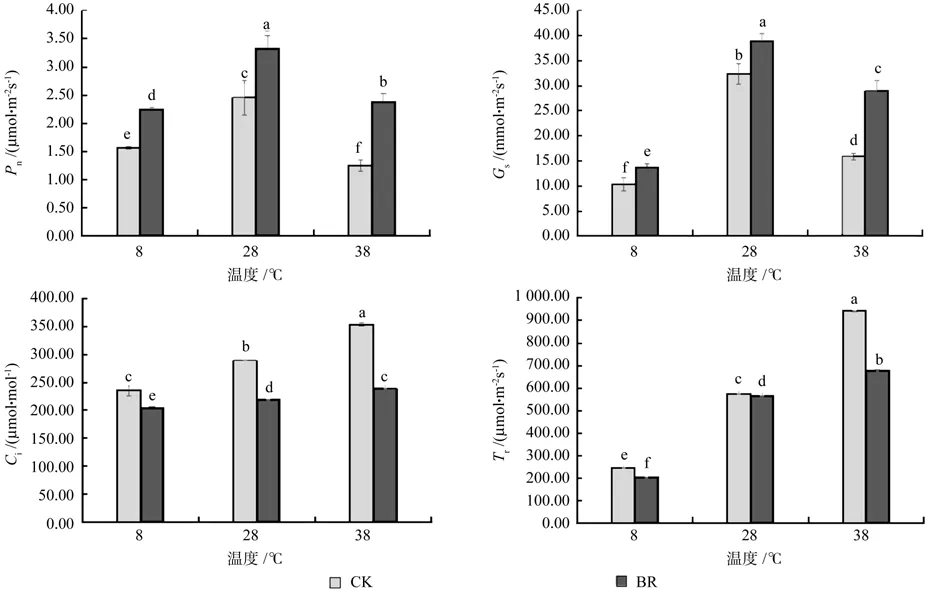
图2 不同温度下喷施油菜素内酯对香椿幼苗光合特性的影响Fig.2 Effects of spraying Brassinolide treatments on photosynthetic characteristics of seedlings of Toona sinensis in different temperatures
2.5 不同温度下喷施油菜素内酯对香椿幼苗叶绿体荧光特性的影响
Fo为初始荧光,是PSⅡ反应中心全部开放时的荧光水平,Fo升高表示PSⅡ反应中心受到了伤害或不可逆失活。由图3可知,在同一激素水平下Fo在38 ℃时最高,8 ℃次之,28 ℃最低,而BR处理降低了Fo值,说明38、8 ℃时香椿幼苗叶片受到伤害,而BR处理有缓解作用。Fv/Fm表示PSⅡ的最大光能转换效率,其值下降是光合作用光抑制的重要特征。同一激素水平下相对于28 ℃时,8、38 ℃时Fv/Fm明显降低(P<0.05),同一温度下BR处理能明显提高Fv/Fm,BR处理在8 ℃时提高了2.04%。qN是非光化学荧光猝灭系数,反映PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分。qP是光化学荧光猝灭系数,表示PSⅡ中处于开放状态的反应中心所占的比例,也是反映光合作用反应中心开放程度的指标。由图3可知,在同一温度下BR处理对qN和qP的作用效果相反,BR处理降低了qN值,提高了qP值。实际光化学量子产量ФPSⅡ和表观电子传递效率ETR有相似的变化趋势,都是28 ℃时显著高于8和38 ℃,且BR处理都提高了ФPSⅡ和ETR,实际光化学量子产量(ФPSⅡ)BR处理在8、28、38 ℃时分别提高了54%、39.73%、34.04%,表观电子传递效率ETR分别提高了13.87%、45.61%、46.67%。
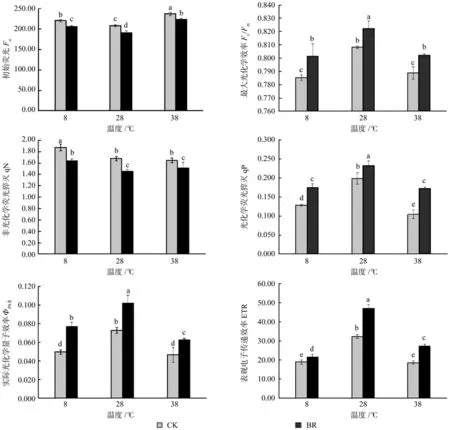
图3 不同温度下喷施油菜素内酯对香椿幼苗叶绿体荧光特性的影响Fig.3 Effects of spraying Brassinolide treatments on chlorophyll fluorescence of seedlings of Toona sinensis in different temperatures
3 讨论与结论
温度胁迫下,植物生长受到不同程度的影响,体现于形态结构变化及生理响应上。在农业生产上,已经发现施用外源油菜素内酯(BR)可以提高作物的产量以及在干旱和低温、高温等逆境条件下起到缓解作用[9-10]。前人研究证明,BR处理可提高花椰菜在干旱胁迫下的壮苗指数、地上部干物质质量,促进壮苗的形成,改善生长状况[11]。王传凯等[12]发现常温下喷施油菜素内酯(BR),可提高裸燕麦叶片的叶绿素含量,增强光合作用,加快其有机物质的积累。本实验研究了在8、28、38 ℃时BR对香椿幼苗生物量的影响,发现8、38 ℃时香椿幼苗的生长受到抑制,BR处理明显增加了香椿幼苗的生物量,促进了干物质的积累,缓解温度胁迫对香椿幼苗生长的抑制作用,与谢云灿等的研究结果一致[13]。
叶绿素是位于叶绿体内的光合色素,直接参与光合作用中光能的吸收、传递、分配和转化等过程,因此,叶绿素含量的多少直接影响光合作用的强弱[14]。而逆境胁迫抑制了光合色素的合成,降低了叶绿素和类胡萝卜的含量,进而引起光合功能的改变[15]。本实验中,低温(8 ℃)和高温(38 ℃)下,叶绿素a、叶绿素b、叶绿素总量明显低于常温(28 ℃),温度胁迫使叶绿素酶失活或者活性降低,捕捉光能能力下降。BR处理叶绿素含量高于CK,说明BR能在一定程度上减轻叶绿素的下降程度,与徐晓昀等的研究结果一致[16]。
低温胁迫会引起植物气孔的关闭,限制CO2的运输和水分的流失,进而影响植物净光合速率和气孔导度,主要有两个因素:一是气孔因素,另外一个是非气孔因素[17]。有学者认为低温下胞质中的磷酸丙糖的利用效率下降,磷酸盐进入叶绿体就会受到抑制,光合作用就会受到磷酸盐的限制[18]。高温胁迫会使Rubisco酶活性下降,进而导致Rubisco对CO2亲和力下降[19]。在外界环境胁迫下,光合作用的限制因子可分为气孔限制和非气孔限制,当胞间CO2浓度与气孔导度同时下降时,净光合速率下降主要是由气孔限制引起的,如果净光合速率 的降低伴随着胞间CO2浓度升高,光合作用的主要限制因素则是非气孔因素[20]。本实验中,低温(8 ℃)胁迫后,胞间CO2浓度和气孔导度低于28 ℃,其变化趋势一致,说明低温下净光合速率的下降是由气孔限制引起的;高温(38 ℃)胁迫后,净光合速率和气孔导度下降,但胞间CO2浓度升高,表明净光合速率值的下降不是因为气孔导度下降使CO2供应减少所致,而是由非气孔因素导致的,与张永平等的研究结果一致[21]。蒸腾速率在高温时上升,在高温胁迫过程中,植株可以通过改变蒸腾速率来调节叶温和矿物质的运转,从而减轻高温的伤害;在低温时降低,说明叶片受低温胁迫后,限制气孔增大,导致气孔导度降低,气孔对CO2更加敏感并且引起质量分数的变化,从而蒸腾速率下降[22]。BR处理显著提高温度胁迫下香椿幼苗的蒸腾速率和气孔导度,据此推断,BR通过促进光合机构对CO2的利用能力及提高温度胁迫后幼苗叶片相关酶活性来提高光合作用。
叶绿素荧光参数与光合作用中的各种反应密切相关,极易受逆境的影响,它的变化可反映逆境对光合作用某些过程的影响,是快速、灵敏、无损伤的研究和探测逆境条件下光合机构运转情况的理想方法[23]。Fo为初始荧光,是PSⅡ反应中心全部开放时的荧光水平,Fo升高表示PSⅡ反应中心受到了伤害或不可逆失活。Fv/Fm表示PSⅡ的最大光能转换效率,其值下降是光合作用光抑制的重要特征。本试验中,8 ℃和38 ℃时Fo显著高于28 ℃,说明Fv/Fm下降是由温度胁迫导致PSⅡ反应中心失活所致,BR处理可以有效缓解温度对PSⅡ反应中心活性的伤害,增强香椿幼苗对温度胁迫逆境的适应,这与张永平等的研究结果一致[24]。qN是非光化学荧光猝灭系数,反映PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,qP是光化学荧光猝灭系数,表示PSⅡ中处于开放状态的反应中心所占的比例,也是反映光合作用反应中心开放程度的指标。ФPSⅡ为作用光下PSⅡ实际光化学效率,能够反映PSⅡ反应中心原初光能捕捉效率,是叶片用于光合电子传递的能量所占吸收光能的比例,常用于表示植物光合作用的电子传递量子产额,较高的ФPSⅡ值有利于提高植物的光能转化效率,促进碳同化的高效运转和有机物的积累[25]。本试验中,8 ℃和38 ℃时qN显著高于28 ℃,而qP、ФPSⅡ和ETR显著低于28℃,BR处理显著降低qN,显著提高qP、ФPSⅡ和ETR,这与张睿佳等在高温胁迫对葡萄光合影响的试验结果一致[26]。说明温度胁迫下PSⅡ的供体和受体遭到逆境伤害,植物关闭部分反应中心以抵御温度逆境的伤害,导致qP和ФPSⅡ下降[27]。BR处理通过降低PSⅡ反应中心非光化学能量的耗散、提高实际光化学量子效率和电子传递速率,来提高温度胁迫下香椿幼苗的光合效率。
综上所述,温度胁迫使香椿幼苗叶片光系统的光化学活性减弱,叶绿素含量下降,导致光合能力
减弱,进而导致香椿幼苗的生物量和干物质的积累减少,香椿幼苗生长受到抑制;喷施外源BR可以显著提高叶绿素含量和光化学活性,同时也可以加厚叶片组织,从而提高香椿幼苗对温度胁迫的缓解作用及适应能力,在适温下(28 ℃)喷施外源油菜素内酯可促进香椿幼苗植株生长。本研究只对外源喷施油菜素内酯后香椿幼苗的生物量积累、叶绿素含量、光合特性做了研究,对相关代谢酶活性和渗透调节物质如:过氧化物酶活性、超氧物歧化酶、可溶性蛋白含量、脯氨酸含量等指标缺乏研究。因此,有待进一步研究外源喷施油菜素内酯对香椿幼苗生理生化指标的影响,从多方面揭示香椿幼苗对外源油菜素内酯的响应机制。

