土著菌根真菌对西南桦无性系幼苗光合生理的影响
邹 慧 ,王春胜 ,曾 杰
(1.中国林业科学研究院 热带林业研究所,广东 广州 510520;2.常州工学院,江苏 常州 213000)
菌根(Mycorrhizae)是由土壤真菌与植物根系形成的一种互惠共生体,在漫长的自然生态系统进化过程中,菌根真菌与植物相互作用,协同进化,对于植物生态系统演替和生物多样性维持至关重要[1-2]。菌根真菌从宿主植物获取碳水化合物以满足自身的生长需求,发达的菌丝体“协助”植物吸收更多水分和养分,促进植物生长,供给真菌更多的碳水化合物,从而形成良性循环,促进了碳的固定和循环[3-4]。大量研究表明,菌根真菌促进植物生长,增加生物量,与其增强植物光合作用和碳素营养有关[5-7]。
西南桦Betula alnoides Buch.-Ham.ex D.Don是我国热带、南亚热带地区的一个乡土珍贵阔叶用材树种,其木材因具有纹理细致美观、心边材不明显、硬度适中易加工、干缩比小不易翘裂等优良特性,作为高档家具、木地板、胶合板贴面以及乐器制作材料深受市场青睐;而且西南桦在生物多样性和地力维持、水源涵养以及碳素固定等方面发挥着重要作用,被广泛应用于该地区生态公益林和珍贵用材林建设[8]。西南桦兼具外生和丛枝菌根,是一个典型的菌根营养型树种[9],菌根化育苗是西南桦壮苗培育的一个重要方向。西南桦林下表土中的菌根真菌种类往往复杂多样,有人利用西南桦林下表土开展育苗试验取得良好效果[10]。
广西凭祥大青山林区自20世纪70年代末即开始西南桦驯化栽培,在各种立地条件下进行人工种植。因此,以大青山林区西南桦人工林下表土为接种剂和育苗基质,以西南桦无性系组培苗为接种对象,开展温室盆栽试验,结果表明接种土著菌根真菌对西南桦无性系幼苗生长和叶片养分的显著促进作用[11]。本研究通过测定西南桦无性系幼苗的叶绿素含量、光合参数以及叶绿素荧光参数,揭示土著菌根真菌侵染对西南桦幼苗光合生理的影响以及无性系之间的差异,为其幼苗菌根化培育提供理论依据,有助于增进对于土壤适应性的了解,为其推广应用提供参考。
1 材料与方法
1.1 供试材料
A5、BY1、FB4、FB4+等4个西南桦无性系参试,其组培苗由中国林业科学研究院热带林业实验中心提供,选取高约5 cm且生长正常的幼苗开展试验。于该中心西南桦人工林内采集表土作为育苗基质和菌根真菌接种材料。共选择12个具代表性的西南桦林分(见表1),设置20 mh30 m样地,测定每株树的胸径和树高。每个林分随机挖取3份等量表层(0~30 cm)土壤,经充分混合后带回室内晾干。
取部分土壤送广东省生态环境与土壤研究所分析测试中心,按国家林业局土壤养分分析标准[12]制样并测定土壤养分含量(数据详见文献[11])。部分土壤经研磨并过2 mm筛,装入塑料盆(上、下口径和高分别为13 cm、12.3 cm和11 cm)内,每盆装1 kg。每个盆内事先套双层保鲜袋,以防止水肥流失。同时,于中国林业科学研究院热带林业研究所(以下简称“热林所”)苗圃采集黄心土,经研磨、灭菌处理后作为试验对照,以检验试验过程中是否受到杂菌污染。

表1 12个西南桦人工林样地的基本信息†Table 1 Information of 12 B.alnoides plantation plots
1.2 试验设计与育苗措施
盆栽试验铺设于热林所温室内,采用裂区设计,主区为13个土接种处理(12个样地表土和对照),副区为4个西南桦无性系,试验共设3次重复,每个主小区每个无性系8盆,每盆种植1株幼苗。2016年10月移苗,根据西南桦幼苗需水特性及菌根真菌侵染特性浇去离子水,初始浇水量为最大持水量的60%,此后视天气和苗木生长状况适当调整浇水量。幼苗移植后用锡箔纸覆盖塑料盆,以免杂菌侵入,试验过程中未施肥。为了减小边际效应,每隔2周移动苗木一次。
1.3 测定指标和方法
试验开始180 d后,每个主小区每个无性系随机选取3株幼苗,测定其叶片光合参数、叶绿素荧光参数和叶绿素含量,并检测菌根侵染情况。
使用LI-6400便携式光合仪(LI-COR公司,美国),于晴朗无云的上午9:00ü11:00,选取顶芽以下第5片健康完满叶片,测定净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。设定光强 1 200 μmol·m-2s-1,温度 26 ℃,CO2浓度 400 μmol·m-2s-1。水分利用效率(WUE)采用如下公式计算:
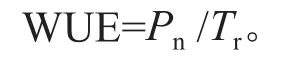
使用PAM-2500便携式调制叶绿素荧光仪(Walz公司, 德国)测定叶片的叶绿素荧光参数。每株选取3片健康完满叶片(顶芽以下第4或5叶),暗适应30 min后,在饱和光强下测定可变荧光Fv和PSⅡ最大光合效率Fv/Fm;光适应下,测定PSⅡ实际光合效率ΦPSⅡ和电子传递率ETR。
用去离子水将苗木冲洗干净并吸干水分,运用CI-202便携式叶面积仪(美国CID生物科技公司)扫描整株幼苗叶片并计算叶面积,随即采用舒展等[13]的方法测定单位面积叶绿素含量。单株幼苗叶绿素含量为单位面积叶绿素含量与叶面积之积。
幼苗生长调查和菌根侵染检测方法及数据详见文献[11],12个样地土壤的菌根侵染率见表2。

表2 西南桦幼苗的土著菌根侵染率†Table 2 Colonization rate of native mycorrhizal fungi in Betula alnoides seedlings %
1.4 数据分析
试验数据运用SPSS22.0软件进行分析:1)采用一般线性模型进行裂区设计方差分析和LSD多重比较分析;2)考虑到土壤养分等因素可能影响西南桦幼苗光合生理特征和菌根侵染,针对各土接种处理分别进行光合生理指标与菌根侵染率的相关性分析(Pearson系数);3)为了明晰菌根侵染和土壤养分对幼苗光合生理特征等的影响,分别依据林分立地指数、土壤养分状况以及幼苗菌根侵染率、生长表现、光合生理指标进行聚类分析,将12个处理分为3类,比较各方面指标的处理聚类结果。聚类分析时,菌根侵染、生长和光合生理指标均以4个无性系的均值进行分析。立地指数、菌根侵染率采用K-中心聚类方法进行聚类分析,土壤养分、生长、光合生理方面指标进行系统聚类分析。
2 结果与分析
2.1 叶绿素含量
各土接种处理间西南桦幼苗的叶绿素含量差异显著(P<0.05),且叶绿素a和b以及总叶绿素含量的差异表现出一致性(见表3)。S12处理的幼苗叶绿素含量最高,均显著高于其它处理,其次是S2、S4和S10处理;S3处理最低,显著低于其它处理;而S5和S6处理处于中上水平(见表3)。S12处理的幼苗叶绿素a、叶绿素b、总叶绿素含量分别为S3的6.8、8.2和7.1倍。各土接种处理的幼苗叶绿素a与b含量比值大小排序则刚好相反,以S3处理为最高,S12处理最低,S5和S6处理亦处于中下水平。
无性系之间比较,幼苗叶绿素含量以无性系A5为最低,显著低于FB4、BY1、FB4+3个无性系,而后三者间差异不显著。土接种与无性系之间的交互作用仅在幼苗叶绿素a含量上达到显著水平(见表3)。
2.2 光合参数
由表4可知,12个土接种处理间西南桦幼苗净光合速率、气孔导度、蒸腾速率和水分利用效率存在显著差异(P<0.05)。S12处理的幼苗净光合速率、气孔导度、蒸腾速率以及水分利用效率最高,均显著高于其它处理,其次为S2、S4、S5、S10以及S6处理,这些处理之间差异较小;S1、S3和S11处理最低,显著低于其它处理,其均值分别比S12处理低约41.90%、53.33%、28.53%和 18.84%。胞间CO2浓度以S3处理为最高,显著高于其它处理,为最低S2和S12处理的1.40倍。
FB4、BY1、FB4+等3个无性系之间净光合速率、胞间CO2浓度、蒸腾速率、水分利用率差异不显著(P≥0.05),均显著优于A5;而气孔导度在4个无性系之间差异不显著。土接种处理与无性系在净光合速率、胞间CO2浓度、蒸腾速率、水分利用率上表现出显著的交互作用。
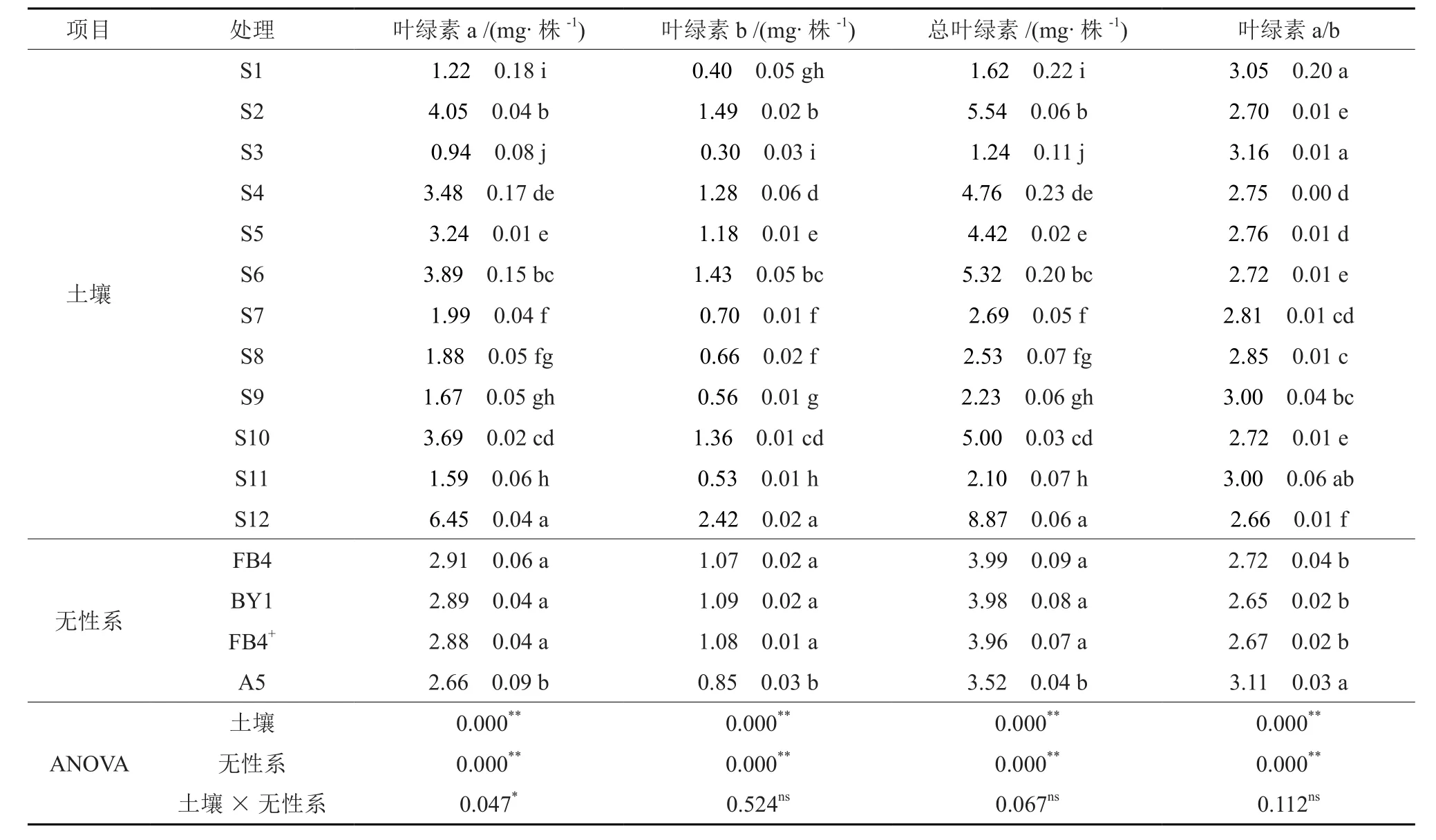
表3 土接种和无性系对西南桦幼苗叶绿素含量的影响†Table 3 Effects of native soil inoculation and clone on leaf chlorophyll contents of B.alnoides seedlings

表4 土接种和无性系对西南桦幼苗光合特征的影响Table 4 Effects of native soil inoculation and clone on leaf photosynthetic characteristics of B.alnoides seedlings
2.3 叶绿素荧光参数
从表5可以看出,12个土接种处理间各荧光参数均差异显著(P<0.05)。Fv/Fm的变化幅度不大,为0.71~0.77。Fv、ΦPSⅡ以及ETR均以S12处理为最高,显著高于其它处理;S1、S3、S9和S11处理最低,显著低于其它处理,后四者的均值分别是S12处理的75.89%、73.02%和73.29%。
FB4、BY1、FB4+等 3个 无 性 系 之 间 Fv、ΦPSⅡ以及ETR差异不显著(P≥0.05),而显著高于无性系A5。土接种处理与无性系的交互作用显著影响幼苗的Fv和ΦPSⅡ。
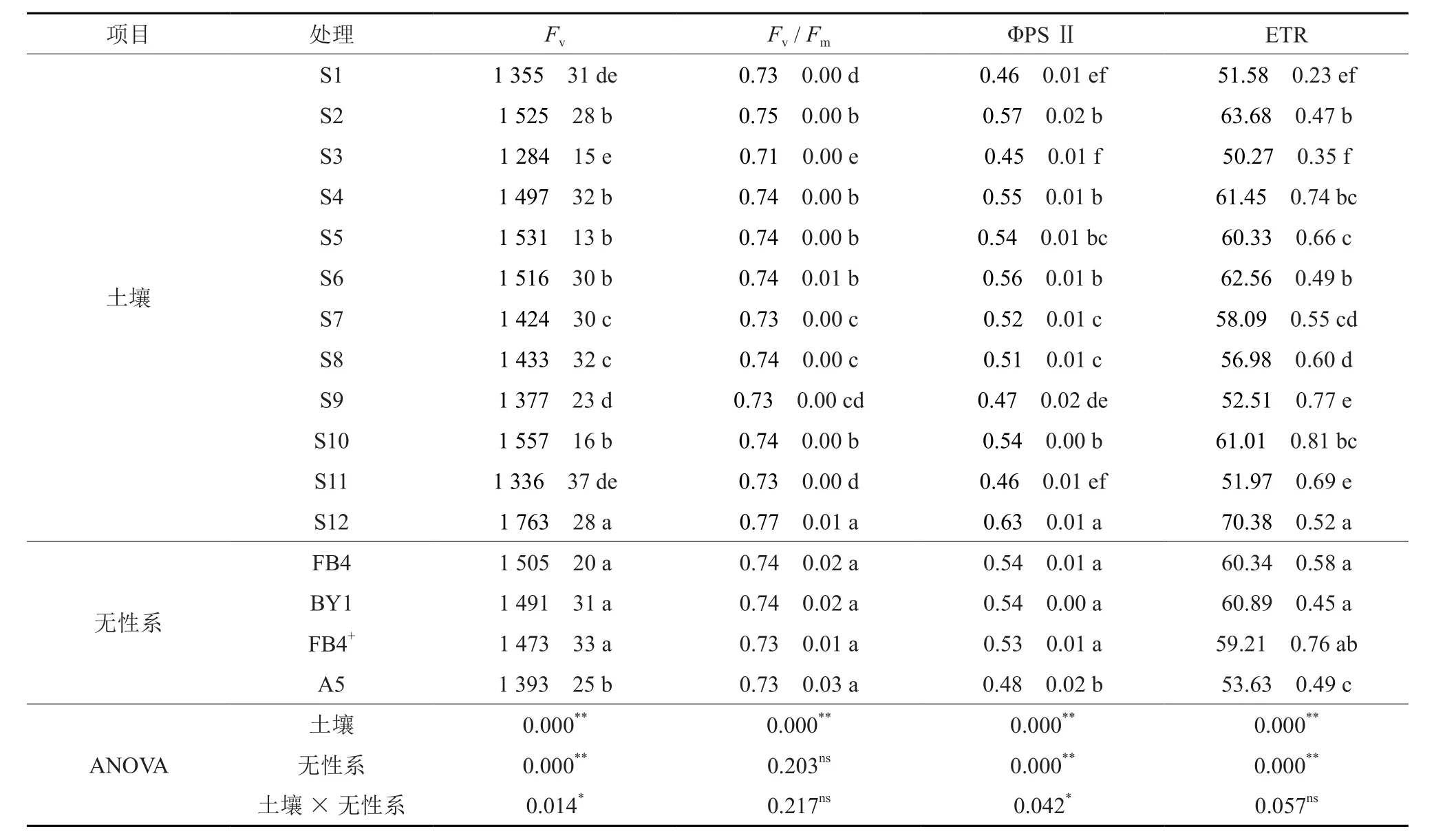
表5 土接种和无性系对西南桦幼苗叶绿素荧光参数的影响Table 5 Effects of native soil inoculation and clone on leaf chlorophyll fluorescence parameters of B.alnoides seedlings
2.4 土著菌根侵染与光合生理特征的相关性
针对每个土接种处理单独进行相关性分析(见表6)得出,各土接种处理西南桦幼苗主要光合生理指标与土著菌根侵染率均呈正相关,且绝大多数达到显著(P<0.05)或极显著(P<0.01)水平。其中,S12和S2处理的各项光合生理指标与土著菌根侵染率均呈极显著正相关,S4、S5、S6以及S10处理均相关显著或极显著;而S3和S1处理的各项光合生理指标与菌根侵染率大多相关不显著(P≥0.05),仅S1处理中水分利用效率与菌根侵染率相关显著。在分析的5个主要光合生理指标中,水分利用效率与土著菌根侵染率相关性最强。
为了明晰土著菌根真菌接种的促生效应,尝试依据西南桦林分生产力、土壤养分以及幼苗菌根侵染率、光合生理指标分别进行聚类分析,各划分3个等级,结果详见表7。由表7可知,养分属 I(S12)、II(S5、S6) 和 III(S1、S3、S9、S11)类的土壤,其立地指数、幼苗菌根侵染、光合生理指标均相应地表现为I、II和III类;而养分属III类的S2号土壤,其立地指数、菌根侵染率均属I类,生长和光合生理指标属II类;养分属III类的S4、S10号土壤,其立地指数以及幼苗菌根侵染率和生长、光合生理指标为II类;养分属III类的S7、S8号土壤,其立地指数和幼苗菌根侵染率为II类。菌根侵染率和立地指数的聚类结果一致,与幼苗生长、光合生理指标的聚类结果基本一致。

表6 主要光合生理指标与土著菌根侵染率的相关系数†Table 6 Correlation coefficients of main photosynthesis physiological index and native mycorrhizal fungi colonization rate (n=36)

表7 基于林分生产力、土壤养分及幼苗菌根侵染、生长、光合生理指标的样地(土接种)聚类分析Table 7 Clustering analysis on sample plots (native soil inoculation) based on forest productivity, soil nutrition,and colonization rate, growth performance and photosynthetic physiology of B.alnoides seedlings
3 结论与讨论
叶绿素作为植物体内将光能转化为化学能的关键色素,其含量是反映植物光合能力强弱的重要指标,叶绿素含量越高,说明植物对光能的利用率越高,光合作用越强[14]。在本研究中,大部分土接种处理(仅S1和S3例外)的西南桦幼苗,其总叶绿素含量均与土著菌根侵染率呈显著或极显著正相关。土著菌根侵染率最高的S12处理,其幼苗叶绿素a和b以及总叶绿素含量均显著高于其它处理,叶绿素a与b的含量比值显著低于其它处理;而土著菌根侵染率低的S1、S3、S9和S11处理则刚好相反。叶绿素a主要吸收红橙光,叶绿素b主要吸收蓝紫光,其相对含量的增加有助于对弱光的利用;在叶绿素a含量较高的情况下,叶绿素a/b的值却较低,说明幼苗对不同波长光的利用率均较高,有助于增强光合作用[15]。柴迪迪等[16]对板栗幼苗的菌根真菌接种试验亦表明,接种适宜菌根真菌能够增强对于弱光的利用能力以及对于强光的适应性和利用能力。这些在本研究得到证实,S12处理幼苗净光合速率、气孔导度、蒸腾速率、水分利用效率均显著高于其它处理,胞间CO2浓度显著低于其它处理;而S1、S3和S11处理则相反。绝大多数土接种处理的西南桦幼苗,其净光合速率、水分利用效率与菌根侵染率呈显著正相关。菌根侵染促进宿主植物对水分和养分的吸收,增强叶肉细胞的光合活性,提高气孔的通透性,使得空气中更多CO2进入叶肉细胞,同时加快CO2的同化固定,因此,胞间CO2浓度显著降低,而净光合速率显著提高[17-18]。而S1、S3、S11处理的幼苗气孔导度相对较低,CO2难以进入细胞内完成固定而积累在细胞间隙,导致胞间CO2浓度升高。
进一步分析菌根侵染对叶绿素荧光参数的影响亦可以发现,Fv/Fm反映植物潜在最大光能转换效率,绝大多数高等植物在健康生理状态下的Fv/Fm值在0.8左右[19],12个土接种处理的幼苗Fv/Fm值变化幅度相对较小,均在0.7以上。Fv反映植物光化学反应的“域”,其值越大说明能进行光化学反应的光强范围越广;ΦPSⅡ反映测量时植物实际光能转换效率;ETR反映光系统Ⅱ利用光能的能力[20]。土著菌根侵染率最高的S12处理,其幼苗Fv、ΦPSⅡ、ETR均显著高于其它处理,而土著菌根侵染率低的S1、S3、S9和S11处理则显著低于其它处理。大部分土接种处理的幼苗Fv/Fm、ΦPS Ⅱ与菌根侵染率呈显著正相关。通常情况下,可变荧光Fv与植物的PSⅡ反应中心活性密切相关[21];ΦPSⅡ和ETR均与净光合速率Pn呈正相关,均能表征光能实际利用效率,PSⅡ反应中心开放的数目越大,开放部分的比例则越高,将更多光能用于电子传递,从而提高光合电子传递能力[18,22-23]。
4个无性系之间叶绿素含量、光合参数以及叶绿素荧光参数绝大多数差异显著,FB4、BY1、FB4+无性系显著高于A5,仅气孔导度、Fv/Fm差异不显著,与常河等[24]对于荔枝的研究结果相似,发现土著菌根真菌对2个荔枝品种幼苗叶绿素含量、净光合速率、蒸腾速率、气孔导度的影响较大,而且其影响效应因品种不同而存在较大差异。
由于菌根侵染与土壤特征密切有关,而且土壤养分等因素亦影响植物生长和光合生理特性[25],因此,本研究中,通过对各土接种处理分别进行幼苗光合生理指标与菌根侵染率的相关性分析发现,侵染率较高的S2、S4、S5、S6、S10、S12处理,其各项光合生理指标与菌根侵染率的正相关性更显著,而侵染率相对低的S1、S3、S9、S11处理,这种相关性并不显著或者显著性水平相对较低,说明各土接种处理间的差异可能是菌根侵染和土壤养分共同作用的结果。从西南桦林分生产力、土壤养分以及幼苗菌根侵染率、光合生理指标的聚类分析结果亦可以看出,对于S1、S3、S5、S6、S9、S11、S12号处理,各方面指标的聚类结果是一致的;也存在各方面指标聚类结果不一致的情况,如,养分属III类的S2、S4、S7、S8和S10处理,其立地指数以及幼苗菌根侵染率、生长和光合生理指标大多并非属III类。究其原因,其一、土壤养分可能直接或者通过促进菌根侵染间接地对幼苗的光合生理表现产生明显影响;其二、除了土壤养分,还有其它因素影响菌根侵染。当然,本研究亦存在其局限性,盆栽试验未采用灭菌的林地土壤作为对照,无法将菌根真菌与养分的作用区分开,主要是考虑到高温灭菌、化学熏蒸等土壤消毒方法亦可能对土壤结构、养分等造成破坏,影响研究结果。尽管本研究无法区分菌根侵染与土壤养分对于幼苗光合生理的贡献,综合相关分析和聚类分析的结果分析可知,菌根侵染是影响西南桦林分生产力以及幼苗生长和光合生理的重要因素。

