透明质酸修饰阿霉素脂质体的制备及抑制肿瘤细胞生长活性
黄 燕, 邱立朋, 朱梦琴, 宿丹丹, 陈敬华
(江南大学 药学院,江苏 无锡 214122)
脂质体是磷脂分散在水中时形成的脂质双分子层闭合囊泡[1],其各层之间被水相隔开,在水中平衡后具有亲水性和疏水性两性性质,被作为药物载体以控制药物释放,减少毒性,提高疗效。阿霉素(Doxorubicin,DOX)是有效的抗肿瘤药物之一,但其具有严重的心脏毒性等毒副作用[2]。通过脂质体包裹阿霉素静脉注射,能够减少阿霉素的心脏分布,降低心脏毒性,提高抗肿瘤疗效[3-4]。然而,普通脂质体存在肿瘤靶向性不足的缺点,因此,通过生物材料对其表面进行修饰是一种提高脂质体靶向性和稳定性,增强细胞内吞能力,延长体内循环作用时间的有效手段[5]。
透明质酸(Hyaluronic acid,HA)是一种广泛存在于体内各组织中的大分子链状黏多糖[6]。HA结构中有羧基、羟基和酰胺键,使其利于载体材料的修饰。研究表明,细胞表面CD44、RHAMM、LYVE-1和HARE等是HA的四类特异性受体[7]。其中,CD44是细胞表面最重要的HA受体[8]。与正常细胞相比,CD44受体在乳腺癌、卵巢癌、肺腺癌等多种恶性肿瘤细胞表面过表达[9]。根据受体-配体理论,HA作为抗肿瘤药物靶向载体时,能与肿瘤细胞表面的CD44受体特异性结合,使更多的抗肿瘤药物分子靶向进入肿瘤细胞内,提高抗肿瘤药物的药物疗效[10-12]。
因此,为提高脂质体的细胞内吞能力及主动靶向性,延长循环时间,并增大疏水性药物携载能力,作者制备了HA修饰的DOX脂质体。通过HA与十八烷胺(Octadecylamine,OA)进行反应透明质酸-十八烷基(Hyaluronic acid-Octodecane,HOA)聚合物,然后通过后插入法制备HOA修饰的DOX靶向脂质体(DOX/LP/HOA),并对其物理化学性质及体外抑制肿瘤细胞生长活性进行研究。
1 材料与方法
1.1 材料
1.1.1 试剂 HA(相对分子质量5 300):购自华熙福瑞达生物医药有限公司;大豆磷脂(纯度98%):购于上海太伟有限公司;胆固醇:购于上海生工生物工程股份有限公司;十八烷胺、N-羟基琥珀酰亚胺 (NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC):购于上海晶纯生化科技股份有限公司;三乙胺(TEA)、甲酰胺、N,N-二甲基甲酰胺酰胺(DMF)、二氯甲烷(CH2Cl2)二胺四乙酸二钠(EDTA):购自购自国药集团化学试剂公司。反应用的溶剂使用前均需重蒸纯化。
1.1.2 仪器 RV10BS96旋转蒸发仪:德国IKA仪器设备有限公司制造;DF-101S型恒温加热磁力搅拌器:郑州科泰实验设备有限公司制造;AVANCEⅢ型核磁共振仪:瑞士Bruker公司制造;UV-1800型紫外分光光度计:日本岛津仪器有限公司制造;FreeZone冷冻干燥仪:美国Labconco公司制造;Zetasizer Nano ZS纳米粒度分析仪:英国Malven公司制造;JY92-ⅡN型超声波细胞粉碎机:宁波新芝生物科技股份有限公司制造;JEM-2100型透射电子显微镜:日本Jeol公司制造;Multiskan Go型酶标仪:美国Thermo公司制造。
1.1.3 细胞 MCF-7细胞:购自中国科学院保藏中心(上海)。
1.2 HOA的合成及结构确证
精确称取HA 100 mg溶于10 mL无水甲酰胺中,加入100 mg EDC和60 mg NHS,冰浴下磁力搅拌2 h。称取72 mg OA胺溶于5 mL无水DMF,将其缓慢滴入上述HA混合液中,30℃氮气环境下搅拌反应40 h。反应结束后,将反应液装入透析袋(截留相对分子质量3 500)中,于过量的水/乙醇混合液(1/3~1/1)中依次透析1 d,去离子水中透析2 d,0.45 μm水系滤膜过滤后,冷冻干燥得白色HOA聚合物[13-14],用核磁共振波谱(1H NMR)确定其结构。
1.3 脂质体制备
1.3.1 阿霉素碱基的制备 精密称量30 mg盐酸阿霉素,将其溶于30 mL甲醇溶液中,加入30 μL三乙胺,室温下避光搅拌过夜,旋转蒸发除去有机溶剂后,再加入四氢呋喃复溶,得到1 mg/mL的阿霉素碱基溶液,避光保存。
1.3.2 脂质体的制备 采用薄膜分散法制备载DOX普通脂质体 (DOX/LP)。精确称取大豆磷脂400 mg,胆固醇50 mg,加入10 mL无水乙醚使其溶解后,置于500 mL的圆底烧瓶中。精密量取2 mL含DOX的四氢呋喃溶液,缓慢滴加至上述溶液中,80 r/min条件下于旋转蒸发仪上减压蒸发,除尽有机溶剂,脂质则均匀地分布在圆底烧瓶内表面。加入10 mL磷酸盐缓冲液(Phosphate Buffered Saline,PBS,pH 7.4)振摇,水化 30 min,使脂质膜充分水合溶胀,得均匀白色混悬液。然后将所得到的初脂质体再冰浴超声10 min(超声功率400 W,工作5 s,间歇5 s),离心5 min,除去未载入的药物,即得DOX/LP。
采用后插入法制备HA修饰的靶向脂质体(DOX/LP/HOA)[15]。取适量 HOA胶束溶液滴入DOX/LP中,50℃下恒温孵育2 h,冷却后得(DOX/LP/HOA)。
1.4 粒径、zeta电位及形貌表征
取适量脂质体溶液于测量杯内,通过Malven纳米粒度分析仪测定脂质体的粒径、粒径分布及zeta电位值。
将上述脂质体溶液混合均匀后,滴至覆有支持膜的铜网上,待液体挥干后用2%磷钨酸钠负染,室温干燥,用透射电镜(TEM)观察其外貌形态。
1.5 包封率的测定
1.5.1 检测波长的选择 分别取空白HOA修饰的脂质体和DOX溶液,稀释至一定浓度,用紫外分光光度计在200~700 nm范围内进行紫外扫描,确定DOX的检测波长。
1.5.2 DOX标准曲线的测定 精确称取阿霉素10 mg,置于容量瓶中,用纯水溶解并定容至100 mL,配制成100 μg/mL的母液。精密量取适量DOX母液置于10 mL的棕色容量瓶中,纯水稀释定容得到1、2、8、12、16、32、40 μg/mL 的系列 DOX 标准溶液。利用紫外分光光度计测定阿霉素的紫外吸收值,以吸光度A对DOX的质量浓度c作图,绘制标准曲线。
1.5.3 精密度的测定 按照上述方法分别配制2、12 μg/mL 和 32 μg/mL 的低、中、高质量浓度待测溶液,在同一天的内测定5次,计算日内精密度,并连续测5天计算日间精密度。
1.5.4 回收率的测定 取0.5 mL空白脂质体溶液,加入阿霉素储备液适量,稀释至质量浓度分别2、12、32 μg/mL 的低、中、高质量浓度待测溶液,测定吸光度,并按照标准曲线计算回收率。
1.5.5 包封率的测定 采用超速离心法测定包封率[16]。精确量取1.5 mL脂质体于截留相对分子质量为3 000的超滤杯中,10 000 r/min离心30 min,测定滤出液吸光度,计算得到药物的包封率(EE)。
1.6 体外释放
采用动态透析法考察载药脂质体的体外释放行为。取2 mL DOX/LP和DOX/LP/HOA置于透析袋内(截留相对分子质量为3 500),封口后投入装有10 mL、pH 7.4的PBS释放介质的棕色瓶中,于(37±0.5)℃、100 r/min避光振摇。 分别于不同时间点取样1 mL,同时补充相同体积和温度的新鲜PBS。利用紫外分光光度法测定样品的吸光度值,计算累积释放百分数。
1.7 抑制肿瘤细胞生长活性评价
取处于对数生长期的MCF-7细胞,以6×103个/孔接种于96孔板,37℃、5%CO2条件下培养24 h,分别加入 100 μL 的游离 DOX、DOX/LP、 DOX/LP/HOA溶液,同时设空白对照组。孵育48 h后,吸去含药培养液,每孔加入100 μL的MTT溶液(0.5 mg/mL),继续孵育4 h。然后每孔加入100 μL的DMSO用酶标仪测定每孔的吸光度值(OD),并计算细胞存活率,评价其抑制肿瘤细胞生长的活性。
2 结果与讨论
2.1 HOA合成及表征
利用十八烷胺上的氨基与HA结构中的羧基进行反应,制备HOA聚合物,合成过程见图1。通过1H-NMR谱图对HOA聚合物结构进行确证见图2。其中,1.95 μg/g为HA结构中乙酰甲基的特征峰,0.83 μg/g和1.23 μg/g处出现新的特征峰,为十八烷基长链中甲基和亚甲基的特征峰,这表明成功合成了HOA聚合物。
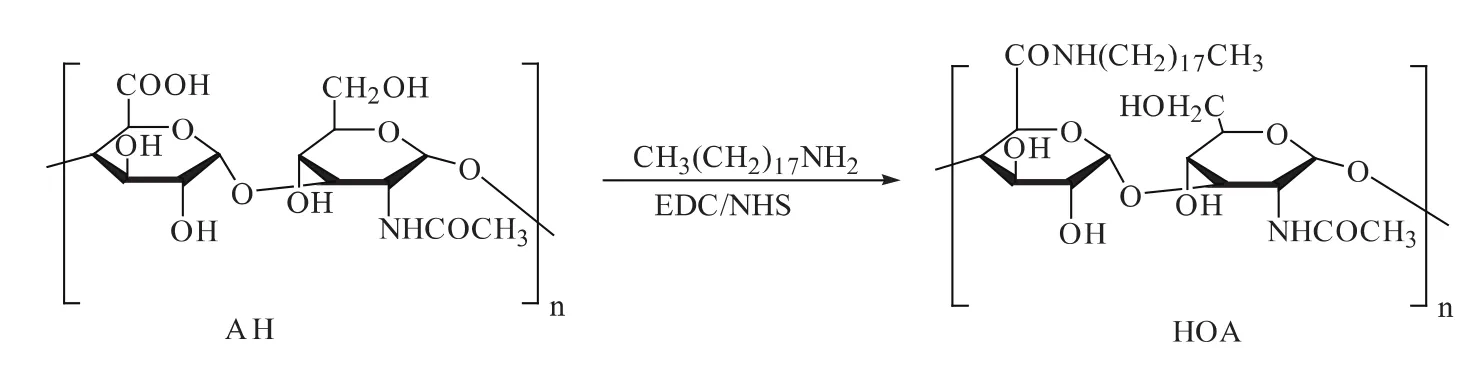
图1 HOA的合成路线图Fig.1 Synthesis route of HOA conjugate
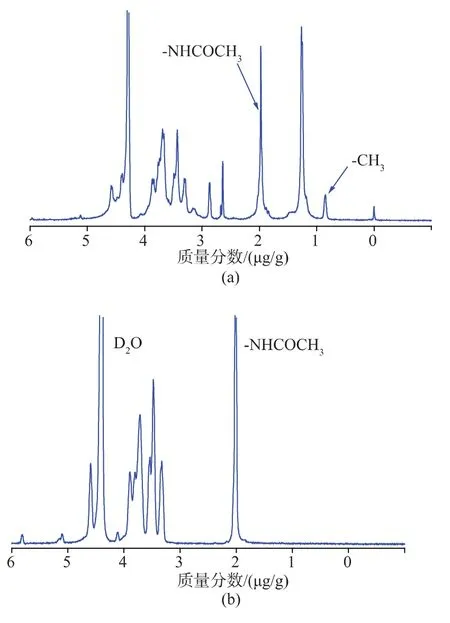
图2HOA和HA的1H-NMR谱图Fig.2 1H-NMR spectra of HOA and HA
2.2 粒径及zeta电位
DOX/LP和DOX/LP/HOA的粒径、多分散指数及zeta电位值见表1。可以看出,制备得到的脂质体粒径较小,经HOA修饰后,脂质体粒径及PDI值无明显变化,zeta电位有所下降。DOX/LP/HOA负的zeta电位能够有效防止粒子聚集,增加脂质体稳定性,同时可以避免血浆蛋白的吸附,提高在血液中的循环稳定性。此外,图3显示DOX/LP/HOA脂质体粒径分布较窄,形貌为球形或类球形。

表1 不同脂质体的粒径、多分散指数及zeta电位值(n=3)Table 1 Sizes,PDI andzeta potential of different liposomes(n=3)
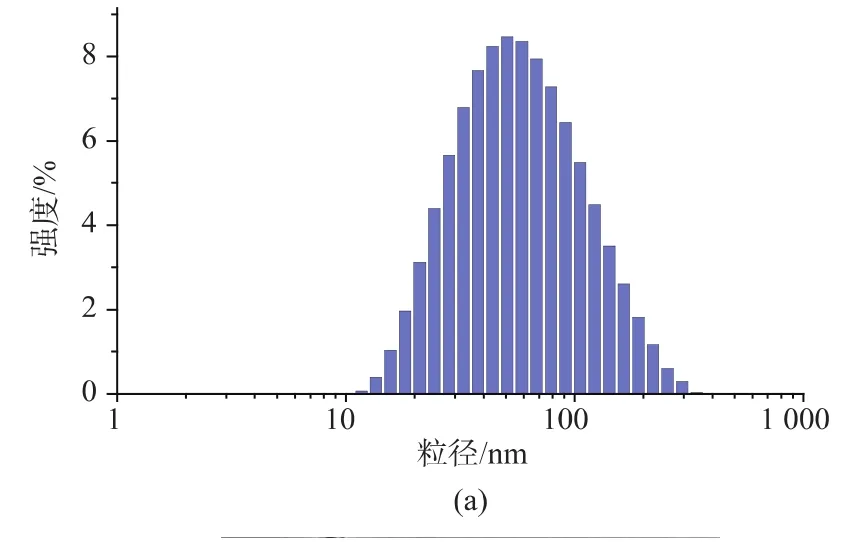

图3 DOX/LP/HOA粒径分布图及透射电镜图Fig.3 Size distribution and TEM micrograph of DOX/LP/HOA
2.3 载药量测定
2.3.1 阿霉素吸收波长 用紫外分光光度法对空白脂质体和DOX溶液的全波长进行扫描,结果见图4。DOX在480 nm处有最大吸收峰,而空白脂质体在此波长并无吸收,不干扰药物质量浓度测定,故选择紫外分光光度计作为DOX质量浓度的检测方法,检测波长为480 nm。
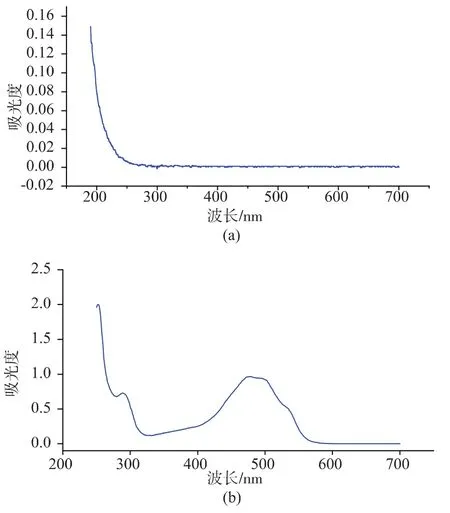
图4 空白脂质体和DOX的紫外全波长扫描图谱Fig.4 UV-scanning spectrometry of blank liposomes and DOX
2.3.2 阿霉素标准曲线 以吸光度(A)对阿霉素质量浓度(c)作图,得到DOX回归方程为:A=0.018 5c-0.001 5(r=0.999 7),结果表明阿霉素在 1~40 μg/mL范围内有良好的线性相关性,可用于DOX的定量分析。
2.3.3 精密度 质量浓度为 2、12、32 μg/mL的阿霉素标准溶液的日内精密度和日间精密度结果见表2。结果表明该方法的重复性良好,各个质量浓度的精密度RSD值均小于2%,符合方法学要求。
2.3.4 回收率 质量浓度为 2、12、32 μg/mL的阿霉素标准溶液的平均回收率分别为100.24%、99.14%和98.95%,RSD值在0.67~1.53,说明该方法的回收率良好。

表2 阿霉素精密度的测定(n=5)Table 2 Precision determination of DOX(n=5)
2.4 包封率
通过超速离心法测定DOX/LP包封率为(95.4±0.32)%,DOX/LP/HOA 的包封率为 (98.85±0.40)%。经HOA聚合物修饰后,脂质体的疏水性空间增大,对DOX具有较好的亲和力,因此,DOX/LP/HOA的包封率有所提高。
2.5 体外释放实验
采用动态透析法考察DOX/LP和DOX/LP/HOA脂质体的体外释放行为,结果见图5。脂质体释放初期均无明显的突释效应,表明DOX被全部包载于脂质体双层中,这与测定的较高包封率结果一致。随着时间的延长,脂质体均缓慢释放,DOX/LP和DOX/LP/HOA的72 h累计释放百分率分别为32.8%和23.16%,具有明显的缓释效果。此外,由图5可以看出,DOX/LP/HOA的释放更缓慢,这可能是因为HOA的疏水段十八烷基插入脂质体双分子层膜,导致疏水作用力增强,形成的空隙更小,不利于药物向外自由扩散。
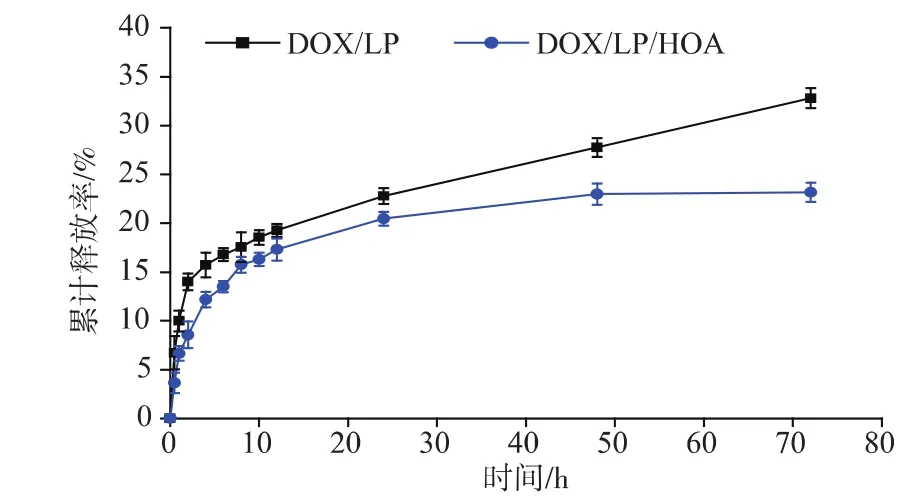
图5DOX/LP/HOA和DOX/LP体外释放图(n=3)Fig.5 In vitro drug release profiles of DOX/LP/HOA and DOX/LP(n=3)
2.6 细胞毒性研究
MTT 法测定 的 游 离 DOX、DOX/LP、DOX/LP/HOA的细胞毒性见图6。结果表明,随着DOX质量浓度增加,不同组的MCF-7细胞存活率逐渐降低,这表明细胞毒性具有浓度依赖性。此外,DOX/LP、DOX/LP/HOA和游离DOX的细胞半数抑制质量浓度 (IC50) 分别为 (2.241±0.351)、(1.458±0.164)、(0.611±0.350) mg/L。 DOX/LP、DOX/LP/HOA、DOX的IC50依次变小,其抑制肿瘤细胞生长的活性越好,说明DOX的脂质体剂型(DOX/LP)更容易进入肿瘤细胞;用HA进一步修饰其脂质体剂型得到DOX/LP/HOA,DOX/LP/HOA可以通过CD44受体介导的内吞作用高效进入细胞,从而达到更好地抑制肿瘤细胞生长的活性。

图6DOX/LP、DOX/LP/HOA与游离DOX对 MCF-7细胞生长的抑制活性(n=3)Fig.6 In vitro cytotoxicity of DOX/LP、DOX/LP/HOA and free DOX against MCF-7 cells(n=3)
3 结语
脂质体作为药物载体因其主要由天然磷脂和胆固醇组成,具有良好的生物相容性,不会在体内积累,免疫原性小、无毒副作用等优点受到越来越多人的重视。并且,根据临床治疗的目的,可以改变脂质体的成分提高脂质体的靶向性。阿霉素是临床上常用的蒽环类抗恶性肿瘤药物,抗癌谱广,疗效好,但是其没有选择性,易导致骨髓抑制、胃肠道毒性以及心脏毒性等副作用,因此我们利用HA具有修饰方便、生物相容性以及受体靶向性等优点,制备了靶向性DOX/LP/HOA脂质体,增大对疏水性药物的携载能力,控制药物缓慢释放,提高药物对肿瘤细胞生长的抑制活性。

