碱法破壁-酶法提取葡萄酒废酵母细胞壁多糖的工艺研究
石豪磊,赵国正,孔祥君,栾俊家,孔国光,牌延惠,张丽君,许维娜,2*
(1.滨州医学院药学院(葡萄酒学院),山东 烟台 264003;2.烟台张裕集团有限公司 山东省葡萄酒微生物发酵技术重点实验室,山东 烟台 264001;3.烟台迈百瑞国际生物医药有限公司,山东 烟台 264006)
酵母泥作为葡萄酒生产的主要副产物之一,含量约占葡萄酒产量的4%~5%[1-2],近几年我国葡萄酒年产量均在10亿L以上,随之生成的废酵母泥极为丰富。葡萄酒废酵母中含有丰富的蛋白质、氨基酸、多糖、核酸、维生素、矿物质等成分,在食品、医药、化工、饲料等工业应用普遍[3-6]。对葡萄酒酵母泥进行开发利用,不仅有利于企业提高经济效益,而且能防止环境污染,具有明显的生态效益。
葡萄酒废酵母细胞壁中含有丰富的多糖类物质,约占细胞干质量的25%~40%,主要成分是葡聚糖和甘露聚糖[2,7]。细胞壁多糖具有较高的生物性能,在人体的消化道中可作为膳食纤维发挥作用,并具有免疫调节、提高巨噬细胞活性、抗癌、抑制有害菌生长、促进有益菌繁殖等功能,加上酵母细胞壁多糖天然、安全、可靠,已作为抗生素替代品成为新的开发热点[8-11]。
目前啤酒废酵母的综合利用研究较多[12-13],葡萄酒废酵母相关研究较少[14]。酵母多糖常用的提取技术有超声波辅助提取法[15]、微波辅助提取法[16]、碱溶法[17]、酶法[18]、自溶法[19-20]等,其中超声波辅助提取法和微波辅助提取法提取时间短,但其设备成本和能耗较高;碱溶法操作简单、成本低,但提取时间过长、提取率低,且会造成一定的环境污染;酶法具有反应条件温和、选择性强、设备要求低等优点,但提取成本相对较高;自溶法成本低,但具有工艺过程复杂、提取率低等缺陷。
本研究以葡萄酒工业发酵产生的废酵母泥为材料,过筛法除去葡萄果皮、果籽等杂质后,进行碱(KOH)法细胞破壁和酶法提取细胞壁多糖,以破壁液中蛋白质含量、多糖提取率为评价指标,通过单因素试验和正交试验优化碱法破壁及酶法提取法多糖工艺条件,以期达到较高的多糖提取率,实现葡萄酒废酵母的综合利用。
1 材料与方法
1.1 材料与试剂
葡萄酒废酵母泥:瑞枫奥赛斯(烟台)葡萄酒庄园有限公司;KOH(分析纯)、浓硫酸(分析纯)、苯酚(分析纯):国药集团化学试剂有限公司;考马斯亮蓝、牛血清白蛋白(bovine serum albumin,BSA)(纯度≥98%)、木瓜蛋白酶(1000U/mg)、碱性蛋白酶(200U/mg)、中性蛋白酶(500U/mg)、蜗牛酶(破壁率>90%):北京索莱宝科技有限公司。
1.2 仪器与设备
KS50R台式高速冷冻离心机:湖南凯达科学仪器有限公司;DC-01低温恒温水浴锅:北京市华瑞科学器材有限公司;KQ-500DE型超声波清洗器:昆山市超声仪器有限公司;G6860型紫外分光光度计:美国安捷伦科技公司;Milli-Q AdvantageA10超纯水系统:默克化工技术(上海)有限公司。
1.3 实验方法
1.3.1 废酵母泥过筛处理
将葡萄酒酵母泥与蒸馏水按照料液比1∶1(g∶mL)混合均匀,平分为A、B、C、D四个样品,分别过60、80、100、120目筛进行除杂筛分,葡萄果皮、果籽等杂质被筛网截留,酵母通过筛网后收集。以酵母泥的得率(OD600nm值)与过滤时间为考察指标,筛选合适的筛目。过筛处理连续进行2次,过筛酵母进行离心(4 000 r/min、20 min)处理。检测标准:酵母泥下层沉淀为白色,上层液体无色透明,除杂后的酵母泥105℃烘干至恒质量。
1.3.2 碱法破壁处理
碱法进行酵母细胞破壁时,选用超声波法进行辅助,超声频率采用80 kHz,功率500 W[2]。选择KOH[17]质量浓度(40 g/L、50 g/L、60 g/L、70 g/L、80 g/L)、碱处理温度(30℃、40℃、50℃、60℃、70℃)、碱处理时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h)三个因素为变量进行单因素试验,破壁液离心(13 000 r/min、20 min)后取上清,用考马斯亮蓝法测定粗蛋白含量,考察各因素对废酵母破壁效率的影响。
碱法破壁工艺优化正交试验的3个主要影响因素为:碱处理温度(A)、碱质量浓度(B)、碱处理时间(C),依据单因素试验结果每个因素选取3个水平,以破壁上清液中蛋白质含量为评价指标衡量破壁效果,通过正交试验来优化破壁工艺条件。
1.3.3 酶法提取细胞壁多糖
破壁酵母液进行离心,沉淀按料水比1∶5(g∶mL)加磷酸盐缓冲液,分别对生物酶种类(木瓜蛋白酶、蜗牛酶、中性蛋白酶、碱性蛋白酶)、加酶量(0.1%、0.2%、0.3%、0.4%、0.5%)、酶解温度(30℃、40℃、50℃、60℃、70℃)、酶解时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h)和酶解初始pH值(4.0、5.0、6.0、7.0、8.0)进行单因素试验。用苯酚-硫酸比色法[14]测定酶解液中的多糖含量,考察各影响因素对多糖提取效率的影响。
酶解法提取细胞壁多糖正交试验的4个主要影响因素为:酶解温度(A)、酶解时间(B)、酶添加量(C)及酶解初始pH值(D),依据单因素试验结果每个因素选取3个水平,通过正交试验来优化提取工艺条件,以获得较高的多糖提取率。
1.3.4 分析检测
蛋白质含量的测定采用考马斯亮蓝法;多糖含量测定采用苯酚-硫酸比色法[14],多糖提取率计算公式如下:
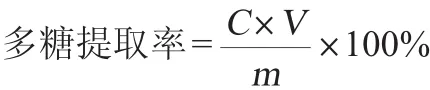
式中:C为上清液中多糖质量浓度,mg/L;V为上清液的总体积,L;m为酵母泥干质量,mg。
2 结果与分析
2.1 废酵母泥过筛处理
由表1可知,从时间角度考虑,60目筛两次过筛时间分别为10 s、10 s,用时最短;从酵母得率角度考虑,80目筛过筛后酵母得率最高,OD600nm为4.247。考虑到60目筛和80目筛的处理时间差别不大,选取80目筛为过筛除杂的最适目数。
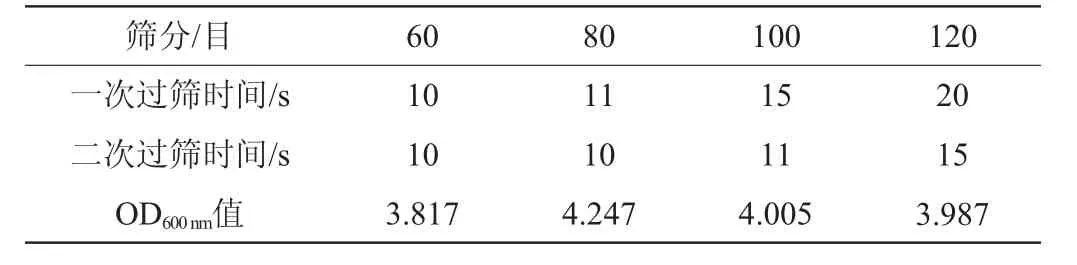
表1 葡萄酒废酵母的预处理条件与结果Table 1 Pretreatment conditions and results of spent yeast of wine
2.2 蛋白质含量测定
以牛血清白蛋白质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制牛血清白蛋白标准曲线如图1所示。由图1可知,牛血清白蛋白标准曲线回归方程为y=0.0061x+0.0200;相关系数R2=0.999,表明二者线性关系良好。
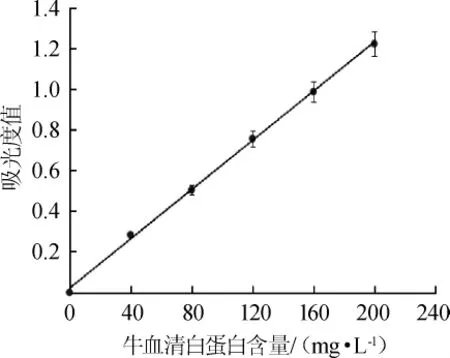
图1 牛血清白蛋白的标准曲线Fig.1 Standard curve of bovine serum albumin
2.3 破壁工艺优化单因素试验
2.3.1 碱质量浓度对废酵母破壁的影响
由图2可知,在碱处理温度为60℃,处理时间为0.5h时,随着碱质量浓度在40~70 g/L范围内的增加,蛋白质含量由76.86 mg/L提高到148.05 mg/L,即废酵母破壁效率不断提高;当碱质量浓度为70 g/L时,蛋白质含量最高,破壁效率最好;当碱质量浓度>70 g/L之后,废酵母破壁效率快速下降。因此,最佳碱(KOH)质量浓度为70 g/L。
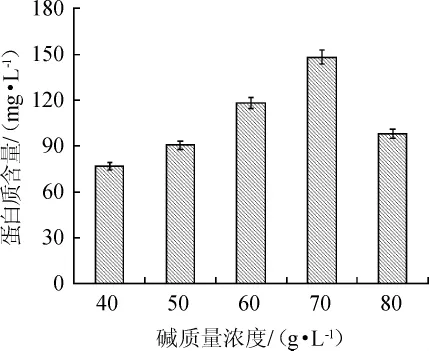
图2 碱质量浓度对废酵母破壁的影响Fig.2 Effects of alkali concentration on cell wall-breaking of spent yeast
2.3.2 碱处理温度对废酵母破壁的影响
由图3可知,在碱质量浓度为70 g/L,处理时间为0.5 h时,随着碱处理温度由30~60℃范围内的升高,蛋白质含量由52.86 mg/L提高到78.09 mg/L,即废酵母的破壁效率不断提高,碱处理温度为60℃时,蛋白质含量最高,破壁效率最好;碱处理温度>60℃之后,蛋白质含量略有下降。因此,最佳碱处理温度为60℃。

图3 碱处理温度对废酵母破壁的影响Fig.3 Effects of treatment temperature of alkali on cell wall-breaking of spent yeast
2.3.3 碱处理时间对废酵母破壁的影响
由图4可知,在碱液质量浓度为70 g/L,碱处理温度为60℃时,碱处理时间在0.5~1.0 h范围内的升高,蛋白质含量由77.28 mg/L提高到91.24 mg/L,即废酵母破壁效率有较大提高,碱处理时间为1.0 h时,蛋白质含量最高。碱处理时间>1.0 h后,蛋白质含量略有下降,酵母破壁效率基本稳定。因此,最佳碱处理时间为1.0h。
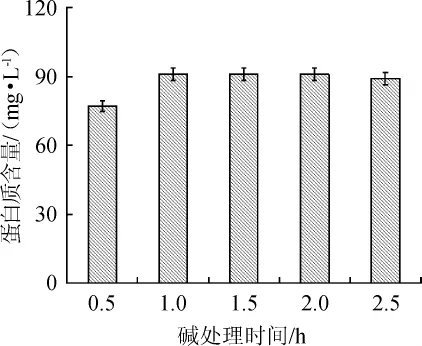
图4 碱处理时间对废酵母破壁效率的影响Fig.4 Effect of treatment time of alkali on cell wall-breaking of spent yeast
2.4 碱法破壁工艺优化正交试验结果
在单因素试验基础上,选取碱处理温度(A)、碱质量浓度(B)、碱处理时间(C)3个影响因素,以破壁上清液中蛋白质含量为评价指标,通过正交试验优化破壁工艺条件,结果与分析见表2。由表2可知,3个因素对破壁效率的影响由大到小排序为碱质量浓度>处理温度>处理时间。最佳破壁工艺条件组合为A2B2C3,即碱处理温度60℃,碱液质量浓度70 g/L,破壁时间1.5 h。在此最佳破壁工艺条件下进行3次验证试验,得到的蛋白质含量为163.21 mg/L。

表2 废酵母破壁工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for technology optimization of cell wall-breaking of spent yeast
2.5 多糖含量标准曲线
以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线如图5所示。由图5可知,葡萄糖标准曲线回归方程为y=0.0274x+0.0013;相关系数R2=0.998,表明二者线性关系良好。
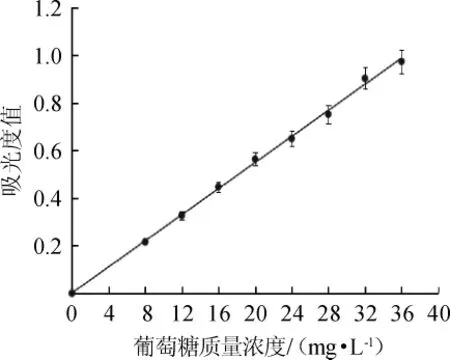
图5 葡萄糖标准曲线Fig.5 Standard curve of glucose
2.6 酶法提取细胞壁多糖工艺优化
2.6.1 酶种类对多糖提取率的影响
由图6可知,在酶添加量为0.2%,pH值为6.0,温度50℃,酶解时间1.0 h的条件下,采用中性蛋白酶的多糖提取率最高,为19.56%。因此,确定最适酶为中性蛋白酶。
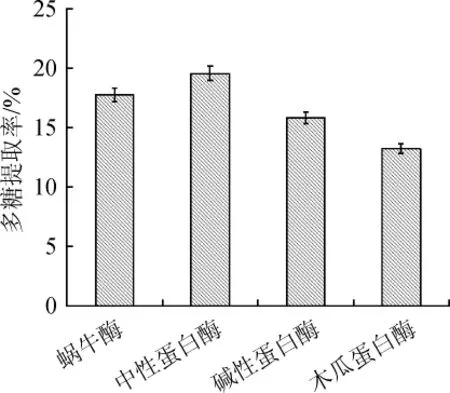
图6 酶的种类对酵母多糖提取率的影响Fig.6 Effect of enzyme types on extraction rate of yeast polysaccharides
2.6.2 酶解时间对多糖提取率的影响
由图7可知,在酶添加量为0.2%,pH值为6.0,酶解温度为50℃的条件下,酶解时间在0.5~1.5 h范围内,多糖提取率由12.52%逐渐增加到19.69%;酶解时间为1.5 h时,达到最高多糖提取率;酶解时间>1.5 h之后,多糖提取率有所下降。因此,最佳酶解时间为1.5 h。
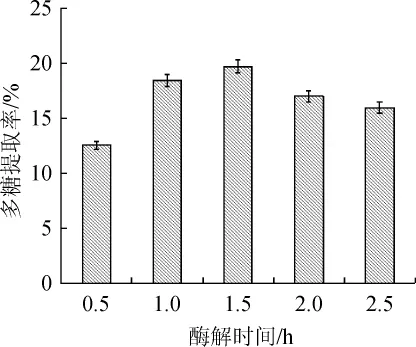
图7 中性蛋白酶的酶解时间对酵母多糖提取率的影响Fig.7 Effect of enzymatic hydrolysis time of neutral protease on extraction rate of yeast polysaccharides
2.6.3 酶解温度对多糖提取率的影响
由图8可知,在酶添加量为0.2%,pH值为6.0,酶解时间为1.0 h的条件下,酶解温度在30~50℃范围内,多糖提取率由13.51%增加到19.53%;酶解温度为50℃时,多糖提取率最高;酶解温度>50℃之后,多糖提取率有所下降。因此,最佳酶解温度为50℃。

图8 中性蛋白酶的酶解温度对酵母多糖提取率的影响Fig.8 Effect of enzymatic hydrolysis temperature of neutral protease on extraction rate of yeast polysaccharides
2.6.4 酶添加量对多糖提取率的影响
由图9可知,在酶处理pH为6.0,酶解时间1.0 h,酶处理温度50℃的条件下,酶添加量在0.1%~0.3%范围内,多糖提取率由16.75%增加到20.16%;酶添加量为0.3%时,多糖提取率最高;酶添加量>0.3%之后,多糖提取率有所下降。因此,最佳酶添加量为0.3%。
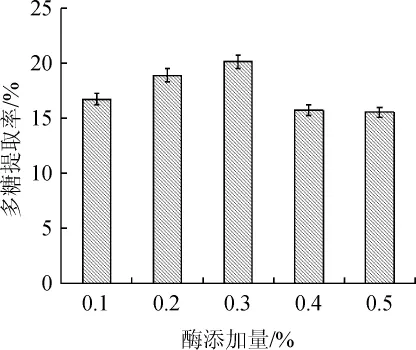
图9 中性蛋白酶添加量对酵母多糖提取率的影响Fig.9 Effect of neutral protease addition on extraction rate of yeast polysaccharides
2.6.5 初始pH值对多糖提取率的影响
由图10可知,在酶添加量为0.2%,酶处理温度为50℃,酶处理时间为1.0 h的条件下,初始pH值在4.0~6.0范围内,多糖提取率由13.35%增加到19.15%;初始pH值为6.0时,多糖提取率达到最大;初始pH值>6.0之后,多糖提取率有所下降。因此,最佳酶解初始pH值为6.0。
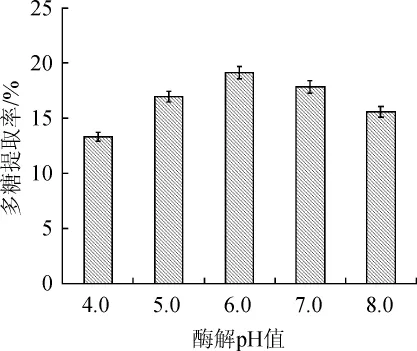
图10 中性蛋白酶的酶解pH对酵母多糖提取率的影响Fig.10 Effect of enzymatic hydrolysis pH of neutral protease on extraction rate of yeast polysaccharides
2.7 酶法提取细胞壁多糖工艺优化正交试验结果
在单因素试验基础上,选取酶解温度(A)、酶解时间(B)、酶添加量(C)及酶解初始pH值(D)4个影响因素,以多糖提取率为评价指标,通过正交试验优化多糖提取工艺条件,结果与分析见表3。
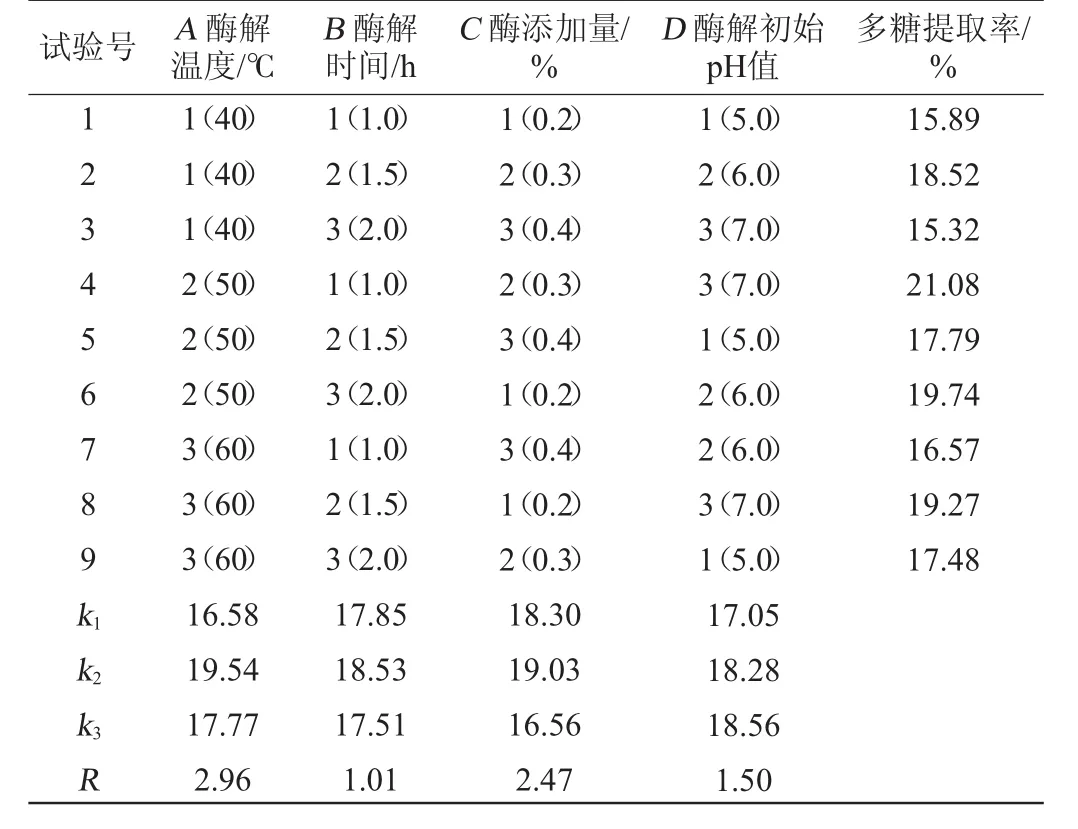
表3 酶法提取多糖工艺优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for enzyme extraction technology optimization of polysaccharides
由表3可知,4个影响因素对多糖提取率的影响由高到低顺序为酶解温度>酶添加量>酶解pH值>酶解时间。最佳多糖提取工艺条件组合为A2B2C2D3,即酶解温度50℃,酶解时间1.5 h,酶添加量0.3%,初始pH值7.0。在此条件下进行3次验证试验,得到的多糖提取率为21.08%。
3 结论
通过单因素试验和正交试验对除杂条件、超声辅助-碱法破壁-酶法提取细胞壁多糖的工艺进行探索,确定的最佳破壁工艺条件为:80目筛过筛除杂;细胞破壁采用70 g/L KOH,60℃下处理1.5 h,80 kHz超声辅助;酶法提取多糖选用中性蛋白酶,最佳提取工艺条件为酶添加量0.3%,酶解温度50℃,酶解时间1.5 h,初始pH值为7.0;酵母细胞壁多糖提取率可达21.08%。研究结果证明,超声辅助-碱-酶复合方法用于酵母细胞破壁和细胞壁多糖提取时,多糖得率较单一方法更高,工业化前景更广阔。本研究结果可为葡萄酒废酵母附加价值的开发利用提供技术参考。

