香豆素和植物激素对北沙参种子萌发的影响
,,, , , ,
(1.河北中医学院,石家庄 050200; 2.安国数字本草检验中心有限公司,河北 安国 071200)
北沙参为伞形科植物珊瑚菜(GlehniaLittoralisFr.Schmidt ex Miq.)的干燥根,是我国传统中药材,具有养阴清肺,益胃生津的功效[1],主产河北、山东、辽宁、内蒙等省区[2]。北沙参主要以种子进行繁殖,北沙参种子为深度休眠型[3],发芽率很低[4],严重制约着北沙参的规模化栽培种植发展。
北沙参种子发芽较低,一是因为种子成熟度不够,胚尚未发育完全即成熟脱落;二是因为种子内含有发芽抑制物——香豆素,香豆素是最早被认为休眠诱导物的物质之一[5],其衍生物在自然界中广泛分布,在萌发种子中能迅速代谢,对北沙参种子的萌发有一定的抑制作用;三是因为种子霉变等因素的影响。在北沙参种子的贮藏和层积过程中,种子胚乳发霉、糜烂等现象导致种子丧失了萌发力。
植物激素指植物细胞接受特定环境信号诱导产生的、低浓度时可调节植物生理反应的活性物质。它们在细胞分裂与伸长、组织与器官分化、开花与结实、成熟与衰老、休眠与萌发以及离体组织培养等方面,分别或相互协调地调控植物的生长、发育与分化。植物激素主要有生长素(Auxin)、赤霉素(GA)、细胞分裂素(CTK)、脱落酸(abscisic acid,ABA)、乙烯(ethyne,ETH)和油菜素甾醇(brassinosteroid,BR)。这些虽然是简单的小分子有机化合物,但它们的生理效应却非常复杂、多样,从细胞的分裂、伸长、分化,到种子的休眠、发芽、生根以及植物的开花、结果、脱落等方面有着重要的调节控制作用[6-9]。
本研究对干燥存储1年、干燥存储6个月以及低温沙藏3个月的北沙参种子进行4种植物激素(IAA、CTK、GA3、ABA)和5种香豆素成分(补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素)的含量测定,以期分析不同保存时间的北沙参种子中植物激素和香豆素类成分的含量变化以及二者之间的关系,为深入研究北沙参种子的萌发机制提供参考。
1 实验材料
北沙参种子由河北省安国市怡康药业提供,经河北中医学院郑玉光教授鉴定为伞形科珊瑚菜(GlehnialittoralisFr.Schmidt ex Miq.)的种子。样品信息见表1。
表1 北沙参种子信息
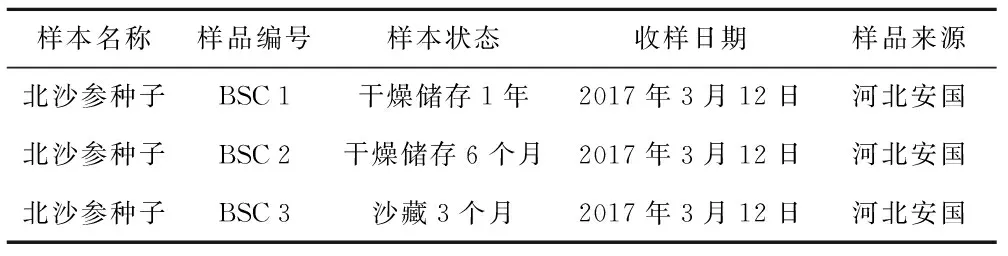
样本名称样品编号样本状态收样日期样品来源北沙参种子BSC1干燥储存1年2017年3月12日河北安国北沙参种子BSC2干燥储存6个月2017年3月12日河北安国北沙参种子BSC3沙藏3个月2017年3月12日河北安国
2 实验仪器与试剂
2.1 实验仪器
Agilent 1100型高效液相色谱仪(美国安捷伦公司);CPA 225 D电子分析天平(赛多利斯(上海)贸易有限公司);KQ-300 VDE型三频数显超声波清洗器(昆山市超声仪器有限公司);GL-20 G-II型高速冷冻离心机(上海安亭科学仪器厂);Eporch酶标仪(伯乐生命医学产品(上海)有限公司);DGG-101-2 BS型电热鼓风干燥箱(天津天宇实验仪器有限公司)。
2.2 实验试剂
欧前胡素对照品(批号:ST 02340120 MG)购自上海诗丹德有限公司,花椒毒素对照品(批号:FY 132301109)、佛手柑内酯对照品(批号:FY 12320913)购自南通飞宇生物技术有限公司,以上3种对照品纯度均大于98%,补骨脂素对照品(批号:110739-201617,按99.7%计)、异欧前胡素对照品(批号:110827-201611,按99.4%计)购自中国食品药品检定研究院。色谱纯乙腈(默克),甲醇、乙醇为分析纯,水为纯净水。
植物激素脱落酸(ABA)酶联免疫分析试剂盒(ELISA)(批号04/2017)、植物细胞分裂素(CTK)酶联免疫分析试剂盒(ELISA)(批号04/2017)、植物吲哚乙酸(IAA)酶联免疫分析试剂盒(ELISA)(批号04/2017)、植物赤霉素3(GA3)酶联免疫分析试剂盒(ELISA)(批号04/2017)均购于上海酶联生物科技有限公司。
3 实验方法
3.1 北沙参发芽实验
从北沙参种子中用镊子挑选个大、饱满的净种子,在25 ℃室温下经清水浸泡24 h。向培养盒及镊子上喷洒少量75%的酒精进行消毒处理,紫外灯照射1 h进行灭菌处理。在超净工作台中将已高温高压灭菌的滤纸平贴在已进行消毒灭菌过的培养盒中,喷洒清水润湿滤纸,用镊子夹取北沙参种子30粒,整齐排列于培养盒的滤纸上,放入培养箱中,保持温度25 ℃,湿度60%,光照66%,光周期为10 h黑暗,14 h光照。 每日观察,补充水分,挑出霉烂种子,并记录各发芽床中的发芽数。
3.2 北沙参种子香豆素类含量测定
采用HPLC法对北沙参种子中的补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素进行含量测定。
3.2.1 色谱条件
根据预实验的实验结果,筛选的色谱条件为:Dikma色谱柱:C 18(250 mm×4.6 mm,5μm);流动相:乙腈(A)-0.1%磷酸(B),梯度洗脱(0~18 min,24%→30%A;18~29 min,30%→49%A;29~33 min,49%→72%A;33~40 min,72%A);流速:1.0 mL/min;检测波长:295 nm;柱温:30 ℃;进样量:20μL。
3.2.2 混合对照品溶液制备
分别精密称取欧前胡素7.60 mg、花椒毒素9.40 mg、佛手柑内酯9.0 mg、补骨脂素8.90 mg、异欧前胡素10.10 mg置于5个100 mL的容量瓶中,加入甲醇溶解并定容,制得欧前胡素、花椒毒素、佛手柑内酯、补骨脂素、异欧前胡素的质量浓度分别为0.074 5,0.093 8,0.089 8,0.088 7,0.100 4 mg/mL的对照品贮备液。将以上单一对照品溶液进行等体积混合,制成混合对照品溶液。
3.2.3 供试品溶液制备
种子用水浸泡24 h后取出(与激素含量测定的种子一起浸泡,浸泡时间相同),低温40.0 ℃烘干,打粉后过4号药典筛,精密称定约2 g,分别置于50 mL锥形瓶中,加入75%乙醇25 mL,称重,超声(功率500 W,频率40 kHz)提取30 min,放冷,用75%乙醇补足减失的重量,滤过,取续滤液,经0.45μm微孔滤膜滤过,即得。每批制备3个平行样。
3.2.4 线性方程及样品含量测定
按“3.2.1”项下色谱条件进样测定,得到补骨脂素、花椒毒素、佛手柑内酯、欧前胡素、异欧前胡素的线性方程。根据线性方程及样品的峰面积计算出样品中香豆素类成分含量。
3.3 植物激素类检测方法
3.3.1 样品前处理
种子用水浸泡24 h后取出用吸水纸将其表面吸干,称取北沙参种子样本,同时加入9倍体积的PBS进行研磨(研钵需进行预冷),4 ℃冰箱内浸提1 h,3 000 r/min离心30 min,取上清液备用。
表4 北沙参种子中香豆素含量 (n=3)
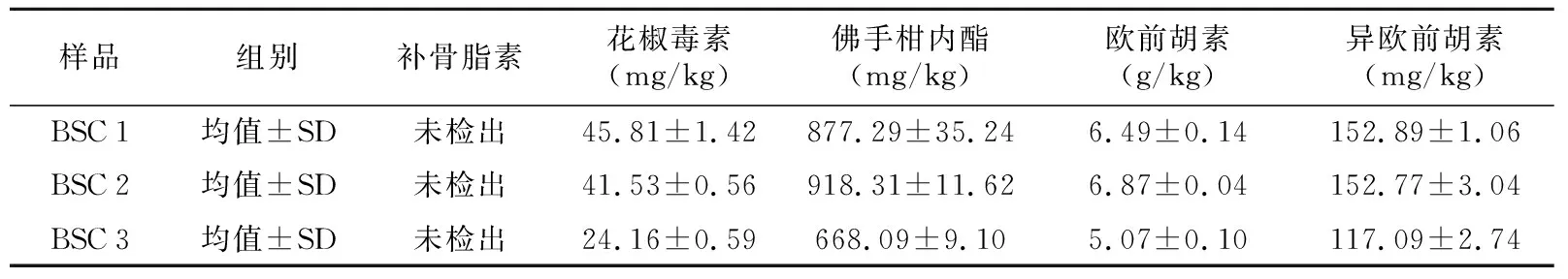
样品组别补骨脂素花椒毒素(mg/kg)佛手柑内酯(mg/kg)欧前胡素(g/kg)异欧前胡素(mg/kg)BSC1均值±SD未检出45.81±1.42877.29±35.246.49±0.14152.89±1.06BSC2均值±SD未检出41.53±0.56918.31±11.626.87±0.04152.77±3.04BSC3均值±SD未检出24.16±0.59668.09±9.105.07±0.10117.09±2.74
3.3.2 ELISA实验步骤
1) 标准品的加样:设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μL。
2) 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40μL,然后再加待测样品10μL(样品最终稀释度为5倍)。加样时将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3) 加酶:每孔加入酶标试剂100μL,空白孔除外。
4) 温育:用封板膜封板后置37 ℃温育60 min。
5) 配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。
6) 洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。
7) 显色:每孔先加入显色剂A 50μL,再加入显色剂B 50μL,轻轻震荡混匀,37 ℃避光显色15 min。
8) 终止:每孔加终止液50μL,终止反应(此时蓝色立转黄色)。
9) 测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。 测定应在加终止液后15 min以内进行。
10) 计算:以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度,再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD 值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
4 实验结果
4.1 不同贮藏方法对北沙参种子发芽率的影响
将3种不同贮藏方式下的北沙参种子进行发芽实验,结果发现,经低温沙藏后的种子BSC 3发芽率最高,而干燥贮藏6个月以上的种子BSC 2发芽率很低,干燥贮藏时间越长种子发芽率越低,干燥贮藏1年的种子基本失去发芽能力。
4.2 北沙参种子中香豆素含量的检测
4.2.1标准曲线
取对照品贮备液适量,采用逐级依次稀释,制得一系列质量浓度的对照品溶液,按“3.2.1”项下色谱条件进样测定,记录峰面积,以质量浓度(x,mg/mL)为横坐标、峰面积(y)为纵坐标进行线性分析得到线性回归方程(见表3)。标准曲线的R2均为0.99左右,说明后续结果可信。
表2 3种不同贮藏方式下的北沙参种子的发芽率
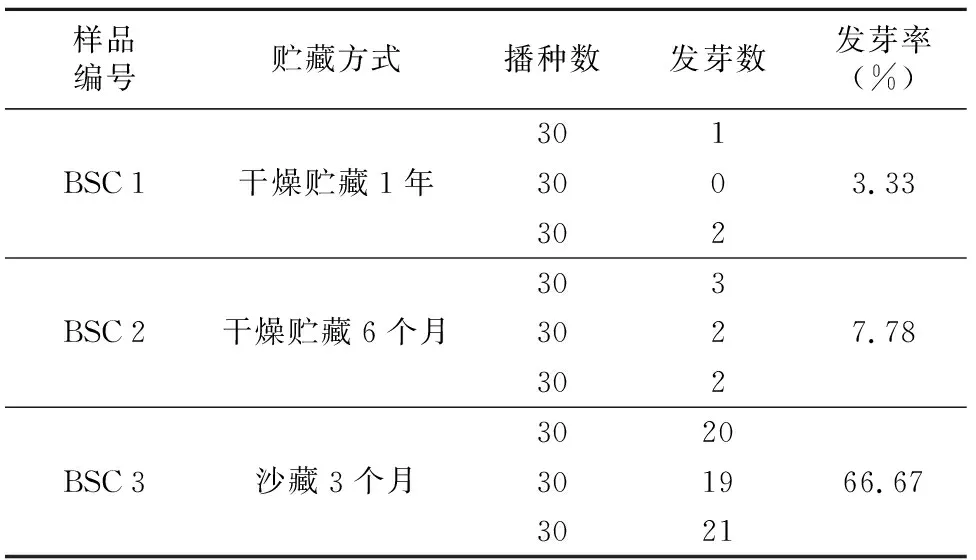
样品编号贮藏方式播种数发芽数发芽率(%)301BSC1干燥贮藏1年3003.33302303BSC2干燥贮藏6个月3027.783023020BSC3沙藏3个月301966.673021
表3 香豆素各成分检测回归方程

指标回归方程R2补骨脂素y=76201x+15.0320.9996花椒毒素y=64478x+21.6650.9998佛手柑内酯y=62568x-115.510.9994欧前胡素y=51454x+40.5860.9993异欧前胡素y=48766x+106.110.9994
4.2.2 北沙参种子中香豆素类含量检测结果
在3种北沙参种子的香豆素含量检测中,补骨脂素未检出,说明北沙参种子中的补骨脂素含量较低。在北沙参种子中含量较高的为佛手柑内脂,最高可达918 mg/kg。对于干燥贮藏的北沙参种子BSC 1和BSC 2,二者所含的香豆素类成分大致相当,而经过低温沙藏的北沙参种子BSC 3中的香豆素类各成分都明显低于BSC 1和BSC 2(见表4),说明在北沙参种子低温沙藏的过程中,香豆素类的成分在逐渐减少,对种子萌发的抑制作用也在逐渐降低。
4.3 植物激素含量检测结果
4.3.1 标准曲线
利用ELASA的方法检测北沙参种子中的4种植物激素的含量,首先利用植物激素的标准品进行了标准曲线的检测,标准曲线的R2均为0.99左右(表5),说明后续结果可信。
表7 香豆素和植物激素含量相关性分析
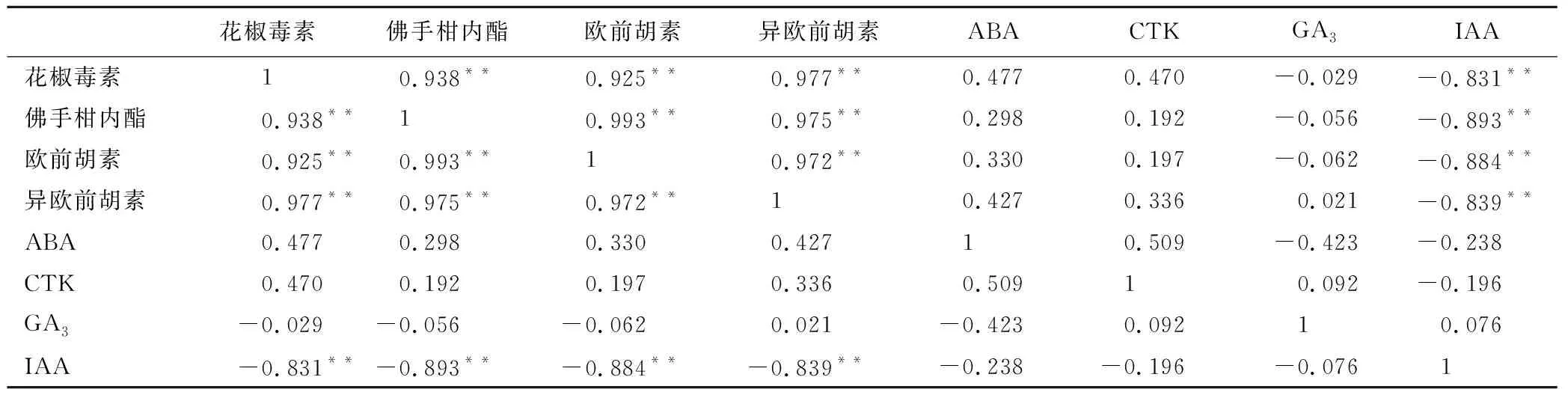
花椒毒素佛手柑内酯欧前胡素异欧前胡素ABACTKGA3IAA花椒毒素10.938**0.925**0.977**0.4770.470-0.029-0.831**佛手柑内酯0.938**10.993**0.975**0.2980.192-0.056-0.893**欧前胡素0.925**0.993**10.972**0.3300.197-0.062-0.884**异欧前胡素0.977**0.975**0.972**10.4270.3360.021-0.839**ABA0.4770.2980.3300.42710.509-0.423-0.238CTK0.4700.1920.1970.3360.50910.092-0.196GA3-0.029-0.056-0.0620.021-0.4230.09210.076IAA-0.831**-0.893**-0.884**-0.839**-0.238-0.196-0.0761
注:“**”表示在 0.01水平(双侧)上显著相关。
表5 植物激素检测回归方程

指标回归方程R2IAAy=0.0667x-0.00540.9979GA3y=0.0136x+0.03270.9963CTKy=0.0289x-0.01770.9976ABAy=0.0267x+0.03530.9992
4.3.2 4种植物激素含量检测结果
4种植物激素检测的结果表明,随着贮藏时间的延长,北沙参种子中ABA、CTK和GA3含量略有升高,其含量的基本情况是BCS 1>BCS 2>BCS 3,说明随着贮藏时间的延长以及干燥程度的加深,种子失去更多的水分,从而使ABA、CTK和GA3相对含量增加。但是IAA的含量并不因贮藏时间的延长而增加,干燥贮藏1年和6个月的北沙参种子中IAA的含量相当,而经过低温沙藏的种子其IAA的含量则明显高于干燥贮藏的种子(表6),说明在低温沙藏的过程中,随着抑制种子萌发的香豆素类的明显减少(表4),与种子萌发相关的IAA开始大量合成,为种子的萌发做准备。
表6 北沙参种子中植物激素含量(n=3)
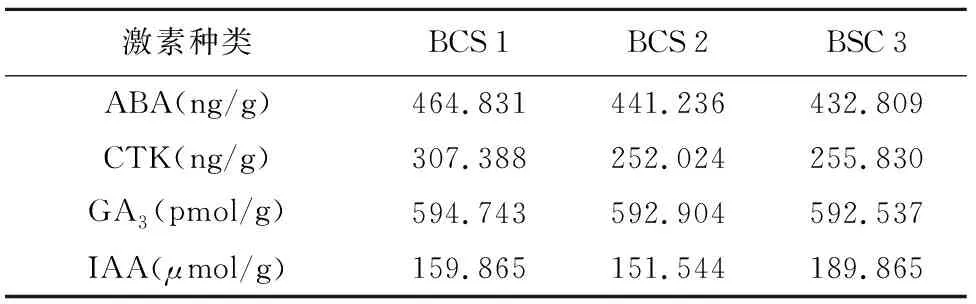
激素种类BCS1BCS2BSC3ABA(ng/g)464.831 441.236 432.809 CTK(ng/g)307.388 252.024 255.830 GA3(pmol/g)594.743592.904592.537IAA(μmol/g)159.865151.544189.865
4.4 北沙参种子中香豆素和植物激素含量相关性分析
用SPSS 19.0软件分析香豆素含量和植物激素含量之间的关系,结果见表7。香豆素的4种成分花椒毒素、 佛手柑内脂、欧前胡素和异欧前胡素含量之间呈极显著正相关(p<0.01),而这4种成分和植物激素中的ABA、CTK和GA3的关系不明显,只是和IAA呈极显著负相关关系(p<0.01)。说明香豆素的各个成分作为抑制种子萌发物质其作用是相似的,而在种子萌发时,香豆素成分会逐渐减少,随之而来的是促进种子萌发的IAA的水平的升高。
5 讨 论
种子的休眠是抑制种子萌发的主要因素,种子的休眠一般分为5种类型:生理休眠、形态休眠、形态生理休眠、物理休眠和联合休眠。北沙参的种子属于典型的形态生理休眠,它的种子在萌发前要进行解除休眠的预处理而且预处理的时间较长[10]。这主要是因为北沙参中含有较多的香豆素类成份。香豆素类又称为化感物质[11],目前多数的研究都集中在化感物质对种子萌发的抑制作用[12-14]。本研究中,随着干燥贮藏的时间延长,北沙参种子中香豆素类成分对种子萌发的抑制作用越明显,而经过低温沙藏处理之后的香豆素类则明显减少,相应的种子的萌发力也明显升高。
植物激素是调控种子休眠和萌发的重要内源性因素[15],以往的研究证明ABA和GA3在调控植物种子萌发的过程中起到了重要的作用,但最近的研究表明,IAA在植物种子的休眠和萌发中也起着重要的正向调控作用[16]。本研究中,干燥贮藏的北沙参种子的植物激素似乎没有太大的变化,而经过低温沙藏的种子中,IAA的含量明显增高,相应的其萌发率也升高。
在植物种子萌发的过程中,化感物质能够影响植物种子萌发过程中植物激素的含量,打破植物内源激素的平衡,从而导致种子无法萌发[11]。有研究表明,黄酮类化感物质可以明显的抑制独行菜的种子中GA3氧化酶活性,进而抑制种子的萌发[17-18],而香豆素类化感物质可以明显的降低多花黑麦种子中吲哚乙酸氧化酶(IAAO)的活性,从而抑制种子萌发[19]。因此,在本研究中,经过低温沙藏处理的北沙参种子中香豆素含量明显降低,对于IAAO的抑制作用也相应降低,从而使IAA的合成加速,IAA含量明显升高,为种子的萌发做好了准备。

