经自然腔道取标本手术联合Parks术在低位直肠癌保肛手术中的临床研究
陈海鹏,赵志勋,关 旭,周海涛,梁建伟,姜 争,刘 正,杨 明,王锡山
(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院,北京,100021)
低位直肠癌手术的保肛问题,一直是结直肠外科治疗领域的热点。一方面由于其特殊的解剖学部位,尤其盆腔狭窄或肥胖患者,一定程度上增加了保肛手术的难度。另一方面,尽管目前的一些术式能完成解剖学上的“保肛”,但术后控便功能也是评价低位直肠癌术后效果的重要指标[1-2]。1982年Parks提出经腹完成肠管切除,然后通过肛门进行消化道吻合,相关研究结果证实了其安全性[3-4]。与此同时,随着近年经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)在结直肠肿瘤治疗中的兴起,我们想能否将两种治疗理念进行整合,继而用于低位直肠癌的外科治疗[5]。在此启发下,近期我们完成一系列腹部无辅助切口经肛门切断拉出标本、乙状结肠肛管单层吻合的腹腔镜下超低位直肠肿瘤手术,并将其命名为NOSES I式C法(NOSES IC)。本文通过与传统腹腔镜低位前切除(laparoscopic anterior resection,LAR)及其他低位直肠癌NOSES手术方式[6]进行对比,深入探讨NOSES IC在低位直肠癌保肛手术中的作用。
1 资料与方法
1.1 临床资料 本研究采取非随机回顾性研究,选取2017年5月1日至2017年12月31日于中国医学科学肿瘤医院结直肠外科就诊并行腹腔镜手术的直肠癌患者。其中男38例,女29例,根据手术方式分为3组:NOSES IC组、NOSES IA组及LAR组。入选标准:(1)患者均经术前肠镜诊断并结合肛门指诊,肿瘤下缘距肛缘<5 cm;(2)经组织病理学证实为腺癌或黏液腺癌;(3)术前MRI及CT证实肿瘤未侵及邻近器官且无远处转移。排除标准:(1)盆腹腔手术史;(2)肿瘤复发或多原发肿瘤;(3)行预防性造口;(4)术前接受新辅助治疗。
1.2 手术方法
1.2.1 手术准备 全麻后患者取截石位。常规术区消毒,采用五孔法施术,脐内10 mm为观察孔,右下腹(脐与右髂前上棘连线中外1/3偏下处)12 mm Trocar为术者主操作孔,右腹(脐右侧10 cm)、左下腹(与右侧孔对称)3枚5 mm Trocar为辅助操作孔。
1.2.2 组织游离及淋巴结清扫 常规腹腔镜进腹探查,腹腔内其他脏器未见明显异常,无腹水。肿瘤位于腹膜返折下方无法视及,肠系膜未见明显肿大淋巴结。采用中央入路,切开乙状结肠系膜后腹膜融合部,上至肠系膜下动脉根部,下至直肠膀胱陷凹,注意保护盆腔自主神经,清扫系膜根部淋巴脂肪组织,结扎切断肠系膜下动、静脉,向下方锐性分离直肠后间隙,游离直肠系膜达盆底,注意保护下腹下神经及盆丛;沿Toldt间隙向外侧游离,注意鉴别及保护左侧输尿管、生殖血管,以纱布覆盖表面予以保护。沿乙状结肠系膜左侧根部及降结肠旁沟侧腹膜融合部处切开,充分游离近端结肠,必要时可行降结肠脾区的游离,按直肠全系膜切除术原则分离直肠并向盆腔部延长至盆底,向下方与对侧游离界面相会合。沿邓氏筋膜前后叶之间分离直肠前壁,向下方离断邓氏筋膜后叶。分离直肠两侧壁至肛提肌裂孔,直至齿状线水平。
1.2.3 标本取出及消化道重建
1.2.3.1 NOSES IC组 应用拉钩完全展开肛门显露直肠,充分消毒,于齿状线上0.5 cm处切开直肠,电刀离断直肠全层(避免损伤内括约肌),常规直视下经肛门送检下切缘行术中冰冻病理检查(保证术中病理阴性),经肛门拉出近端肠管及肠系膜,于体外离断预切除肠段,确切止血,切除标本送检术后病理。碘伏生理盐水冲洗盆腔,探查无出血后开始重建消化道,行乙状结肠肛管手工单层吻合。经肛管远端由黏膜层入针浆膜出针,再经乙状结肠浆膜入针黏膜层出针,分别于3、6、9、12点钟方向先行缝合四针,在每个象限中加固3~4针,针距0.3~0.5 cm为宜,完成乙状结肠-肛管端端单层吻合。注水充气试验阴性,冲洗腹腔及盆腔创面,确切止血,盆腔内置双乳胶管引流经腹壁引出。常规留置肛管,不常规行预防性末段回肠造口术。见图1~图5。
1.2.3.2 NOSES IA组[7]助手扩肛冲洗肠管后,在卵圆钳辅助下,将管型吻合器抵钉座经肿瘤对侧肠腔滑入直肠;送至近端乙状结肠预切线处以上,直线型切割闭合器将抵钉座封闭于乙状结肠近端肠管处,助手经肛门置入卵圆钳,与术者配合夹持直肠残端,将直肠外翻于肛门口外,距肿物下缘2 cm以弧形切割缝合器切断直肠,残端还纳。腔镜下于乙状结肠封闭处开一小孔,穿出抵钉座中心杆,经肛门置入吻合器体部,完成直肠乙状结肠端端吻合,充气注水试验确认吻合口通畅,无渗漏、出血,吻合确切,生理盐水冲洗腹腔,盆腔内留置双乳胶管引流经腹壁引出,解除气腹,关闭Trocar孔,手术结束。
1.2.3.3 LAR组 完成肿瘤游离后,助手扩肛冲洗肠管,使用直线型切割闭合器于肿瘤下方预切线处切断并封闭肠管,然后于腹壁上做5~10 cm切口,于肿瘤上方预切线切断肠管并移除肿瘤,置入吻合器抵钉座后直视下完成乙状结肠直肠端端吻合。其余步骤同1.2.3.2。
1.3 观察指标 收集入组患者的基本信息、围手术期相关指标,并观察对比术后并发症情况。术后采用WHO疼痛分度,0度:不痛;Ⅰ度:轻度痛,为间歇痛,可不用药;Ⅱ度:中度痛,为持续痛,影响休息,需用止痛药;Ⅲ度:重度痛,为持续痛,不用药不能缓解;Ⅳ度:严重痛,为持续剧痛伴血压、脉搏等变化。术后1年进行随访,采用Wexner失禁评分评价患者术后肛门功能,此评分包括五部分,每项0~4分,满分20分,分数越高代表肛门功能越差。其中0分代表功能正常,1~10分表示控便良好,11~19分代表大便失禁,20分表示完全失禁。

2 结 果
2.1 患者一般情况的比较 3组患者性别、年龄、BMI、术前CEA、术前CA19-9、肿瘤最大径及肿瘤分期等基本资料差异无统计学意义(P>0.05)。见表1。
2.2 围手术期临床指标的比较 与NOSES IA组相比,NOSES IC组在手术时间、术中出血量、术后首次排气时间、术后住院时间及疼痛程度方面差异无统计学意义。而与LAR组相比,NOSES IC组排气时间更短(P=0.008),患者术后疼痛更加轻微(P=0.016),其他指标两组差异无统计学意义。见表2。
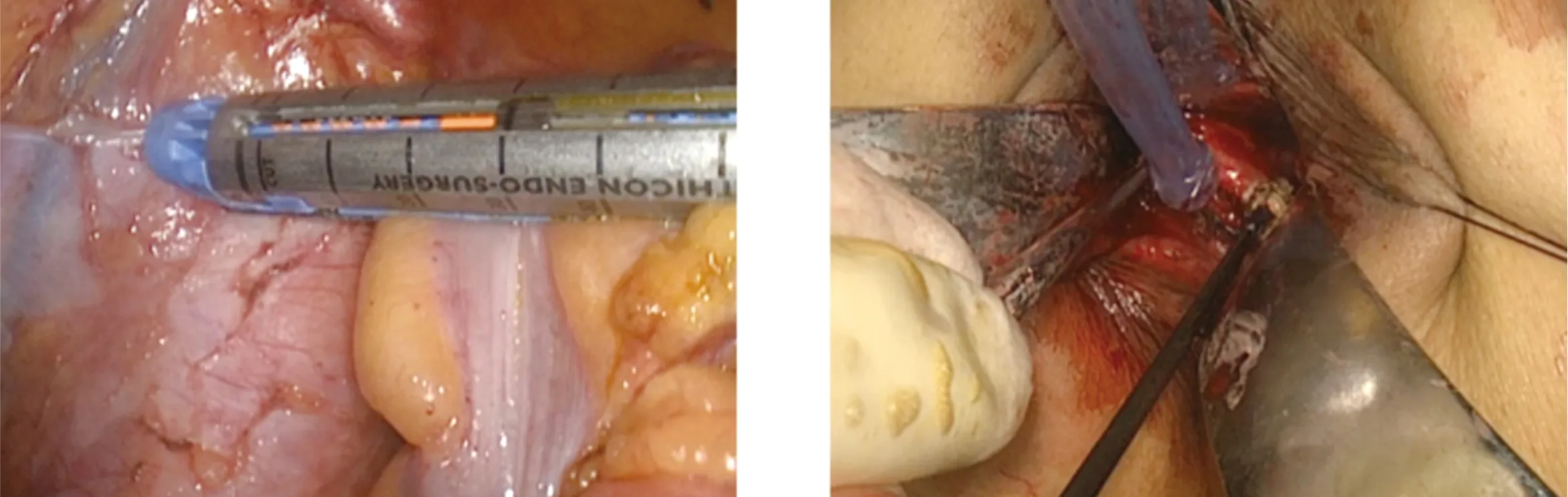
图1 于肿瘤上方预切线处切断闭合肠管 图2 经肛门距齿状线上0.5 cm切开直肠
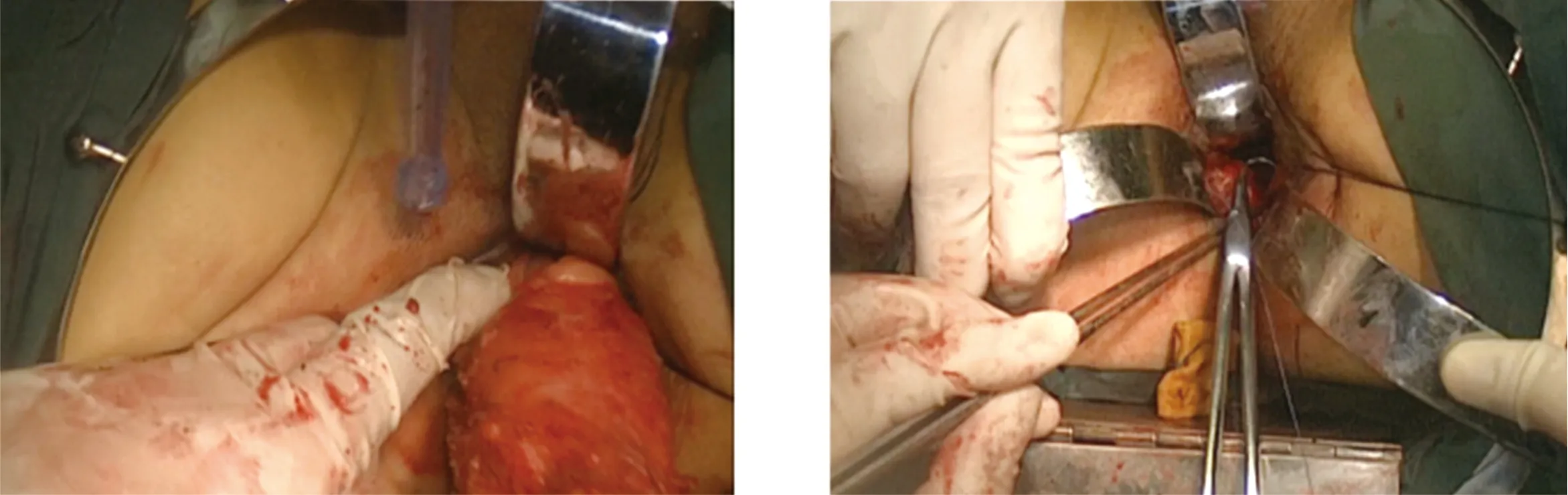
图3 经肛门拉出近端肠管及肠系膜 图4 经肛管远端由黏膜层入针浆膜出针,再经乙状结肠浆膜入针黏膜层出针,缝合12~18针

图5 完成乙状结肠-肛管端端单层吻合
2.3 术后并发症的比较 3组均未出现围手术期死亡,仅NOSES IA组发生1例吻合口漏、1例腹腔感染,LAR组发生1例腹腔感染。其他患者未出现明显术后并发症。3组患者并发症发生率差异无统计学意义。见表2。
2.4 肛门控便功能的比较 在术后12个月的随访中,54例患者完成了术后肛门功能的评价,共9例患者肛门Wexner评分>10分,控便功能较差。3组患者在肛门功能方面差异无统计学意义。见表2。
3 讨 论
NOSES用于结直肠肿瘤治疗方面的专家共识已经形成。NOSES不仅保证了结直肠肿瘤的根治性,还表现出优秀的微创效果,堪称为“微创中的微创”。相关研究已证实,直肠癌经直肠或阴道取标本的NOSES术后患者恢复良好,未发生直肠或阴道相关并发症[5,8-9]。此外,多项研究结果也表明,结直肠NOSES的手术时间、术中出血量、淋巴结清扫数量与常规腹腔镜手术相比差异无统计学意义,且术后首次排气时间短、腹壁功能障碍少[10-11]。腹壁无切口使患者所受手术创伤更小,术后疼痛程度明显减轻,较舒适,且腹壁几乎无可见疤痕,达到了美容效果。如果适应证掌握合理,NOSES可达到绝佳的损伤效益比。低位直肠癌保肛手术目前仍是外科界的难点之一。随着吻合器的不断改进、发展及术者技术水平的提高,直肠癌手术保肛率得到明显提高[3]。但低位直肠癌由于特殊的解剖位置及周围脏器的密切关系,使保肛手术增加了一定难度。目前直肠癌多采用双吻合器吻合,增加了保肛的机会,但由于吻合器尺寸的限制,对骨盆狭窄及肥胖患者闭合器很难在盆底肌平面切断闭合直肠[12]。这类距齿状线3~4 cm低位、超低位直肠癌患者也难以借助双吻合器达到保肛目的。Parks于1982年提出了经腹直肠癌切除术、经肛门结肠肛管吻合的术式,后经许多学者证实此术式在不影响长期疗效的前提下,为更多的直肠癌患者提供了保肛机会,且弥补了双吻合器对低位直肠癌保肛手术的不足[1,13-15]。
表1 3组患者临床资料的比较(n)
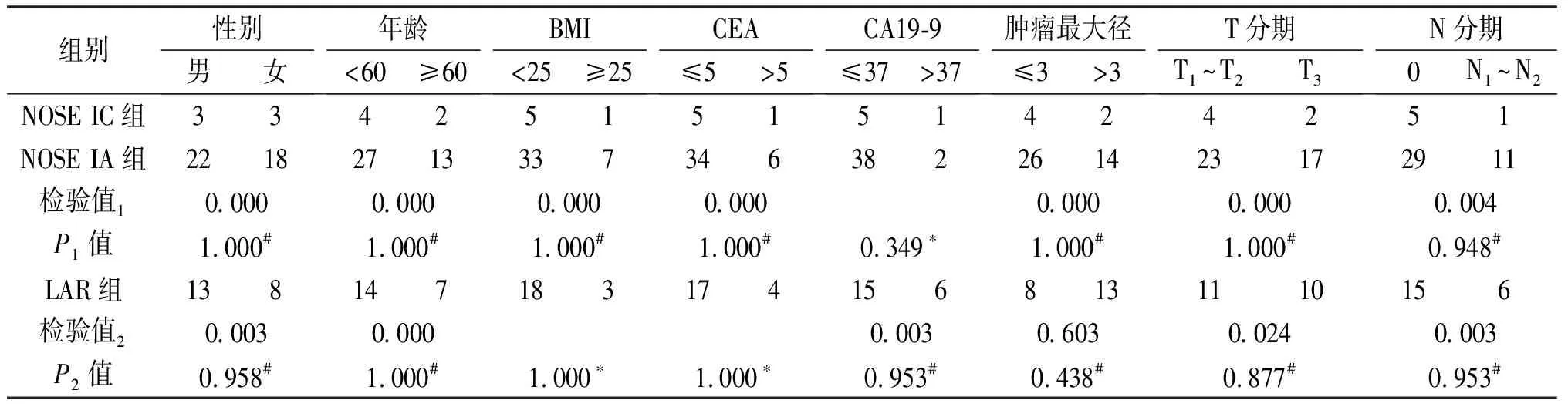
组别性别男女年龄 <60≥60BMI<25≥25CEA≤5>5CA19-9 ≤37>37肿瘤最大径≤3>3T分期T1~T2T3N分期0N1~N2NOSE IC组3342515151424251NOSE IA组22182713337346382261423172911检验值10.0000.0000.0000.0000.0000.0000.004P1值1.000#1.000#1.000#1.000#0.349∗1.000# 1.000#0.948#LAR组1381471831741568131110156检验值20.0030.0000.0030.6030.0240.003P2值0.958#1.000#1.000∗1.000∗0.953#0.438#0.877#0.953#
BMI:身体质量指数(body mass index)。检验值1、P1表示NOSE IC组与NOSE IA组之间的比较;检验值2、P2表示NOSE IC组与LAR组之间的比较。#代表连续校正χ2检验,*代表Fisher精确检验。
表2 3组患者手术相关指标的比较

组别手术时间(min)术中出血量(mL)肛门排气时间(d)术后住院时间(d)疼痛分级(n)0~ⅠⅡ~Ⅳ度并发症(n)吻合口漏腹腔感染合计Wexner评分≤10>10NOSE IC组171.7±39.746.7±20.72.5±0.58.7±1.24200051NOSE IA组175.9±34.731.1±20.22.3±0.910.7±4.0246112275检验值10.344-1.937-0.5231.1170.000P1值0.7380.0700.6440.2821.000#1.000∗1.000∗LAR组153.1±28.278.1±62.33.5±0.78.7±1.1219011133检验值2-0.7341.1472.8720.0005.820P2值0.4760.3450.0081.0000.016#1.000∗1.000#
注:检验值1、P1表示NOSE IC组与NOSE IA组之间的比较;检验值2、P2表示NOSE IC组与LAR组之间的比较。#代表连续校正χ2检验,*代表Fisher精确检验。
NOSES IC既是对NOSES手术体系的完善,也是对传统Parks手术完美的升华,使传统术式焕发了新的生命力。本文通过与传统LAR相比,证实其排气时间更短、疼痛更加轻微,而与NOSES IA相比,发现两者在围手术期指标、术后并发症及控便功能方面差异无统计学意义。因此从短期疗效来看,NOSES IC可作为新的NOSES术式,用于低位直肠癌的外科治疗。
笔者认为NOSES IC术式具有以下优势[2,16-17]:(1)在保证直肠癌根治的前提下,充分发挥了NOSES手术“微创中的微创”的特点,术后损伤小、疼痛轻、康复快,符合快速康复外科的理念。(2)经肛门切断拉出标本、乙状结肠肛管单层吻合。可吸收线缝合两端,形成完整均匀一致的“吻合口”,因可吸收线组织相容性好,减少了吻合钉与组织相容不良的弊端,降低了机体的免疫、炎症反应,减少了吻合口狭窄的可能[16]。(3)最大限度保护肛管内外括约肌,保留肛门功能,充分保证了术后控便功能。(4)直肠癌保肛手术多采用双吻合器吻合,因肿瘤位置超低,预留直肠远端因肿瘤致组织反应性水肿重、缺血等影响因素明显,吻合口漏发生率增高,此术式无对端吻合,有效避免了因吻合口水肿、缺血、感染导致的吻合口漏。我们选择手术患者的标准为:心肺功能可耐受长时间腔镜手术;有强烈保肛要求;肿瘤分化程度好(为中、高分化腺癌),临床分期早(T1~T2期),术前肛门功能良好,此外,术前充分告知患者术后可能出现控便功能异常及排便习惯改变等情况。NOSES I式C法目前完成6例,术后均未出现明显并发症,控便功能良好,远期并发症尚待观察。笔者建议术中常规行下切缘术中病理检查,这不仅是对患者负责,更是对术者自身的保护。
自2013年7月起,笔者团队开始开展结直肠肿瘤NOSES,目前我们已开展500余例结直肠肿瘤NOSES。此外,由于接受NOSES的患者多为早期患者,因此其远期疗效也会颇为可观[8]。NOSES是传统术式与腹腔镜技术的完美结合,使结直肠肿瘤手术更加丰富,在保证根治效果的同时,增加了低位直肠癌患者的保肛几率,一举数得。尽管目前开展例数有限,且缺乏长期随访结果,但笔者认为随着技术的发展,NOSES会适用于更多的学科,发挥其独有特点,使患者获益。

