83例苯丙酮尿症患者pah基因大片段缺失的检测
张 展,刘 昕,高峻峻,王 萍,朱琳琳,史许锋,常爱民
(1.郑州大学第三附属医院检验科,河南郑州 450052;2.新乡医学院检验学院,河南新乡453000;3.河南省人民医院妇产科,河南郑州 450052)
苯丙酮尿症(phenylketonuria,PKU)是新生儿最常见的氨基酸代谢障碍性疾病,是因苯丙氨酸羟化酶基因(phenylalanine hydroxylase gene,pah,612349)突变导致苯丙氨酸羟化酶(pah)活性下降或缺乏,导致血中苯丙氨酸(Phe)浓度增高并在神经系统和血中蓄积[1],造成严重的神经损害,影响患儿发育,甚至危及生命。据统计,我国苯丙酮尿症发病率约为1∶12 189[2],而1985-2000年中国主要城市新生儿筛查的PKU发病率为1∶11 307[3],而近3年河南省PKU的发病率为1∶6 356,高于全国平均水平[4]。本课题组使用MLPA技术联合Sanger测序,对河南省人群中PKU患者进行pah基因研究,可为PKU患者的诊断以及家系的深入研究提供理论依据。
1 资料与方法
1.1 一般资料
选取2015年1月至2016年1月在郑州大学第三附属医院科研中心进行基因诊断的高苯丙氨酸血症的患儿,通过Phe负荷试验、BH4负荷试验、尿液蝶呤谱分析确诊分型并排除其他代谢性疾病的83例PKU患儿及其父母为研究对象。83例患儿的男女性别比例为41∶42,年龄30 d至10岁。所有受试者检测均获得患儿监护人的知情同意,并且符合医院人体试验伦理委员会所制定的伦理学标准,得到该委员会批准。
1.2 方法
1.2.1外周血DNA提取 EDTA抗凝全血采用QIAamp®DNA Blood Mini Kit (批号:51106,德国Qiagen公司)按照该试剂盒的DNA提取操作说明书进行外周血样本的基因组DNA提取,所得样本基因组DNA经1%的琼脂糖凝胶电泳检测后保存于-80 ℃超低温冷藏箱中备用。
1.2.2PCR扩增、基因测序和序列分析比对 在ABI 9700 PCR(美国Applied Biosystems公司)仪上进行聚合酶链式反应,采用20 μL的PCR总反应体系,其中2*Master Mix(TIANGEN)10 μL,上下游引物(表1)各0.4 μL,DNA模板1 μL,ddH2O 8.2 μL。PCR反应条件:95 ℃预变性5 min,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s(30次循环),72 ℃ 10 min。用1%琼脂糖凝胶电泳观察PCR产物片段的大小,确定有目的片段并且同引物设计的目的片段大小一致后在ABI 3730测序仪上进行测序,测序结果的峰图以及序列比对分别采用Chromas Pro 2.1.3和Vector NTI Explorer进行。
1.2.3多重连接探针扩增(MLPA)法检测pah基因大片段缺失 使用SALSA MLPA probemix P055-D1 pah kit(MRC-Holland公司,荷兰)对测序无法进行基因分型的PKU患者外周血基因组DNA标本进行pah基因大片段缺失检测,该试剂盒含有38个探针,其中pah基因所在区域(chromosome 12q23.2)探针22个,上下游探针各1个,参考序列探针14个。MLPA反应参照试剂盒说明书进行,反应产物在ABI3500基因测序仪上进行毛细管电泳,电泳结果采用MLPA专用数据软件Coffalyser进行分析,拷贝数的判定根据同内参照序列电泳峰面积的比值确定:正常2拷贝比值范围为0.7~1.3;3拷贝(杂合重复突变)比值范围为1.4~1.7;单拷贝(杂合缺失突变)比值范围为0.3~0.6;纯合缺失突变的比值范围为0~0.2。

表1 PCR扩增和测序引物
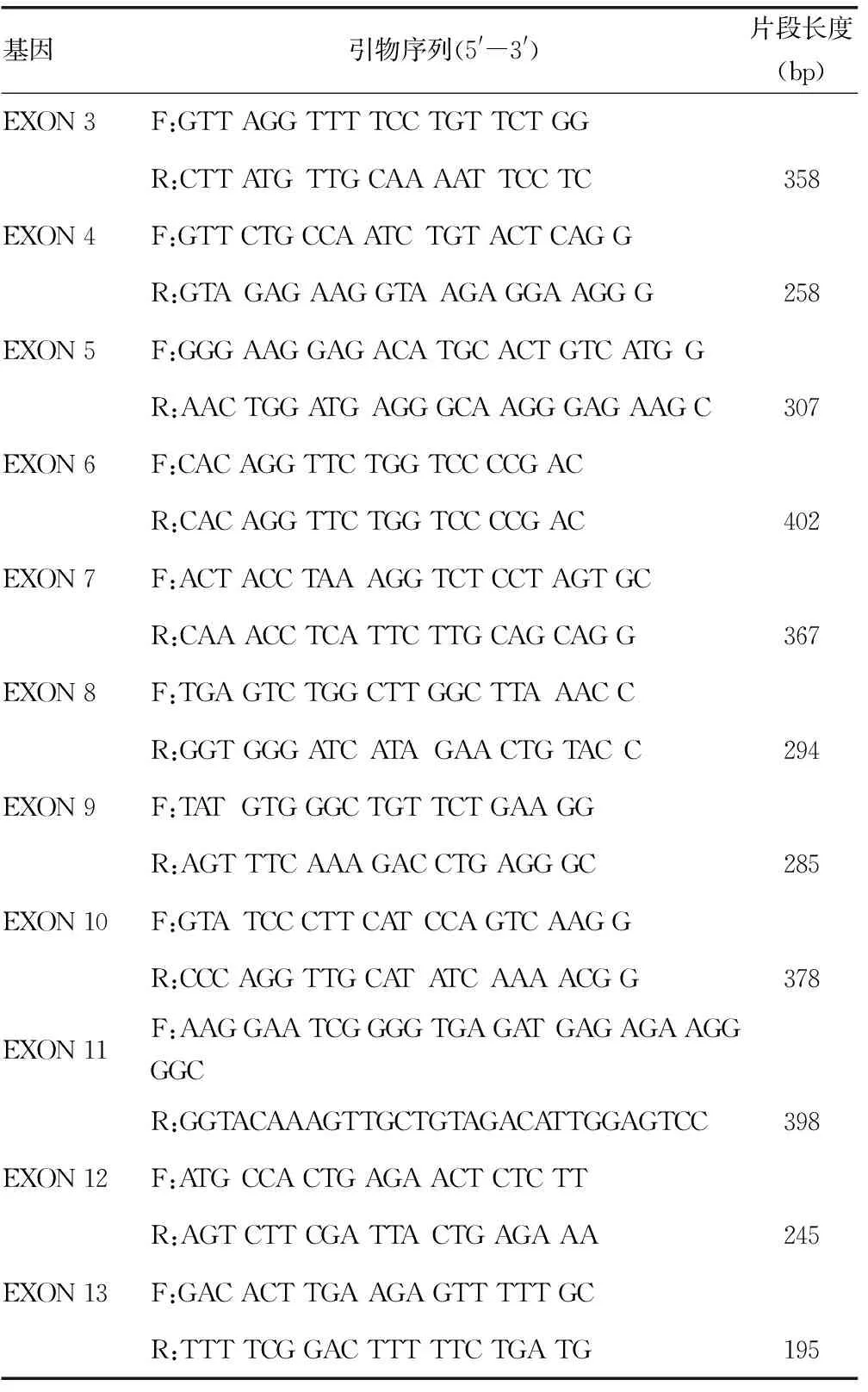
续表1 PCR扩增和测序引物
2 结 果
2.1 河南省PKU患儿pah基因点突变检测结果
在对确诊的83例PKU患儿中,对其pah基因13个外显子及其双侧剪接区进行测序分析:在166条染色体中共检测到62种,162个基因突变,突变检出率为97.61%。83例患儿中有4例只检测出1条染色体上等位基因的突变,6例患儿检测到6个大片段缺失型杂合突变,3例患儿为纯合型突变,其余70例患儿均为杂合型突变。
163个突变位点分布于pah基因第2至第12外显子及第2、3、4、12内含子区域(表2),发生突变频率最高的区域是第6、7、11外显子区域,占总体突变的64.1%;在所有点突变中,发生频率最高突变类型的为替换突变,其突变频率为74.4%,其余突变类型依次为剪接区突变、沉默突变、缺失突变和无义突变,突变频率分别为13.5%、5.8%、3.8%和2.6%;突变频率最高的位点为c.728G>A(p.R243Q),突变频率为15.38%、其次为c.611A>G(p.Y204C)、c.721C>T(p.R241C)、c.1197A>T(p.V399V) 和c.158 G>A(p.R53H),其突变频率依次为9.62%、7.05%、7.05%和5.13%,其余位点的突变频率均在0.64%~4.49%。

表2 河南省83例PKU患儿pah基因突变情况

续表2 河南省83例PKU患儿pah基因突变情况
2.2 河南省PKU患儿pah基因大片段缺失检测结果
在本研究中,通过MLPA技术共发现6例患者的pah基因出现大片段缺失型突变,缺失突变发生在其pah基因第1、4、5、6、7外显子及其基因上游的调控区域,其中3例患者(PKU033、PKU039、PKU055)检测到了发生在pah第4、5外显子上的大片段缺失(图1A、B、F),其血浆Phe浓度分别为0.181、0.196 g/L和0.202 g/L(表3);2例患者(PKU015、PKU027)检测到了发生在pah基因第1外显子的大片段缺失(图1D、E),其血浆苯丙氨酸浓度分别为0.072、0.123 g/L(表3);1例患者(PKU012)检测到了发生在pah基因第5、6、7外显子的大片段缺失(图1C),其血浆Phe浓度分别为0.329 g/L(表3)。
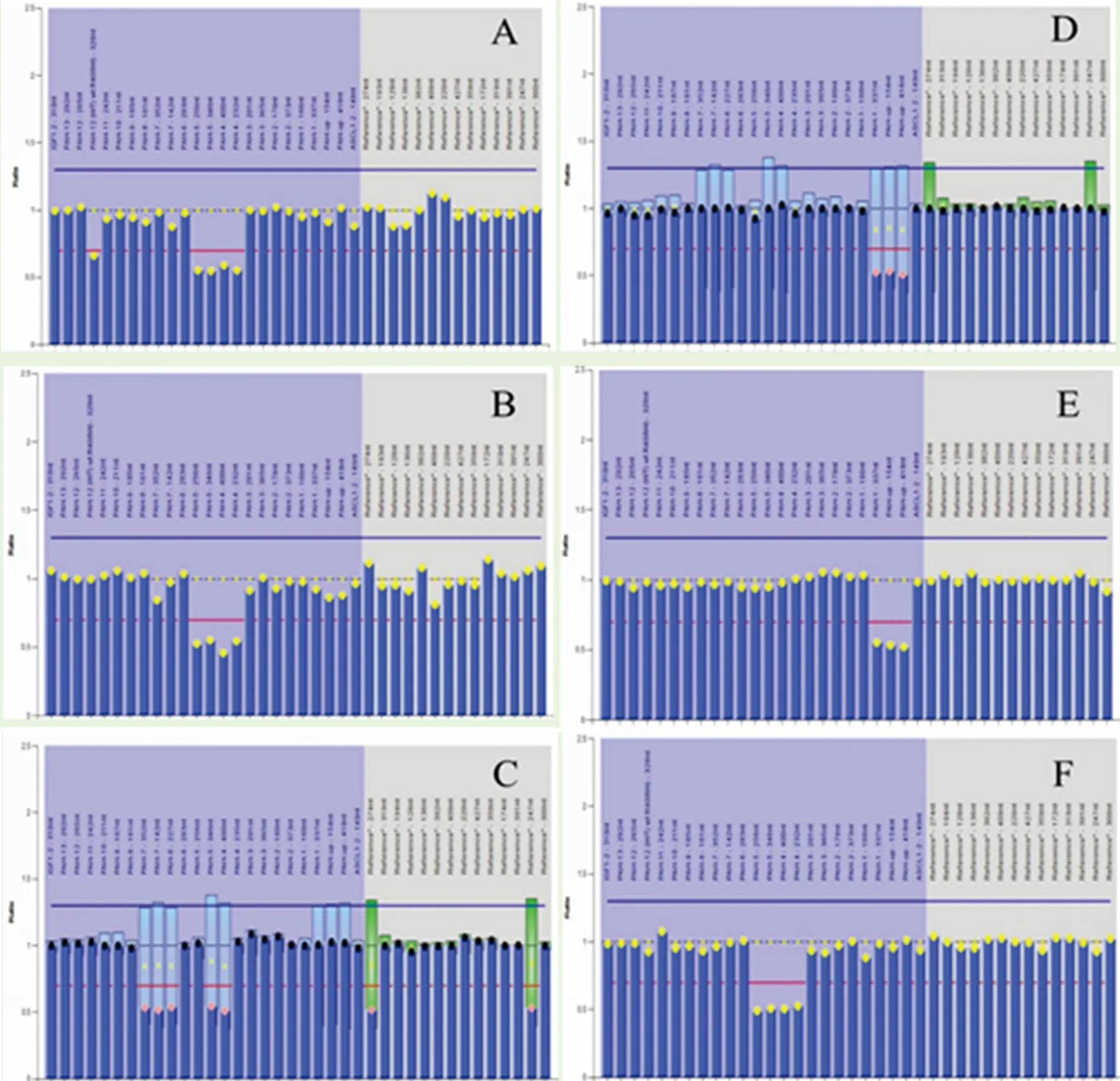
A:PKU033患者在pah基因第4、5外显子区域发现大片段缺失;B:PKU039患者在pah基因第4、5外显子区域发现大片段缺失;C:PKU012患者在pah基因第5、6、7外显子区域发现大片段缺失;D:PKU015患者在pah基因第1外显子区域发现大片段缺失;E:PKU027患者在pah基因第1外显子区域;F:PKU055患者在pah基因第4、5外显子发现大片段缺失

表3 pah基因大片段缺失型PKU患者一般临床资料
3 讨 论
PKU是常见的遗传代谢性疾病,其主要机制是人体内pah 基因发生突变,导致pah 结构及活性改变[5]。pah基因突变位点多处于外显子或者外显子与内含子的交接区[6],影响一个或多个氨基酸。根据对pah酶活性有无影响,分为沉默突变和致病突变。沉默突变对pah酶活性无影响。致病突变大部分发生在外显子或外显子和内含子的交接区域,严重影响 pah基因转录和翻译以及蛋白质异常折叠、聚合,使其加速降解,从而影响 pah 酶的催化活性。pah基因的突变具有位置多变、类型多样及异质性等特点[7],而且不同民族和地区之间基因突变的频率和突变类型存在较大差异[8]。
pah突变的标准分子分析包括对所有的外显子和外显子边缘的Sanger测序,同时可使用多重连接探针扩增技术(MLPA技术)进行补充[9]。pah基因的基因组DNA分析也可以被扩展到EBV -永生化的淋巴细胞提取的cDNA分析,以确定或确认转录异常[10]。Sanger测序主要用于检测错义突变、剪切位点突变以及小片段的插入和缺失,MLPA技术则可检测大片段的缺失、复杂的重排及拷贝数变异,二者联合使用可以取长补短,提高诊断准确率[11]。MLPA是基于分子诊断的敏感有效的技术,包括缺失和大型基因组区域的复制[12]。在PKU患者中,大部分等位基因突变伴随着错义突变和大片段缺失。有研究采用MLPA技术,对59例未知突变等位基因的捷克PKU患者进行检测,发现31例患者携带大片段缺失突变[13]。有学者在研究罗马尼亚人的PKU基因型频谱时,采用Sanger测序和MLPA、 cDNA分析的结合,达到了对PKU 99%的诊断效率[14]。
本研究中pah基因的突变位点集中在6、7、11、12这4个外显子及其两端的内含子剪接区中,同数据库中的统计结果和以往中国人群中pah基因突变的调查结果基本一致。本研究PCR扩增产物的直接测序结果突变频率在5%以上的热点突变中c.728G>A、c.611A>G、c.1197A>T的突变频率与以往文献资料相一致[15],而c.721C>T和c.158G>A的突变发生率较高,其频率分别为7.05%和5.13%,同其他省份人群的PKU突变热点不同[1,7,16],提示其可能是河南人群中pah基因的特有突变。
测序后使用MLPA共检测到6例PKU患者其pah基因发生大片段缺失突变,6例患者血浆中Phe的浓度相差较大,其中血浆中浓度最低的患者其大片段缺失发生在pah基因的第1外显子,而发生在第5、6、7外显子的大片段缺失突变的患者血浆中Phe的浓度最高达0.329 g/L。这种差异存在可能与大片段缺失发生的位置有关,由于pah基因第1外显子所编码的氨基酸位于酶蛋白的调控域,而5、6、7外显子所编码的氨基酸位于蛋白的活性中心域,因此当区域发生大片段缺失突变时,酶的活性下降程度相对较大。此外,由于大片段缺失突变发生频率相对较低,对于这种突变的基因型表型的关系研究还需要扩大样本量进行深入的探讨。
综上所述,使用MLPA进行pah基因大片段缺失的检测,是对PKU患者常规突变筛查的补充,为PKU患者的诊断治疗以及PKU患者家系的研究提供理论依据,值得进一步推广和应用于临床诊断。

