单核苷酸多态性结合位点C19007T与宫颈癌患者易感性的相关研究
秦 梅,武红权,厉 勇,杨 旭,胡苑苑
(1.贵州省贵阳市第一人民医院输血科 550002;2.贵州省人民医院检验科,贵阳 550002;3.贵州省贵阳市妇幼保健院输血科 550003)
宫颈癌是最常见的女性生殖系统恶性肿瘤之一,在女性恶性肿瘤发病率中排第3位。近年来,宫颈癌的发病趋于年轻化[1],广大女性的健康及生命安全受到了严重威胁。通过对宫颈癌相关易感因素的研究表明,遗传基因的突变很有可能是引起宫颈癌的一个重大因素[2]。到目前为止,针对宫颈癌易感性与基因多态性的研究已有较大进展[3-4]。本研究旨在通过探讨位于caspase-3基因C19007T位点的多态性与宫颈癌易感性的关系,为宫颈癌的病因学研究提供新思路。
1 资料与方法
1.1 一般资料
选取从2013年2月至2016年9月于贵州省人民医院、贵阳市妇幼保健院、贵阳市第一人民医院妇科住院的100例宫颈癌患者(观察组),均未曾在采血前行放疗、化疗、免疫治疗等其他针对肿瘤的治疗,平均年龄为(46.0±10.1)岁,经术后的宫颈活组织病理检查结果判定,所有患者肿瘤病理类型都是宫颈鳞状细胞癌。根据国际妇产科联盟(FIGO)的2009年临床分期标准:Ⅰ、Ⅱ期有60例,Ⅲ、Ⅳ期有40例;局部的淋巴结转移情况:32例有转移,68例无转移。患者各项信息(年龄、吸烟状态、孕产次、HPV感染情况等)均来源于病历记录。选取同期于该院体检未检出宫颈病变的100例健康女性作为对照组,平均年龄为(47.8±9.4)岁。所有研究对象间相互均无直系亲属关系,且均无遗传病病史。
1.2 方法
1.2.1DNA的提取 采集所有受试者晨起空腹时的静脉血3~5 mL,运用TIANamp试剂盒提取所采血液中基因组DNA,于-80 ℃保存。
1.2.2基因分型 选取caspase-3上3′-UTR端的microRNA结合位点C19007T,使用PCR-PIRA方法进行引物设计,于多态性位点的上游用碱基A代替T,进而引入TaqⅠ酶切位点。其中,上游的引物为:5′-TTG TGA AAA AGT TAA ACA TTG AAG TAT-3′,下游的引物:5′-TTC AGG ACA AAC ATC ACA AA-3′,扩增的产物片断长度是230 bp(图1)。PCR扩增反应体系的总体积为25 μL,包括10×Buffer 2.5 μL,ddH2O 17.15 μL,dNTP 0.5 μL,MgCl22.5 μL,P 10.3 μL,rTaq酶0.25 μL,P2 0.3 μL。PCR扩增条件:95 ℃条件下预变性10 min,95 ℃条件下变性45 s,退火45 s,72 ℃ 50 s,扩增35个循环,72 ℃ 7 min,4 ℃保存,反应结束。电泳槽中放入2%琼脂糖凝胶,并加11 μL PCR反应产物后电泳(30 min)。在凝胶成像仪下成像、拍照。酶切反应体系为15 μL,包括ddH2O 1.5 μL,XspI 1 μL(8 U/μL),Buffer(10×K)1.5 μL及PCR反应产物11 μL。在37℃恒温水浴箱过夜。用3.5%的琼脂糖凝胶电泳(30 min)后观察并记录酶切结果,见图2。

图1 caspase-3基因的PCR产物

图2 caspase-3基因的C19007T多态性的分析
1.2.3免疫组织化学 从观察组中选取100例宫颈鳞癌组织的石蜡标本。标本来源于贵州省人民医院、贵阳市妇幼保健院病理科。常规石蜡包埋,4 μm连续切片后,给予免疫组织化学染色,显微镜下观察。结果分析:以细胞质或细胞膜中出现棕黄色颗粒为caspase-3蛋白的阳性表达。当物镜下的阳性细胞,≤10%记0分;>10%~50%记1分;>50%~75%记2分;>75%记3分。染色强度的区分标准:无色0分,淡黄色1分,棕黄色2分,棕褐色3分。上述两项的得分相加以后:0分为“-”,1~2分为“+”,3~4分为“++”,5~6分为“+++”。
1.3 统计学处理
所有数据采用SPSS19.0软件进行处理,计数资料采用率表示,组间采用χ2检验或Fisher确切概率法,等级资料的相关性分析采用Spearman等级相关分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 caspase-3基因上C19007T 位点多态性的基因分布情况
对照组与观察组在年龄、吸烟状况、婚次、产次方面均无明显差异。而HPV感染在观察组84例(84%)的分布频率明显高于对照组24例(24%)且有统计学意义(P<0.01)。
2.2 caspase-3结合位点上C19007T 的基因型分布及其与宫颈鳞状细胞癌遗传易感性的关系
所有研究对象的C19007T 多态位点共计有3种基因型:C/C、T/C及T/T,其在观察组中的基因型频率依次为58%、37%、5%,在对照组中依次为55%、29%、16%,将基因型T/C、T/T分别与等位基因C/C作对比,两组间基因型C/C和T/C的分布频率差异无统计学意义(P=0.540),C/C、T/T基因分布频率差异有统计学意义(P=0.020),见表1。T/T基因型较C/C基因型可更明显降低宫颈鳞状细胞癌发病的可能性,见表2。经χ2检验,caspase-3 rs1049216多态位点在两组中均符合Hardy-Weinberg平衡。
2.3 caspase-3上3′-UTR端microRNA结合位点的SNP与宫颈鳞状细胞癌转移的关系
有淋巴转移组的caspase-3 C19007T 的C/C、T/C、T/T基因型频率分别为31.0%、35.1%、20.0%,无转移组的分别为69.0%、64.9%、80.0%,分别将基因型T/C、T/T与基因型C/C作对比,两组基因型的分布频率均差异无统计学意义(P=0.678、0.606),见表3。
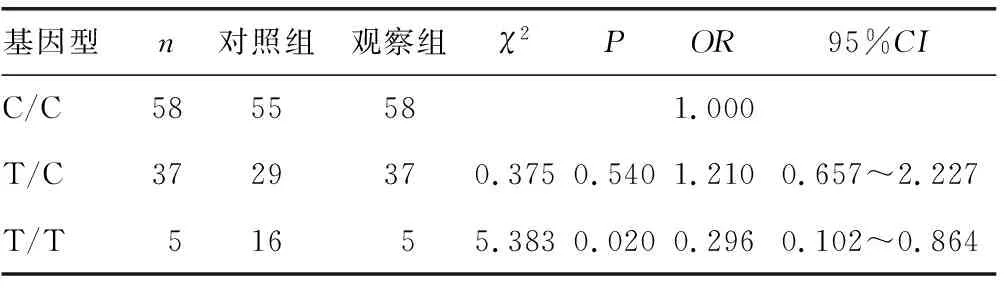
表1 C19007T SNP基因型在观察组和对照组的分布(n)

表2 C19007T 基因型和宫颈癌临床分期的关系[n(%)]

表3 C19007T 基因型与淋巴转移的关系[n(%)]
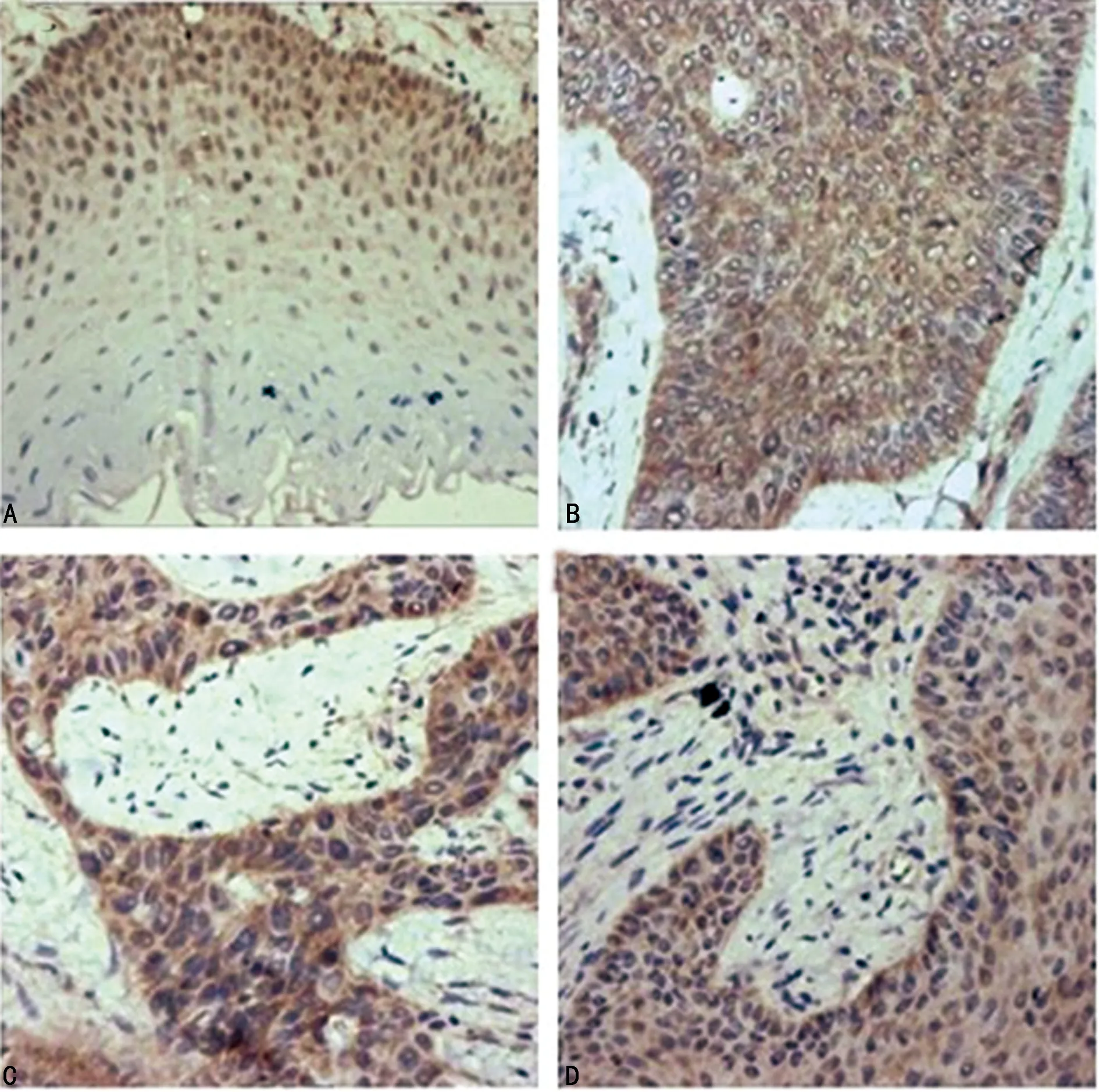
A:正常宫颈组织;B:C/C基因型患者的瘤组织;C:T/C基因型患者的瘤组织;D:T/T基因型患者的瘤组织

表4 3种基因型的宫颈癌组织中的caspase-3蛋白表达水平[n(%)]
2.4 免疫组织化学
癌组织中caspase-3蛋白的表达减少,免疫组织化学染色结果提示:阳性颗粒位于肿瘤细胞的细胞质中,部分间质细胞内亦有所发现。以上研究结果表明,caspase-3蛋白的表达情况与rs1049216的基因型类型(C/T、C/C、T/T)没有显著的关联(P=0.903),见表4、图3。
3 讨 论
在女性所有的生殖系统肿瘤中,宫颈鳞状细胞癌是最常见的恶性肿瘤之一。目前,宫颈鳞状细胞癌的致命性在全球引起广泛关注,在发展中国家的进展速度更为引人注目[5]。宫颈鳞状细胞癌的发生、发展是个多因素参与的复杂过程,随着近年来的深入研究,众多研究表明,遗传因素的改变是引起宫颈鳞状细胞癌出现易感性的重要原因。遗传易感性虽然不能直接引起肿瘤,但会使肿瘤发生的可能性增加,而其中的SNP及其相关组合,可增加复杂性遗传病的发病风险[6]。有研究表明,microRNA结合位点的SNP可明显改变生物合成和/或相应的microRNA的功能表达,并由此增加恶性肿瘤的患病风险[7]。同时,有大量研究表明,基因3′-UTR的SNP功能位点可大大增加恶性肿瘤发生的可能性[8-9]。
caspase-3是一种与细胞凋亡有关的蛋白,caspase-3在整个细胞凋亡过程中发挥着关键作用[10]。有研究表明,caspase-3在宫颈鳞状细胞癌中表达减低,使得癌细胞在向周围正常组织及全身各器官的扩散转移速度加快。有文献报道,caspase-3基因的多态性与许多种恶性肿瘤易感性有关[11-12]。本研究显示,在caspase-3基因中的结合位点C19007T 的T/T基因型可导致宫颈癌的发生。与HPV感染和宫颈鳞状细胞癌的临床分期都有显著的相关性。相关研究表明,SNP的很多位点与多种肿瘤的转移与预后有关[13-14]。
细胞增殖与凋亡失衡、促细胞凋亡的蛋白表达减少均会诱发肿瘤,而caspase-3在细胞的凋亡中极为重要。相关研究表明,caspase-3在很多妇科恶性肿瘤中的表达出现变化[15]。但caspase-3在宫颈鳞状细胞癌细胞中的表达可能与C19007T 位点的多态性无明显相关性。
总之,caspase-3基因3′端非翻译区microRNA结合位点的C19007T 可能与宫颈癌的淋巴转移无关,同时,caspase-3的蛋白表达情况与rs1049216的多态性无明显相关性。这些发现可用于对易感人群进行宫颈鳞状细胞癌的筛查,对宫颈鳞状细胞癌的预防及治疗具有重要意义。

