组织蛋白酶S对RA软骨细胞分泌Ⅱ型胶原的研究
赵进军,黄 琴,任 昊,欧阳晴晴,毋 静,杨 敏△
(南方医科大学:1.南方医院风湿免疫科;2.珠江医院风湿免疫科,广州 510515)
类风湿关节炎(rheumatoid arthritis,RA)发病机制复杂,至少有8种类型细胞参与,包括肥大细胞、成纤维细胞、巨噬细胞、T细胞[1]、B细胞[2]、树突状细胞[3]、软骨细胞和破骨细胞。在正常滑膜中肥大细胞约占滑膜表面细胞的3%;而在RA患者滑膜中肥大细胞数量可占到滑膜表面细胞的5%,说明肥大细胞在RA疾病中起重要作用[4]。RA的主要病理改变是关节软骨和骨的破坏。因此,针对RA的治疗,除控制炎症外,就是寻求保护软骨的方法。软骨基质主要由Ⅱ、Ⅸ、Ⅺ胶原组成,其中Ⅱ型胶原(CⅡ)的半衰期最长[5]。本研究将肥大细胞、成纤维细胞、巨噬细胞和软骨细胞共培养,以期发现对软骨细胞分泌CⅡ影响最大的细胞类型。由于肥大细胞可分泌多种蛋白酶,本研究拟通过肥大细胞的稳定剂、激活剂和酶抑制剂,以期发现组织蛋白酶S是否对CⅡ的破坏存在作用。
1 材料与方法
1.1 动物与试剂
本实验所用动物均为8~9周龄C57BL/6雌性小鼠,在SPF级动物所饲养,符合南方医科大学动物管理条例,用胶原诱导的关节炎(CIA)进行造模,造模成功后进行原代细胞的培养。DMEM培养基,RPMI 1640培养基,胎牛血清购自Gibco公司;Ⅳ型胶原酶,色甘酸二钠(DSCG),肥大细胞的激活剂(C48/80),脂多糖(LPS)购自Sigma公司;Anti-Cathepsin S抗体、Anti-Collagen Ⅱ抗体,GAPDH抗体购自Abcam公司;组织蛋白酶S的ELISA试剂盒购自LifeSpan公司;CⅡ ELISA试剂盒购自武汉华美;Transwell培养板购自Corning;其余均为国产分析纯。LHVS由哈佛大学的施国平教授赠送。
1.2 方法
1.2.14种原代细胞的培养方法
滑膜成纤维细胞和关节软骨细胞的原代培养使用0.3%的Ⅳ型胶原酶消化法。腹腔巨噬细胞使用3%的Thioglycollate肉汤。骨髓源性肥大细胞的原代培养使用终浓度为10 g/mL的重组小鼠IL-3和SCF刺激。
1.2.2软骨细胞和滑膜成纤维细胞共培养 软骨细胞和滑膜成纤维细胞共培养分4组:软骨细胞对照组、软骨细胞+滑膜成纤维细胞组、软骨细胞+滑膜成纤维细胞+TNF-α低剂量刺激组(终浓度10 μg/mL)、软骨细胞+滑膜成纤维细胞+TNF-α高剂量(终浓度100 μg/mL)刺激组。选取Transwell小室12孔板,每组设3个复孔,细胞按3×105/mL浓度加入Transwell小室,共培养24 h和48 h。
1.2.3软骨细胞和巨噬细胞共培养 软骨细胞和巨噬细胞共培养分4组:软骨细胞对照组、软骨细胞+巨噬细胞激活组(LPS的终浓度为100 ng/mL)、软骨细胞+巨噬细胞+LHVS(终浓度10 ng/mL)组、软骨细胞+巨噬细胞+E64(终浓度20 μmol/L)组。巨噬细胞和软骨细胞分别按2×106/mL和3×105/mL浓度加入Transwell小室的内孔,其中巨噬细胞的激活使用LPS(终浓度100 ng/mL),共培养24 h和48 h。
1.2.4软骨细胞和肥大细胞共培养 软骨细胞和肥大细胞共培养分6组:软骨细胞对照组、软骨细胞+肥大细胞共培养对照组、软骨细胞+肥大细胞+DSCG(终浓度10 μmol/L)组、软骨细胞+肥大细胞+C48/80(终浓度5 μg/mL)组、软骨细胞+肥大细胞+LHVS组、软骨细胞+肥大细胞+E64组。肥大细胞和软骨细胞分别按1×106/mL和3×105/mL浓度加入12孔板,共培养24 h和48 h。
1.2.5ELISA检测培养上清液中组织蛋白酶S和CⅡ的表达 培养上清液中组织蛋白酶S和CⅡ的ELISA检测方法按试剂盒说明书进行,每个样品检测3次。
1.2.6RT-PCR检测软骨细胞中CⅡ mRNA RT-PCR检测软骨细胞中CⅡ mRNA:提取总RNA,检测总RNA的完整性,去除DNA,加入PCR引物(CⅡA1:5′-CCT GTT CTG AGA GGT CTT CCT G,5′-AAT ACC AGC AGC TCC CCT CT,GAPDH:5′-AGA AGG TGG TGA AGC AGG CAT C,5′-CGA AGG TGG AAG AGT GGG AGT T),反应后每一个样品目的基因扩增的循环数(Ct)都依据GAPDH做校正。
1.2.7Western blot检测组织蛋白酶S的表达 用lysis buffer冰上裂解细胞,获得总蛋白,常规方法进行电泳、转膜、封闭、抗体、显色等。
1.3 统计学处理
2 结 果
2.1 细胞共培养时CⅡ的表达
小鼠关节软骨细胞和滑膜成纤维细胞共培养用TNF-α刺激时,CⅡ表达的结果见图1A,各组间没有统计学差异。软骨细胞和腹腔巨噬细胞共培养时CⅡ表达的结果见图1C,软骨+巨噬细胞激活组与其他组间差异有统计学意义(P<0.05),加用组织蛋白酶S的抑制剂后,LHVS和E64组CⅡ的表达均升高,与软骨细胞对照组间差异无统计学意义。软骨细胞和骨髓源性肥大细胞共培养时CⅡ表达的结果见图1E,软骨+肥大+C48/80组与其他各组间差异有统计学意义(P<0.05),而在加入组织蛋白酶S的抑制剂后,CⅡ的表达恢复正常。
2.2 细胞共培养时组织蛋白酶S的表达
软骨细胞和腹腔巨噬细胞共培养时组织蛋白酶S表达的结果见图1G,软骨+巨噬细胞激活组与其他组间差异有统计学意义(P<0.05),加用组织蛋白酶S的抑制剂后,LHVS和E64组内组织蛋白酶S的表达均降低。软骨细胞和肥大细胞共培养时组织蛋白酶S表达的结果见图1H,软骨+巨噬细胞激活组与其他各组间差异有统计学意义(P<0.05),加用组织蛋白酶S的抑制剂LHVS和E64后,组织蛋白酶S表达降低,与软骨+肥大对照组间差异无统计学意义。
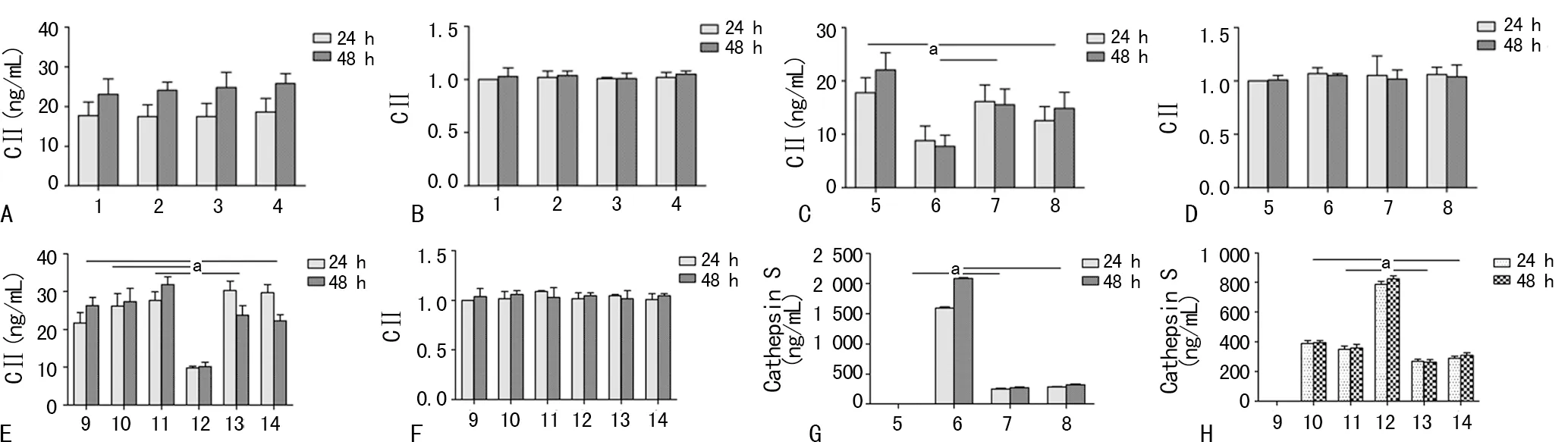
A:小鼠软骨细胞与滑膜成纤维细胞共培养时CⅡ的ELISA结果;B:小鼠软骨细胞与滑膜成纤维细胞共培养时CⅡ的RT-PCR结果;C:小鼠软骨细胞与巨噬细胞共培养时CⅡ的ELISA结果;D:小鼠软骨细胞与巨噬细胞共培养时CⅡ的RT-PCR结果;E:小鼠软骨细胞与肥大细胞共培养时CⅡ的ELISA结果;F:小鼠软骨细胞与肥大细胞共培养时CⅡ的RT-PCR结果;G:巨噬细胞与软骨细胞共培养时组织蛋白酶S的ELISA结果;H:肥大细胞与软骨细胞共培养时组织蛋白酶S的ELISA结果;a:P<0.05;1:软骨;2:软骨+滑膜;3:软骨+滑膜+TNF低;4:软骨+滑膜+TNF高;5:软骨;6:软骨+巨噬;7:软骨+巨噬+LHVS;8:软骨+巨噬+E64;9:软骨;10:软骨+肥大;11:软骨+肥大+DSCG;12:软骨+肥大+C48/80;13:软骨+肥大+LHVS;14:软骨+肥大+E64
图1细胞共培养结果
2.3 细胞共培养时RT-PCR结果
本研究对软骨细胞和其他3种类型的细胞共培养,进行了CⅡ的RT-PCR检测,不管是和滑膜成纤维细胞(图1B),腹腔巨噬细胞(图1D),还是和骨髓源性肥大细胞(图1F),各组间均差异无统计学意义。

A:软骨细胞和巨噬细胞共培养时的结果;B:软骨细胞和肥大细胞共培养时的结果
图2组织蛋白酶S的Western blot结果
2.4 Western blot结果
本研究对软骨细胞和腹腔巨噬细胞共培养、软骨细胞和骨髓源性肥大细胞共培养,提取总蛋白,Western blot结果见图2。巨噬细胞和肥大细胞分别被LPS和C48/80激活后,组织蛋白酶S的表达升高,而用组织蛋白酶S的抑制剂LHVS和E64可以抑制其表达。
3 讨 论
组织蛋白酶S是一种属于木瓜蛋白酶超家族的半胱氨酸蛋白酶,在抗原递呈细胞(antigen presenting cell,APCs)上高度表达,它对多种蛋白具有催化水解活性,特别是MHC Ⅱ恒定链(invariant chain,Ii)和细胞外基质成分(弹性蛋白和胶原)。已证实组织蛋白酶S参与多种疾病,如阿尔茨海默病、动脉粥样硬化、哮喘、慢性阻塞性肺病、肿瘤、骨关节炎、神经痛和多种自身免疫性疾病[6-7]等。但目前对组织蛋白酶S在RA中的作用研究较少[8]。
组织蛋白酶 S的底物广泛[9],最引起人们兴趣的是它的高弹性蛋白水解活性[10]。但在类风湿关节炎中可能无关弹性蛋白的降解,因为在骨和软骨的细胞外基质中弹性蛋白水平极低。但组织蛋白酶 S有潜在的蛋白聚糖降解活性,特别是在中性和酸性pH中具有强大的水解软骨聚集蛋白聚糖能力[11]。组织蛋白酶 S在RA关节的滑膜巨噬细胞上表达,在炎性过程中分泌蛋白酶入软骨基质,可能会破坏形成功能性软骨的软骨聚集蛋白聚糖-CⅡ网状组织的完整性[12]。但目前很少有人研究组织蛋白酶S对软骨细胞分泌CⅡ的影响[13]。
本研究共进行了4种原代细胞的培养,包括小鼠滑膜成纤维细胞、腹腔巨噬细胞、关节软骨细胞和骨髓源性肥大细胞。发现软骨细胞在与滑膜成纤维细胞共培养时,软骨细胞分泌CⅡ的量无变化。而软骨细胞与巨噬细胞共培养时,及软骨细胞与肥大细胞的共培养时,均发现CⅡ的量减少,尤其是在肥大细胞被其激活剂(C48/80)激活后。该研究证实巨噬细胞和肥大细胞是组织蛋白酶S的主要来源,本研究在该研究中当加入组织蛋白酶S的特异性抑制剂(LHVS)及非特异性抑制剂(E64)后,CⅡ的量恢复到正常水平,说明组织蛋白酶S可能是CⅡ量减少的主要因素。但细胞培养上清中CⅡ量减少是由于分泌减少还是分泌后被破坏需深一步研究。随后收集各组软骨细胞,裂解提取RNA后进行CⅡ的RT-PCR检测,发现各组间RT-PCR水平相似,说明CⅡ在转录水平上未发生变化,因此认为CⅡ主要是在合成后受到破坏。当然,本研究中还存在不足,即未对组织蛋白酶S的活性进行检测,不能反映组织蛋白酶S在病变中的功能变化,这将是下一步研究的重点。
从本研究上看,巨噬细胞和肥大细胞均对软骨细胞分泌CⅡ的影响较大,他们可能是影响软骨功能的主要细胞类型,而在抑制了组织蛋白酶S功能后,CⅡ的分泌量恢复正常,说明组织蛋白酶S很有可能是CⅡ破坏的主要因素,因此针对组织蛋白酶S的特异性治疗有可能是未来研究的方向。

