利格列汀对2型糖尿病SD大鼠肾脏PRMT1表达及肾功能的影响*
梅 希,吴锦林,黎 瑶,邱 平
(1.成都医学院第一附属医院内分泌与代谢病科,成都 610500;2.重庆市中医院/重庆市中医研究院内分泌与代谢病科 400021)
目前,糖尿病肾病(DN)的发病机制仍没有完全阐明,现在公认的主要机制有:肾脏血流动力学改变、高血糖诱导的终末糖基化产物堆积、氧化应激和炎性反应等。既往关于氧化应激方面的研究已证实,糖尿病、高血压患者存在血管内皮功能障碍,其血清中非对称性二甲基精氨酸(ADMA)水平明显升高。约85%的ADMA主要由蛋白质精氨酸甲基转移酶1(PRMT1)催化生成,约75%的ADMA则由二甲基精氨酸二甲胺水解酶1(DDAH1)水解,即形成1条PRMT1-ADMA-DDAH1代谢轴[1-2]。既往研究证明这条代谢轴存在于糖尿病患者胰腺、眼及肾脏组织中[3-5]。二肽基肽酶-4(DDP-4)抑制剂是目前临床上使用的一种新型降糖药物,其主要作用机制是通过抑制胰高糖素样肽-1的分解,从而促进胰岛β细胞对胰岛素的释放。在众多DPP4抑制剂中,利格列汀由于其对肝肾功能影响小,且能控制体质量增加,所以广泛用于糖尿病的降糖治疗中。既往已有研究证实,在替米沙坦治疗基础上加用利格列汀可有效减少DN患者的蛋白尿。为此推测利格列汀除降糖作用外,还可能具有保护肾脏的作用。另外,利格列汀对肾脏中PRMT1的影响少见相关报道。本研究建立2型糖尿病伴早期DN的大鼠模型,通过单用利格列汀干预治疗,探讨其能否通过抑制PRMT1而起到保护肾功能的作用,现报道如下。
1 材料与方法
1.1材料 30只清洁及体质量为(170.30±10.09)g的雄性SD大鼠,购于成都医学院动物实验中心,在基础饲料喂养和自由进水进食的标准环境中饲养并适应1周,随机分为观察组(n=20)和正常对照组(NC组,n=10)。观察组给予高糖、高脂饲料饲养,NC组给予普通饲料饲养。
1.2分组 4周后,分别在观察组和NC组SD大鼠腹腔内注射链脲佐菌素(STZ)溶液(STZ,30 mg/kg,Sigma公司)和相应体积的柠檬酸缓冲液。1周后分别经尾静脉采血检测空腹血糖(FBG)(标准:以禁食后血糖水平>7.8 mmol/L判定观察组2型糖尿病大鼠模型建模成功)。随机将观察组分为糖尿病组(DM组,n=10)和糖尿病利格列汀治疗组(LM组,n=10)。LM组以利格列汀[3 mg/(kg·d),美国礼来公司]经口灌胃,相应剂量的蒸馏水给予NC组和DM组。12周后,收集24 h尿液,将大鼠隔夜禁食称重并经乙醚麻醉后,从腹主动脉留取血液并分离肾脏标本。
1.3方法
1.3.1相关指标检测和计算 采用葡萄糖氧化酶法测定FBG;采用放射免疫法检测空腹胰岛素(FINS)、肌酐(Cr)、24 h尿微量清蛋白(24 h mALB)及尿微量清蛋白肌酐比值(ACR)。胰岛素抵抗指数(HOMA-IR)用[HOMA-IR=FINS×FBG/22.5]计算,FINS单位为mU/L,FBG单位为mmol/L。
1.3.2动脉血压测定 各组大鼠动脉血压测量采用无创大鼠鼠尾测压仪。保持大鼠处于安静清醒状态,放置鼠尾于37 ℃加热毯加热,测量舒张压(DBP)和收缩压(SBP)。
1.3.3反转录-聚合酶链反应(RT-PCR) 肾脏总RNA的提取用Trizol,其水平和纯度测定采用核酸蛋白仪。将RNA反转录成cDNA后进行扩增(试剂购自日本Takara公司)。PRMT1上游引物为:5′-GAG TTC ACC CGA TGC CAC AAG-3′,下游引物为:5′-TCC GGT AGT CGG TGG AAC AAG-3′,扩增产物大小为238 bp,退火温度为57 ℃。取产物加入2%琼脂糖凝胶中进行电泳后,采用BioRad GelDos200凝胶成像系统进行图片拍摄,光密度值采用Quantity One软件进行分析。
1.3.4蛋白质免疫印迹法(Western blot)检测PRMT1蛋白的表达 将肾脏组织加入蛋白裂解液中置于冰上匀浆,提取总蛋白,其蛋白水平测定采用BCA法。将蛋白样品按常规方法加入配制好的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中进行电泳后转至聚偏二氟乙烯(PVDF)膜,加入PRMT1(1∶2 000,美国Cell Signaling公司)经4 ℃孵育过夜后用磷酸盐缓冲液洗膜,经1 h室温孵育二抗后再次洗膜,加入电化学发光试剂后采集图像(BioRad 成像系统),分析光密度值(Quantity One软件)。
1.3.5免疫组织化学法 常规脱蜡并进行抗原热修复,按说明书进行一抗,在37 ℃下孵育2 h,经4 ℃过夜后标记二抗(用DAB显色),苏木精复染、脱水并用中性树脂封片,并于光镜下观察阳性细胞(细胞内出现棕黄色颗粒)进行图像分析,计算光密度值(Image-Pro Plus软件)。

2 结 果
2.1各组大鼠相关指标比较 见表1、2。DM组大鼠FBG水平较NC组明显升高,LM组与DM组比较明显降低,差异均有统计学意义(P<0.05);与NC组比较,DM组及LM组大鼠体质量、SBP、DBP、FINS、HOMA-IR、Cr、ACR及24 h mALB水平明显升高,而LM组较DM组明显降低,差异均有统计学意义(P<0.05)。
2.2各组大鼠肾脏组织中PRMT1的mRNA表达比较 见图1。与NC组比较,DM组及LM组大鼠肾脏组织中PRMT1的mRNA表达明显升高,差异均有统计学意义(P<0.01);而LM组的表达较DM组明显降低,差异有统计学意义(P<0.05)。
2.3各组大鼠肾脏组织中PRMT1蛋白表达比较 见图2。与NC组比较,DM组及LM组大鼠肾脏组织中PRMT1蛋白表达明显升高,而LM组的表达较DM组明显降低,差异均有统计学意义(P<0.05)。
2.4各组大鼠肾脏免疫组织化学法结果比较 见图3。NC组大鼠肾小管上皮细胞核内可见少量阳性细胞,DM组有大量阳性细胞,LM组也可见部分阳性细胞,介于NC组与DM组之间。NC组平均光密度值低于DM组及LM组,LM组光密度值低于DM组,差异均有统计学意义(P<0.05)。

表1 各组大鼠生化指标检测结果比较
注:与NC组比较,*P<0.05;与DM组比较,#P<0.05

表2 各组大鼠生理指标检测结果比较
注:与NC组比较,*P<0.05;与DM组比较,#P<0.05
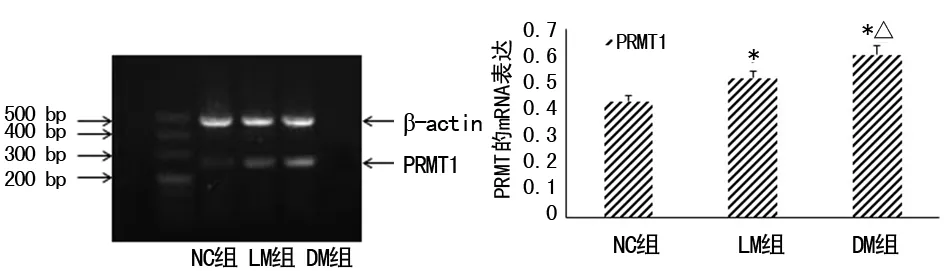
注:与NC组比较,*P<0.01;与LM组比较,△P<0.05
图1大鼠肾脏组织中PRMT1的mRNA表达
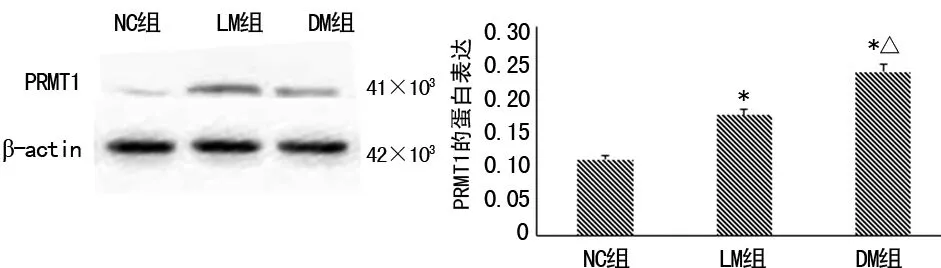
注:与NC组比较,*P<0.01;与LM组比较,△P<0.05
图2大鼠肾脏组织中PRMT1蛋白表达
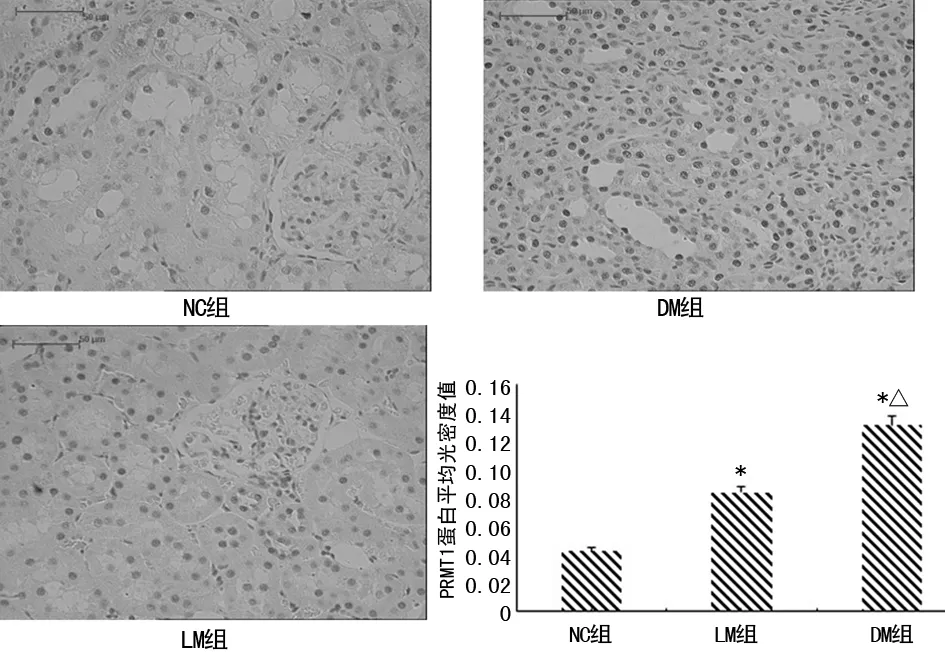
注:与NC组比较,*P<0.01;与LM组比较,△P<0.05
图3各组大鼠肾脏PRMT1蛋白表达免疫组织化学结果(HE,×400)
3 讨 论
利格列汀属于DPP4抑制剂,15%左右以原型经肾脏排泄,85%左右经粪便排出,故其不良反应少,肝肾功能不全者无需调整剂量,在众多DPP4抑制剂中有独特优势。本研究以糖尿病SD大鼠模型作为研究对象,采用利格列汀干预治疗12周,结果显示该药除明显降糖作用外,还能降低其肾脏组织中PRMT1的表达,明显减少24 h mALB及ACR,降低血Cr及血压水平,提示利格列汀有肾脏保护作用,可能与下调肾脏组织中PRMT1的表达有关,推测其机制可能有以下几方面。
3.1抑制氧化应激 DPP4抑制剂对肾脏功能的保护作用机制可能与抑制氧化应激有关,相关研究也发现,DPP4抑制剂能够预防和改善心脏和肾脏组织的氧化应激状态[6]。PRMT1-ADMA-DDAH1通路在糖尿病的氧化应激中起重要作用。PRMT1的表达在糖尿病高氧化状态下升高,而DDAH1的表达却下降,导致ADMA水平升高。有研究发现,PRMT1-ADMA-DDAH1通路在糖尿病大鼠的多个器官,如胰腺、肾脏及眼中均表达失衡[3-5]。本研究发现,通过利格列汀干预治疗后,糖尿病大鼠肾脏组织中PRMT1 mRNA及蛋白表达均明显降低,证实了利格列汀对PRMT1-ADMA-DDAH1通路关键蛋白的调节作用,提示其具有抗氧化应激效应,与近期研究结果相似[7]。但本研究未对该轴其余2个分子的水平进行检测,后续研究可围绕利格列汀作用于PRMT1相关通路展开进一步研究。
3.2改善血流动力学和抑制血管增生 正常肾动脉呈高速低阻的血流动力学特点,随着糖尿病病情进展,受损血管内皮细胞不断增生,加重血管管腔的狭窄和闭塞。目前认为,ADMA升高可能是糖尿病患者导致血管内皮功能失调的主要机制。DPP4抑制剂可抑制血管增生,改善血管内膜与中膜比率及肾动脉血流动力学,抑制肾脏纤维化及血管内皮增生,从而达到肾脏保护作用[8-9]。本研究显示,通过利格列汀干预治疗后,糖尿病大鼠肾小管上皮细胞核中PMRT1表达明显降低,且SBP、Cr水平均下降。本研究推测这是由于利格列汀通过降低肾小管上皮细胞核中的PRMT1水平,抑制ADMA表达,从而减轻对血管内皮功能的损伤,加上利格列汀对血压的改善,减轻了DN状态下高阻低速的血流动力学改变,从而降低Cr水平。本研究未检测血流动力学及内皮细胞的相关指标,这是本研究的不足之处。
3.3减轻胰岛素抵抗及减少尿蛋白 早期研究发现,ADMA升高伴随胰岛素抵抗发生,而胰岛素抵抗是糖尿病和高血压的共同发病基础[10]。本研究发现,通过利格列汀干预治疗后,大鼠体质量明显下降,胰岛素抵抗明显改善,血糖得到较好控制。本研究推测,除DPP4抑制剂本身通过肠促胰岛素途径降低血糖外,利格列汀也可通过对PRMT1-ADMA-DDAH1轴的影响,改善胰岛素抵抗,从而改善血糖水平。另外,DPP4抑制剂还有降低DN患者尿蛋白及改善肾脏功能的作用[11]。本研究结果提示,利格列汀单药治疗12周后可明显减少糖尿病大鼠24 h mALB、ACR及血Cr水平。作者推测,血糖降低本身可从一定程度上改善肾功能和蛋白尿,但利格列汀除降糖机制的降尿蛋白作用外,还对肾功能起到一定保护作用。
综上所述,利格列汀可以通过对糖尿病大鼠肾脏中PRMT1表达的影响,起到改善氧化应激、抑制血管增生、改善肾脏血流动力学、缓解胰岛素抵抗和减少尿蛋白等作用,在一定程度上延缓和改善了DN的发生和发展。

