脂肪间充质干细胞移植对输血相关急性肺损伤大鼠巨噬细胞表面TLR4及CD40 的影响
王景顺
(漯河市中心医院 漯河医学高等专科学校第一附属医院输血科,河南 漯河 462000)
输血相关急性肺损伤(TRALI)是指经过输血或血液相关制品后引起的肺组织急性损伤,发病急,死亡率高,可达14%〔1~6〕。TRALI多表现为呼吸衰竭及肺水肿,因输血引起的肺水肿为非心源性。TRALI发病机制复杂,至今尚未明确,已有研究证实,巨噬细胞激活及巨噬细胞表面Toll样受体(TLR)4、CD40 表达的改变是 TRALI 发生的关键环节〔7~9〕。干细胞是一类能够在特定条件下分化成各种组织器官的细胞〔10~14〕,大量研究将干细胞移植运用于各种疾病的治疗,已经取得了令人瞩目的进展〔15~23〕,包括对TRALI的改善及治疗。脂肪间充质干细胞(ADMSCs)不仅来源广泛,而且具有较强的分化及增殖能力〔24~32〕,成为继骨髓干细胞之后的又一热点。本研究旨在探究ADMSCs对巨噬细胞表面TLR4、CD40 的影响。
1 材料与方法
1.1实验动物 30只雄性SD大鼠,4~5周龄,体重(240±20)g,由河南医科大学动物研究中心提供。
1.2主要材料及来源 脂多糖(LPS,美国Sigma-Aldrich)、肿瘤坏死因子(TNF)-α,白细胞介素(IL)-1β及缺血预适应上调蛋白(MIP)-2 的酶联免疫吸附实验(ELISA)试剂盒(USA R&D)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)、8-羟基脱氧鸟嘌呤氯甲基苯甲酰氨(OhdG)蛋白测定试剂盒(南京迈博生物科技有限公司)、氯甲基苯甲酰氨(CM-DiI)细胞标记液(美国Molecular Probes公司)、显微镜(Leica 公司)、流式细胞仪(美国Coulter公司产品)、离心机(北京医用离心机厂)
1.3体外培养ADMSCs 大鼠腹腔注射麻醉,固定,手术刀切开皮肤,取5 g左右大鼠附睾处脂肪组织置于培养皿中,向培养皿中加入将200 U/ml青霉素及200 U/ml链霉素,将磷酸盐缓冲液(PBS)冲洗后的脂肪组织剪成乳糜样颗粒,首先加入0.25%胰蛋白酶除去结缔组织,然后加入适量的Ⅰ型胶原酶去除脂肪消化,60 min后取出培养皿,弃上清液,剩余的悬浊液经滤网过滤后收集于离心管中,1 500 r/min离心10 min,弃上清,加入PBS再次冲洗2遍,再离心,弃上清,上诉步骤重复3次后加入完全培养基,培养箱中培养72 h后换新的培养基,弃上清同时将未贴壁的细胞一同弃去,之后每隔1 d以同样的方法更换一次培养基,同时察看细胞的生长情况〔33〕。
1.4大鼠TRALI模型的建立及实验分组 雄性SD大鼠随机分为假手术组、TRALI 组及移植组各10只。经腹腔注射2 mg/kg LPS,注射完毕2 h后麻醉,经股静脉抽约1 ml血液,再注入等量人血浆。移植组小鼠采用同上述方法,注射完血浆后注入1 ml ADMSCs混悬液;而假手术组采用TRALI组同样的方法后注射1 ml生理盐水〔34〕。
1.5荧光显微镜观察CM-Dil标记的ADMSCs存活及分布情况 移植组大鼠处死后取少许肺组织,加入适量的胰酶及乙二胺四乙酸进行细胞消化,经过一定时间后加入含血培养基停止消化。吸取少量细胞液于离心管中离心,随后反复冲洗后加入适量CM-DiI细胞标记液,用胶头滴管反复吹打细胞液使细胞与标记液充分接触,标记完毕将其置于培养箱中培养孵育,20 min后取出细胞液再次离心、洗涤后,加入少量台盼蓝染色,计数,将已标记CM-DiI的ADMSCs继续培养,在显微镜下观察细胞生长及形态变化。
1.6ELISA检测血清及肺组织TNF-α、IL-1β及MIP-2 的含量 分别抽取等量血液,然后处死大鼠,取肺组织消化离心后制成细胞液备用。分别从各组中吸取少量的血液及细胞液加入到板条空白孔中,做好标记,用封板胶纸进行封闭后置于特定条件下培养,90 min后取出,将各板孔反复冲洗,然后加入等剂量生物素化抗体,再次封孔培养1 h,取出,反复洗涤,加入等量的酶结合物工作液在上述相同条件下孵育,30 min后洗涤,加入显色液30 min反复冲洗,加入终止液使反应停止,置于酶标仪上测定,TNF-α、IL-1β及MIP-2 均为已知消光系数的化合物。
1.7实时荧光定量聚合酶链式反应(RT-PCR)检测大鼠肺组织TLR4、CD40、核转录因子(NF)-κB基因相对表达量 肺组织加入适量Trizol提取总RNA,按照Fermentas 逆转录试剂盒的说明书合成第一条cDNA,依此为模板逆转录,然后对TLR4、CD40、NF-κB基因进行PCR 扩增,分别测定TLR4、CD40、NF-κB基因的表达量。TLR4引物序列:上游引物5′-GAAATGGAGGCACCCCTTC-3′,下游引物5′-TGGATACGTTTCCTTATAAG-3′,反应产物为548 bp。CD40引物序列:上游引物5′-CTTCTTCCGACCGTGACATGC-3′,下游引物5′-ATGGTTCGTCTGCCTCTGCAG-3′,扩增后 DNA片段长330 bp。NF-κB引物序列:上游引物5′-ATCTGTTTCCCCTCATCTTTCC-3′,下游引物5′-TGGGTGCGTCTTAGTGGTATCT-3′,产物长度217 bp。β-actin引物序列:上游引物5′-CATCTCTTGCTCGAAGTCCA-3′,下游引物5′-ATCATGTTTGAGACCTTCAACA-3′,反应产物为300 bp。TLR4、CD40、NF-κB产物与β-actin产物光密度积分的比值作为TLR4、CD40、NF-κB mRNA的表达量。
1.8外周血巨噬细胞检测TLR4、CD40、NF-κB的mRNA 表达量 经离心等相关操作后从大鼠血液提取出巨噬细胞,并提取总RNA,按照试剂说明书合成cDNA,并以此为模板进行逆转录,对 TLR4、NF-κB、CD40 进行PCR 扩增,计算mRNA 含量,整个操作按照相关说明进行。
1.9采用放射免疫沉淀试剂盒检测SOD、GSH、MDA、8-OhdG 含量 肺组织加入生理盐水制成匀浆,分别取出少量匀浆进行离心,取上清液用于SOD、GSH、MDA、8-OhdG 含量测定,整个操作均按照试剂说明进行。
1.10采用苏木素-伊红(HE)染色观察小鼠肺组织病理变化及计算湿干比 取双侧肺组织加10%甲醛固定24 h后,用石蜡包埋,切片(切片厚度应均匀),HE染色,将切片封固及烤干后放在显微镜下观察。取肺组织,置于锡箔纸上,将锡箔纸的质量设定为W0,将放有肺组织的锡箔纸一起称量,质量设定为W1,肺组织湿重为W1-W0。烘干72 h后取出再次称重,得W2,组织干重为W2-W0,组织湿重与干重的比值即为湿干比。
1.11统计分析 采用SPSS17.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1ADMSCs存活及分布情况 荧光显微镜下可见经过标记及台盼蓝染色后的细胞生长良好,经过标记的细胞显红色荧光,阳性标记率达98%以上。细胞形态呈梭形,形态良好,而早期细胞内含有较多的荧光颗粒,细胞核却不被染色,见图1。

图1 CM-DiI标记的ADMSCs(×200)
2.2各组血清及肺组织TNF-α、IL-1β及MIP-2含量 与假手术组相比,TRALI 组血清和肺组织TNF-α、IL-1β及MIP-2浓度明显增高(P<0.05)。与TRALI 组相比,移植组血清和肺组织TNF-α、IL-1β及MIP-2含量显著降低(P<0.05)。见表1。

表1 各组血清及肺组织TNF-α、IL-1β及MIP-2含量
与假手术组比较:1)P<0.05;与TRALI组比较:2)P<0.05;下表同
2.3各组肺组织TLR4、CD40、NF-κB mRNA相对表达量 与假手术组相比,TRALI 组肺组织TLR4、CD40、NF-κB mRNA 表达量均显著增高(P<0.05);而与TRALI 组相比,移植组TLR4、CD40、NF-κB mRNA表达量显著降低(P<0.05)。见表2、图2。

表2 各组肺组织TLR4、CD40、NF-κB mRNA表达量比较

图2 各组肺组织TLR4、CD40、NF-κB mRNA相对表达量
2.4各组外周血巨噬细胞中TLR4、CD40、NF-κB mRNA表达量 与假手术组比较,TRALI 组巨噬细胞中TLR4、CD40、NF-κB mRNA 表达量显著增高(P<0.05);与TRALI 组相比,移植组TLR4、CD40、NF-κB mRNA表达量显著降低(P<0.05)。见表3、图3。

表3 各组外周血巨噬细胞中TLR4、CD40、NF-κB表达量

图3 各组外周血巨噬细胞中TLR4、CD40、NF-κB mRNA的表达
2.5肺组织SOD、GSH、MDA、8-OhdG含量 TRALI组肺组织SOD、GSH含量显著低于假手术组,MDA、8-OhdG 含量显著高于假手术组(P<0.05);移植组SOD、GSH含量显著高于TRALI 组,MDA、8-OhdG含量显著低于TRALI 组(P<0.05)。见表4。

表4 各组肺组织SOD、GSH、MDA、8-OhdG 含量检测结果
2.6各组肺组织病理变化 显微镜下假手术组肺泡结构完整,大小较为一致,肺泡上皮细胞形态正常,肺泡间隔厚度正常,肺泡腔内无纤维蛋白,也未见明显出血。TRALI组肺间质水肿、出血,炎症反应加重,肺泡间隔增厚、肺泡内纤维蛋白浸润、肺泡内出血、支气管壁增厚。移植组的各种病理变化较TRALI 组明显好转。见图4。
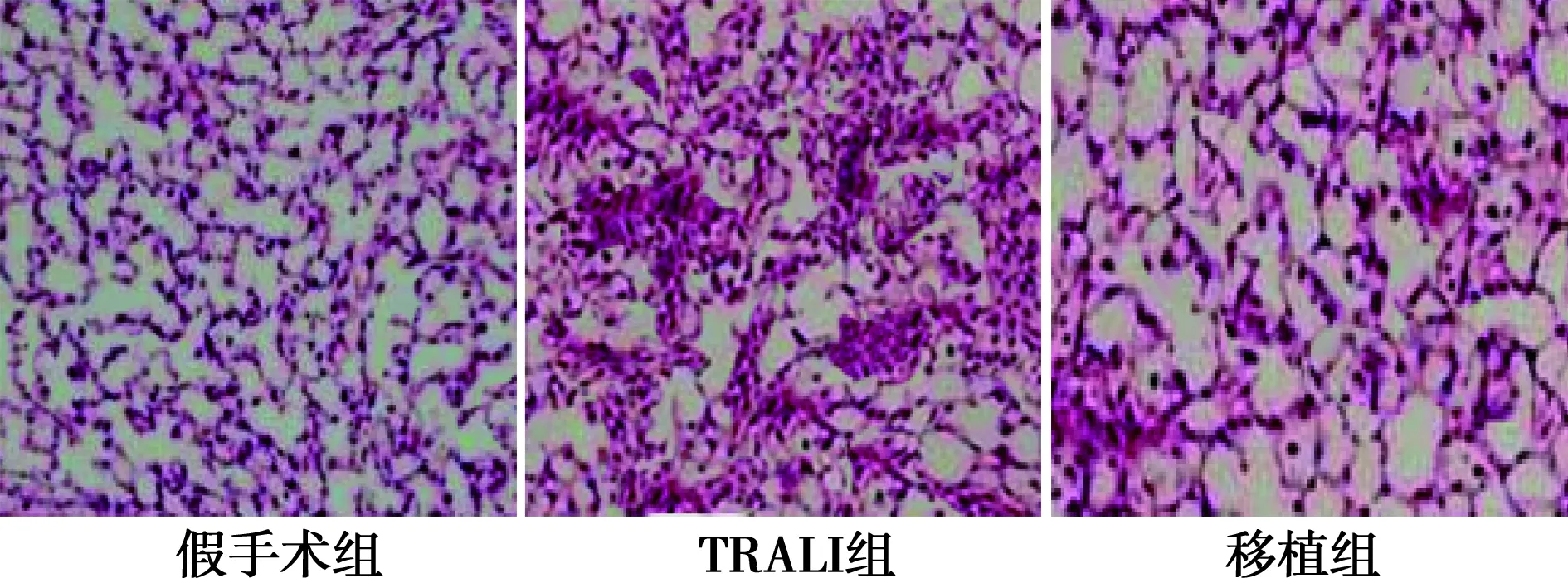
图4 各组肺组织病理变化(HE,×200)
2.7各组肺组织湿干比 TRALI组肺组织湿干比(3.96±0.49)显著低于假手术组(5.45±0.68)和移植组(4.16±0.73;P<0.05)。
3 讨 论
TRALI发病机制复杂,大量研究表明TRALI发病最可能的机制为“二次打击”〔35~39〕。本研究采用“二次打击”机制进行TRALI模型制备,首先对造模小鼠腹腔注射适量LPS为TRALI发生的第1事件;注射LPS后机体立刻启动免疫系统,经过2 h后再经尾静脉给予人血浆为TRALI发生的第2事件。研究发现,肺泡腔内充满巨噬细胞,认为巨噬细胞是肺部炎症反应的一个调节阀,当受到两次打击后调节阀打开,炎症反应被激活,通过一系列炎症连锁反应最终导致 TRALI形成〔40〕。TLR4是巨噬细胞表面的一个受体,在第一次打击事件中TLR4是LPS的重要受体,LPS通过与TLR4结合进一步激活 NF-κB,进而启动多种炎症介质表达〔41〕。除此之外,被激活后的NF-κB 还可以促进共刺激分子CD40表达,进一步加重炎症反应〔42〕。目前已有研究表明TLR4 和 CD40的过度表达是导致TRALI 发病的重要环节〔43~46〕。TRALI 时大鼠体内活化巨噬细胞表面 TLR4 及 CD40表达量显著升高,进而会通过一系列炎症反应、氧化应激反应、内质网应激等环节造成肺损伤〔47~49〕。
本研究提示TRALI后TLR4及CD40表达量明显上升,诱发炎症等一系列反应,ADMSCs移植后可减轻肺损伤程度。

