活性氧促进中性粒细胞与骨髓基质细胞黏附及机制初探*
尤媛媛, 许 倩, 祝飞美, 任泓宇, 杜 宇, 苗峻铭, 王 祎, 陈善泽, 陈军利, 王晓樱, 李婧瑜, 黄 宁
(四川大学华西基础医学与法医学院病理生理教研室, 四川 成都 610041)
活性氧(reactive oytgen species, ROS)最初被人们熟知是基于吞噬细胞的“呼吸爆发”及其对机体的氧化损伤,而越来越多的研究发现低浓度活性氧具有调控细胞信号传导的非传统功能[1-2]。这一生物功能往往涉及氧化还原调节并表现为蛋白上特定半胱氨酸的巯基修饰,例如S-谷胱甘肽化。S-谷胱甘肽化是一种重要的可逆性修饰,一般是由ROS促进蛋白半胱氨酸上的自由巯基(—SH)与还原型谷胱甘肽(glutathione,GSH)作用,形成蛋白-谷胱甘肽混合二硫加合物(protein-SSG,Pr-SSG);而去谷胱甘肽化主要由谷氧还蛋白(glutaredoxin,Grx)调控。Grx具有广泛的S-谷胱甘肽化还原酶活性,它表达水平的变化可导致多种蛋白的S-谷胱甘肽修饰改变。越来越多的研究表明S-谷胱甘肽化影响胞内外许多蛋白的功能,比如核因子κB(nuclear factor-κB,NF-κB)、肌动蛋白(actin)、细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)、高迁移率族盒蛋白1(high mobility group box 1 protein,HMGB1)、白细胞介素1β(interleukin-1β,IL-1β)等[3],从而调控了细胞多种生理或病理过程。
作为天然免疫中非常重要的细胞成分之一,中性粒细胞静息和应激情况下在外周循环中的数量必须受到严格控制,以避免免疫功能下降或炎症反应过度等。静息情况下,绝大多数成熟的中性粒细胞储存在骨髓中;在炎症等应激情况下再快速动员并进入外周循环参与免疫应答。骨髓基质细胞(bone marrow stromal cells, BMSCs)是一类异质细胞,对维持骨髓微环境起重要作用,亦参与调控造血干细胞和中性粒细胞在骨髓中的停留与释放[4]。骨髓是具有较高氧化性的微环境, 因此我们推测活性氧可能参与了中性粒细胞与骨髓基质细胞的相互作用,从而调节中性粒细胞在骨髓中停留与释放的过程。而这一过程很可能通过活性氧诱导的S-谷胱甘肽化来实现,但这些生物学现象和机制迄今未见相关文献报道。基于此,本研究采用体外细胞黏附实验方法,研究活性氧在中性粒细胞与骨髓基质细胞黏附过程中的作用,并探讨在此过程中S-谷胱甘肽化所起的作用及靶向蛋白和通路。
材 料 和 方 法
1 实验动物
Grx1-/-小鼠由郭春宝教授友情提供,其背景为回交14代以上的C57BL/6小鼠;使用周龄匹配的野生型C57BL/6小鼠作为对照,购于成都达硕实验动物有限公司,许可证号为SYXK(川)2014-189;实验中均使用6~10周龄小鼠,雌雄不限。所有涉及小鼠的实验及实验人员都由四川大学华西基础医学与法医学院动物照顾和使用委员会批准和监督。
2 主要试剂
RPMI-1640、IMDM和α-MEM液体培养基购自Invitrogen;胎牛血清(fetal bovine serum, FBS)购自上海生工;抗Grx1抗体购自Abcam;H2O2购自Sigma;CFDA-SE活细胞染料购自碧云天;其它生化试剂为进口分装或国产分析纯。
3 主要方法
3.1HL60细胞培养及诱导分化 稳定转染GFP-Grx1及GFP对照载体的HL60细胞系由H. R. Luo教授惠赠,采用含20%灭活FBS和1%青霉素/链霉素(P/S)的RPMI-1640培养基培养,每隔3~4 d传代1次。利用含1.3% DMSO、20% FBS和1% P/S的IMDM培养基培养诱导5~6天,HL60细胞分化为具有成熟的中性粒细胞特性的细胞dHL60,可用于下一步黏附实验。分化时,只选取传代次数小于20次的HL60细胞。
3.2分离小鼠骨髓中性粒细胞 根据骨髓中性粒细胞与其它骨髓细胞的密度差异,采用梯度密度离心法分离骨髓中性粒细胞。分离小鼠双侧长骨全骨髓细胞,70 μm细胞筛过滤后离心去上清,裂红后去上清,预冷PBS重悬后去上清,重复洗涤2次后用1 mL预冷PBS重悬后置于冰上备用;另一方面,将Percoll原液按9∶1用10×PBS稀释成100% Percoll工作液,用1×PBS将100% Percoll工作液稀释成81%、62%、55%和50%的浓度,按照由高浓度到低浓度的顺序依次以3、2、2和2 mL的量将对应工作液沿管壁轻轻加入15 mL离心管中。最后将重悬好的骨髓细胞悬液加入工作液最上层。以4 300 r/min转速无制动离心30 min,离心后收集81%和62%之间的细胞,加入5 mL预冷PBS中重悬并离心,后用PBS洗2遍,获得的细胞至少90%以上为小鼠骨髓中性粒细胞。
3.3分离小鼠BMSCs 根据骨髓基质细胞易与塑料表面黏附的特性分离BMSCs[5]。简而言之,分离小鼠双侧长骨全骨髓细胞,40 μm细胞筛过滤后离心去上清,用含20% FBS的α-MEM培养基重悬细胞并接种到细胞培养板中;每隔48 h给细胞换液去除悬浮细胞,直至无悬浮细胞;所得贴壁细胞即为BMSCs。
3.4体外细胞黏附实验 根据文献报道[6],将BMSCs按每孔5×103的密度接种到96孔板上,培养过夜;按照说明书用CFDA-SE标记小鼠骨髓中性粒细胞和dHL60细胞;用不同浓度的H2O2处理细胞;然后加入到BMSCs单细胞层上,37 ℃孵育30 min;洗去未黏附细胞,酶标仪检测各孔吸光度(A)值;黏着细胞A值与输入A值的比值即为黏附率。
3.5Western blot实验 离心收集诱导第5或第6天的phage-dHL60 和Grx1-dHL60 细胞, 加入适量RIPA裂解细胞,置于冰上30 min后以12 000 r/min离心15 min。取上清加入 5×SDS上样缓冲液,行SDS-PAGE后转印到PVDF膜,用5%脱脂牛奶封闭1 h,以1∶1 000比例稀释对应I抗(anti-Grx1或anti-actin),4 ℃孵育过夜。PBST洗涤30 min后,将各个抗体对应的II抗以1∶1 000稀释后室温孵育2 h,PBST洗涤30 min后,曝光成像。
3.6PCR鉴定Grx1敲除小鼠实验 剪小鼠尾尖约2 mm,浸入全基因组裂解液中[含50 mmol/L Tris (pH 8.8)、 1.0 mmol/L EDTA和0.5% Tween-20,用前加入蛋白酶K(终浓度200 mg/L)],56 ℃水浴孵育12 h后80 ℃灭活10 min。8 000 r/min离心5 s,放置至室温后取上清液用于PCR检测。所用引物:Grx1的正向引物序列为5’-CCAGCTCTCAGGAGATGACC-3’,反向引物序列为5’-AAAATCCCACACCCCTTTTC-3’;Neo的正向引物序列为5’-GCTTGGGTGGAGAGGCTATT-3’,反向引物序列为5’-GAACTCGTCAAGAAGGCGATA-3’。其中Grx1带为野生型,大小为699 bp;Neo带为敲除型,大小为750 bp。
4 统计学处理
每个结果至少进行3次重复实验,用Microsoft Excel软件进行分析。数据均采用均数±标准差(mean±SD)表示,组间两两比较采用双尾t检验,以P<0.05为差异有统计学意义。
结 果
1 活性氧促进中性粒细胞与BMSCs黏附
我们采用Diff-Quick染色方法检测从小鼠骨髓分离的中性粒细胞的纯度,结果显示,中性粒细胞的比例超过90%,可为后续实验使用,见图1A。前期文献报道骨髓外基质中ROS的浓度在0.01~10 μmol/L范围内[7]。根据文献和我们前期预实验结果,我们选择用0.1 μmol/L H2O2处理小鼠骨髓中性粒细胞,体外黏附实验结果表明0.1 μmol/L H2O2预处理的小鼠骨髓中性粒细胞与BMSCs的黏附率显著增高(P<0.05),见图1B。
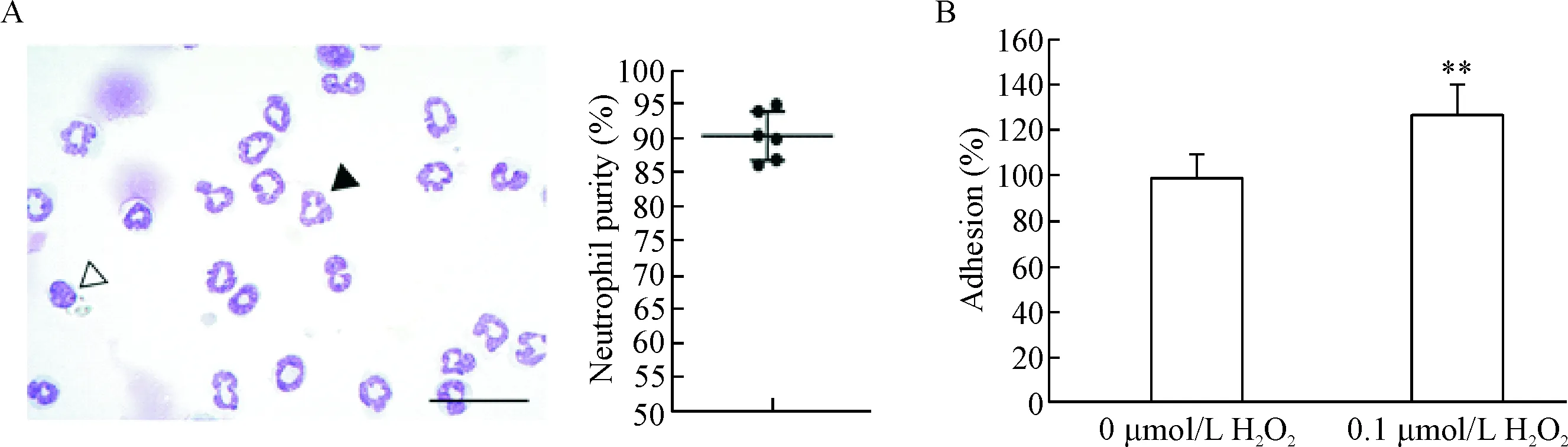
Figure 1.H2O2 enhanced the adhesion of murine neutrophils to BMSCs. A: Diff-Quick staining of purified murine bone marrow neutrophils (scale bar=50 μm); B: the adhesion rate of neutrophils to BMSCs after H2O2 treatment. Mean±SD. n=3. **P <0.01 vs 0 μmol/L H2O2.
2 过表达Grx1抑制中性粒细胞黏附到BMSCs
我们推测ROS诱导细胞黏附增加的效应可能是通过S-谷胱甘肽化来实现,因此,我们随后探究了改变中性粒细胞中去谷胱甘肽化酶Grx1的表达水平对这一过程的影响。我们先利用慢病毒载体构建稳定过表达Grx1的HL60细胞系,从而研究高表达Grx1对中性粒细胞与BMSCs黏附的影响。该慢病毒载体带有GFP荧光标签,结果显示,几乎所有对照(phage-dHL60)及过表达Grx1的(Grx1-dHL60)细胞均可见绿色荧光,见图2A。同时,Western blot的结果显示Grx1-dHL60细胞中Grx1蛋白的表达量明显高于phage-dHL60细胞,见图2B。这证实我们所用细胞系(Grx1-dHL60)稳定过表达Grx1蛋白。
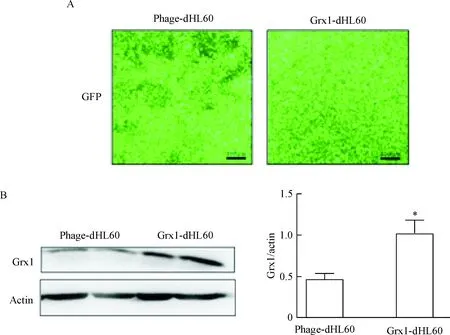
Figure 2.The expression of Grx1 in phage-dHL60 and Grx1-dHL60 cells. A. GFP fluorescence of phage-dHL60 and Grx1-dHL60 cells (scale bar=100 μm); B: Western blot was performed to determine the expression of Grx1 in phage-dHL60 and Grx1-dHL60 cells. Mean±SD. n=3. *P<0.05 vs phage-dHL60.
对dHL60细胞进行H2O2黏附实验,根据小鼠骨髓中性粒细胞的处理浓度(如图1)和预实验的结果,我们亦选用0.1 μmol/L H2O2处理dHL60细胞,结果可见H2O2预处理的dHL60细胞与BMSCs的黏附率明显增高(P<0.01),见图3。而对比phage-dHL60和Grx1-dHL60细胞,H2O2预处理后,黏附到BMSCs单细胞层上的Grx1-dHL60细胞明显少于phage-dHL60细胞(P<0.05),见图3。这表明降低中性粒细胞的S-谷胱甘肽化水平对活性氧促黏附的效应可能具有抑制作用。

Figure 3.Overexpression of Grx1 inhibited the adhesion between dHL60 cells and BMSCs. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L H2O2; #P<0.05 vs phage-dHL60.
3 敲除Grx1促进中性粒细胞与BMSCs黏附
为了更明确S-谷胱甘肽化在中性粒细胞与BMSCs黏附中所起的作用,我们用Grx1敲除小鼠来检测Grx1对这2种细胞黏附的作用。以小鼠全基因组DNA为模板的PCR结果显示Grx1-/-组几乎未检测到Grx1,见图4。分离野生型和Grx-/-小鼠的骨髓中性粒细胞进行体外黏附实验,结果表明更多Grx1-/-中性粒细胞与BMSCs单细胞层黏附(黏附率增加40%~50%,P<0.01),见图5。综上所述,我们的结果证实ROS促进中性粒细胞与BMSCs黏附是通过提高蛋白的S-谷胱甘肽化水平而实现的。

Figure 4.Amplification of Grx1 and Neo in WT and Grx1-/- mice.
4 血管细胞黏附分子1(vascular cell adhesion mo-lecule-1, VCAM-1)抗体抑制ROS介导的中性粒细胞与BMSCs黏附增强
大量报道及我们的前期实验结果表明,VCAM-1介导的黏附信号对造血干细胞及中性粒细胞在骨髓中停留与释放过程起重要作用[8]。我们猜测S-谷胱甘肽化的主要靶向信号可能是VCAM-1介导的黏附信号,因此,我们用VCAM-1抗体封闭BMSCs表面的VCAM-1,探究此信号通路是否参与ROS调节中性粒细胞与骨髓基质细胞黏附的过程。结果显示VCAM-1抗体处理抑制了H2O2介导的这2种细胞黏附增加(P<0.01),黏附率基本回复到未处理组水平,见图6。这提示VCAM-1自身或其介导的黏附信号中的其它蛋白可能是活性氧诱导黏附增加过程中S-谷胱甘肽化的靶向蛋白。
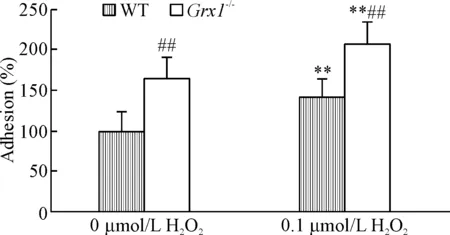
Figure 5.Depletion of Grx1 increased the adhesion between murine neutrophils and BMSCs. Mean±SD. n=3. **P <0.01 vs 0 μmol/L H2O2; ##P<0.01 vs WT.
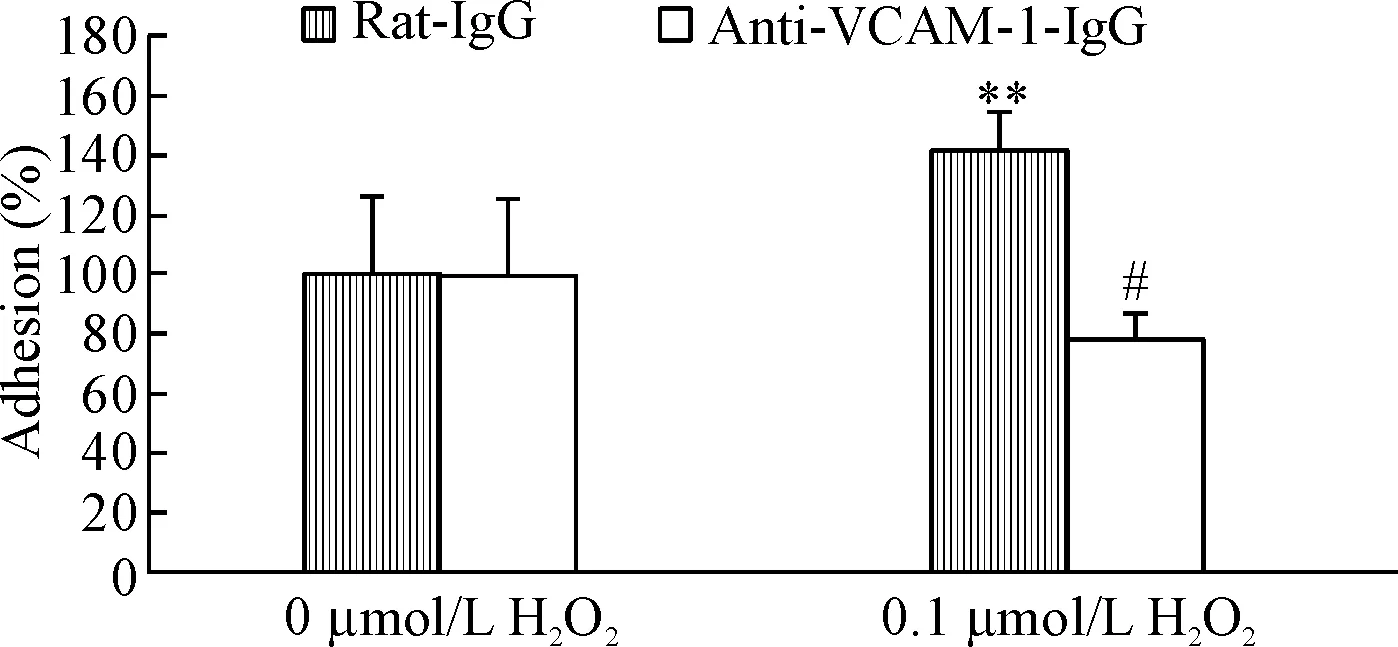
Figure 6.VCAM-1 antibody treatment decreased ROS-induced elevated adhesion between neutrophils and BMSCs. Mean±SD. n=3. **P<0.01 vs 0 μmol/L H2O2; #P<0.05 vs Rat-IgG.
讨 论
本研究首先观察到较低浓度的活性氧可促进中性粒细胞与BMSCs黏附。在研究其机制中,发现过表达Grx1能消除这种影响,反之敲除Grx1会更进一步促进黏附,证明中性粒细胞与BMSCs间黏附增加的过程可能是由ROS诱导的S-谷胱甘肽化来介导。我们的研究进一步发现VCAM-1抗体预处理BMSCs能阻断这一效应。这提示在骨髓中,ROS诱导的S-谷胱甘肽化调控中性粒细胞与基质细胞相互作用的靶点很可能是VCAM-1介导的黏附信号通路中的某一或某些分子,这为深入理解骨髓中性粒细胞停留与释放的调控机制提供了一些线索。
ROS对骨髓中的各组分的功能具有重要的调控作用,如ROS参与调控造血干细胞的更新、分化、动员和迁移等功能活动[9]。我们的前期研究也表明ROS诱导的S-谷胱甘肽化调控中性粒细胞的趋化和吞噬等过程[10]。因此,ROS介导的S-谷胱甘肽化很可能调控中性粒细胞在骨髓中的功能活动,比如停留和释放等。骨髓基质细胞包括成纤维细胞、巨噬细胞、脂肪细胞、成骨细胞和破骨细胞等,一般不直接参与造血作用,而是为造血干细胞和白细胞等提供重要的微环境,影响它们的增殖、成熟、分化、停留和动员等。鉴于骨髓基质细胞对维持造血干细胞及中性粒细胞在骨髓停留的重要作用[11],我们重点研究骨髓中性粒细胞与骨髓基质细胞相互作用过程中ROS所起的作用及其机制,结果表明ROS诱导S-谷胱甘肽化促进这2种细胞黏附,证明了我们的假设。其它研究也报道活性氧影响多种细胞之间的黏附主要受S-谷胱甘肽化的正向调控,比如嗜酸性粒细胞与血管内皮细胞、巨噬细胞与血管内皮细胞、黑色素瘤细胞与血管内皮细胞[6, 12]。
与氧化还原相关的修饰有S-谷胱甘肽化(Pr-SSG)、次磺酸化(RSOH)、亚磺酸化(RSO2H)和磺酸化(RSO3H)等。除S-谷胱甘肽化以外,其它修饰一般要求长时间或高浓度ROS的作用,且往往具有难以逆转的性质,因此多表现为对组织细胞功能的损伤。S-谷胱甘肽化作为一种可逆性的修饰,不但可以保护目的蛋白避免发生不可逆氧化而失活,还可能通过调控目的蛋白的活性或功能,从而调节细胞功能。我们在检测H2O2对中性粒细胞与BMSCs黏附的影响时,确实观察到低浓度H2O2促进黏附,高浓度 H2O2反而抑制黏附。在嗜酸性粒细胞与血管内皮细胞相互作用的研究也得到类似的结果,低浓度 H2O2(<10 μmol/L)促进细胞黏附,高浓度的 H2O2(>50 μmol/L)却反而抑制黏附[6]。骨髓微环境中ROS的水平即使在炎症诱导的应激情况下也很难达到50 μmol/L[7], 因此我们推测ROS促进中性粒细胞与BMSCs黏附的效应是通过S-谷胱甘肽化调控,而本研究的结果证明了我们的假设。
生物体内有几种还原性酶调控氧化还原反应过程,主要包括Grx、硫氧还蛋白(thioredoxin, Trx)和亚硫还蛋白(sulfiredoxin, Srx)[13],它们主要通过氧化自身的自由巯基来还原目的蛋白的修饰巯基,其中Grx家族被证实为重要的去谷胱甘肽化酶。在不同的生物体内Grx家族成员有所差异,哺乳动物细胞内主要有Grx1和Grx2 2个成员。而这2种Grx的分布有所不同,Grx2主要分布在线粒体内,Grx1则有多种分布,包括核内、胞浆中和胞外等[10];因此Grx1可能作用于更广泛的S-谷胱甘肽化靶向蛋白。本研究证明Grx1调控去谷胱甘肽化,从而抑制了ROS诱导的中性粒细胞与骨髓基质细胞黏附增加。而Grx2在这一过程的作用还有待于今后继续研究。
在调控中性粒细胞与BMSCs黏附过程中,我们对S-谷胱甘肽化修饰及Grx1作用的具体靶点还知之甚少。大量的证据表明VCAM-1/VLA-4黏附信号是造血干细胞/祖细胞在骨髓中停留与释放过程中的关键黏附信号[14]。虽然CXCR2配体/G-CSF信号被证实为调控中性粒细胞在骨髓中停留与释放最主要的信号通路[15],但我们的相关研究表明CXCR2配体/G-CSF信号很可能不受S-谷胱甘肽化影响。因此,我们推测Grx1与ROS介导的S-谷胱甘肽化调节中性粒细胞与基质细胞在骨髓中相互作用的靶点为VCAM-1/VLA-4黏附信号。确实,VCAM-1抗体处理BMSCs后,ROS诱导的黏附增强被抑制,基本回复到未处理组水平。而具体的修饰靶点及位点值得进一步研究。

