基于CRISPR/Cas9技术构建SETD2基因敲除鼻咽癌细胞株并分析其增殖特性*
王思思, 廖晓敏▲, 邵钟铭, 袁建玲, 封慕茵, 哈艳平, 李汝佳, 申志华, 揭 伟△
(广东医科大学基础医学院 1病理学系, 2病理生理教研室, 广东 湛江 524023)
基于非基因组DNA突变的表观遗传学调控异常与肿瘤的发生、发展密切相关。组蛋白修饰是表观遗传学调节中的重要机制之一,通过甲基化、乙酰化、磷酸化、泛素化和其它多种修饰方式调节基因的表达[1-2]。人类SETD2基因位于第3号染色体短臂的2区1带(3p21.31), 长度大约为192 kb, 包括23个外显子和22个内含子。SETD2蛋白是组蛋白H3第36号位赖氨酸三甲基化(H3K36me3)转移酶[3]。H3K36me3 作为基因活化标志,参与基因转录起始的抑制、生物的生长发育、转录因子p53的激活及DNA的修复等众多生物学过程。近年发现SETD2基因在多种人类肿瘤中存在突变,其表达普遍呈下降趋势,具有抑癌基因作用,可能是肿瘤治疗的潜在靶点[4-6],但SETD2基因在肿瘤发生、发展中的确切机制尚不清楚。
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国华南地区的多发性恶性肿瘤,具有显著的流行病学特征。NPC的发生、发展是多因素综合作用的结果,与遗传易感性、EB病毒感染及环境因素等紧密相关。我们课题组前期就NPC的发病机制进行了系列研究,发现了一些与NPC临床侵袭、进展密切相关的基因表达或信号异常,为进一步阐明NPC的发病学提供了新的线索[7-12]。迄今,与NPC高度相关且具有临床转化意义的分子治疗靶点的涉疑基因仍少见。SETD2与NPC的报道极少[13], SETD2异常在NPC中的发生和发展中是否发挥作用尚不清楚。
基因组编辑是指对目标基因进行定向操作,实现对特定DNA片段的敲除或加入等。以ZFN (zinc-finger nucleases)和TALEN (transcription activator-like effector nucleases)为代表的序列特异性核酸酶技术能够高效率地进行定点基因组编辑, 在基础研究、基因治疗和遗传改良等方面展示出了巨大的潜力。近来开发并不断完善的成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)/CRISPR相关蛋白9(CRISPR-associated protein 9, Cas9)技术是继ZFN和TALEN之后出现的第3代“基因组定点编辑技术”[14-15],具有高效、简便的优点,目前在基因组编辑中受到极大的重视。本研究拟应用CRISPR/Cas9技术,对高表达SETD2的NPC细胞进行基因组编辑获得SETD2基因敲除的稳定细胞株,初步分析SETD2在NPC增殖中的作用,为后续深入研究NPC中SETD2的生物学功能及分子机制提供参考资料。
材 料 和 方 法
1 细胞系
永生化鼻咽黏膜上皮细胞系NP-69、高分化鼻咽癌细胞系CNE1、低分化鼻咽癌细胞系CNE2Z及未分化鼻咽癌细胞系C666-1均为我室保存。
2 主要试剂及仪器
基于pCRISPR-CG01质粒(元件序列:U6-sgRNA-CMV-T7-Cas9-Sv40-mCherry-IRES-Neo)构建的含针对人SETD2基因的CRISPR/Cas9质粒及相应小向导RNA(small guide RNA,sgRNA)均委托GeneCopoeia旗下广州复能公司进行设计和制备。3条sgRNA靶向位点分别为5’-GATGGGGGATTTCTACGACC-3’、 5’-TCTAGTCGATTTTTGCCCAA-3’和5’-GGAGTCGAGTCTACCTGAAG-3’。pCRISPR-CG01质粒物理图谱参见GeneCopoeia相关网页。DMEM培养液和胎牛血清(HyClone);NP-69上皮细胞专用培养液和Lipofectamine 3000(Invitrogen);蛋白裂解液、BCA蛋白定量试剂盒、CCK-8试剂、NC膜和ECL发光液(碧云天);兔抗人SETD2 I抗(GeneTex);兔抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、GAPDH和tubulin I抗(Cell Signaling Technology);兔抗人细胞周期素D1(cyclin D1)、cyclin B1、cyclin E1、cyclin A2、CDK2、CDK4、CDK6、p16、p21 I抗及HRP标记的II抗(ProteinTech);TRIzol试剂(Ambion);RT-PCR试剂盒(TaKaRa);PCR引物(上海生工)。CO2培养箱(BNA-311型,Thermo);PCR仪(Eppendorf);转膜仪及水平电泳系统(BioRad);FACS Canto II型流式细胞仪(BD);酶标仪(BioTek);凝胶成像系统(上海天能)。
3 方法
3.1细胞培养 参考既往方法进行细胞培养[8-11]。简言之,NP-69细胞用含5% 胎牛血清的上皮细胞专用培养液重悬,接种于6 cm培养皿,置于37 ℃、5%CO2、饱和湿度条件下培养,每3 d换液一次;CNE1、CNE2Z及C666-1细胞均以含10% FBS、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液重悬,接种于6 cm培养皿,置于37 ℃、5% CO2、饱和湿度条件下培养,每2天换液1次。取对数生长期细胞用于相关实验。
3.2CRISPR/Cas9质粒转染及单克隆细胞株筛选和鉴定 CNE1细胞接种12孔板,将3种CRISPR/Cas9质粒混合成cocktail,按Lipofectamine 3000说明书将3 μg混合质粒转至CNE1细胞。转染48 h后荧光显微镜下观察红色荧光的阳性情况并在孔板背面相应位置做好标记,将标记处的细胞用0.25%胰酶消化并转移至96孔板,调整浓度为每孔接种1个细胞,待生长出单克隆细胞后扩大培养并进行Western blot鉴定SETD2蛋白表达。
3.3Western blot 各组细胞经冷PBS洗涤,加入细胞裂解液提取总蛋白,应用BCA法定量蛋白浓度。取30~50 μg蛋白进行SDS-PAGE,将蛋白转移至NC膜。根据待检测目的蛋白的分子量大小,将NC膜剪成一定大小,各膜经含5% BSA的TBST室温摇床上封闭1 h,TBST洗涤3次后与相应I抗4 ℃孵育过夜,各抗体稀释比例如下: SETD2, 1∶500; PCNA, 1∶500; cyclin D1, 1∶500; cyclin B1, 1∶500; cyclin A2, 1∶500; cyclin E1, 1∶500; CDK2, 1∶500; CDK4, 1∶500; CDK6, 1∶500; p16, 1∶500; p21, 1∶500; Tubulin, 1∶3 000; GAPDH, 1∶500。TBST洗涤3遍,每遍15 min,各膜再与HRP-标记IgG室温下结合1 h,洗涤后经ECL发光液显影,凝胶成像分析系统扫描条带,ImageJ软件分析蛋白条带灰度值。实验重复3次。
3.4RT-PCR TRIzol提取细胞总RNA,紫外分光光度计测定A260/280以判断RNA浓度及纯度,取500 ng 总RNA逆转录为cDNA。经PCR在线引物设计平台(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计跨外显子引物。SETD2(NM_014159.6)上游引物序列为5’-CCTCTTCTGCCTATGAGCGG-3’, 下游引物序列为5’-ATGTGGCACCACTGGTACTG-3’,PCR产物434 bp; 内参照GAPDH(NM_002046.6)上游引物序列为5’-CCGCATCTTCTTTTGCGTCG-3’, 下游引物序列为5’-TGGAATTTGCCATGGGTGGA-3’,PCR产物217 bp。20 μL PCR体系含PCR 2×buffer 10 μL(含Taq酶及dNTPs)、cDNA 4 μL、引物1.6 μL (含上、下游)和ddH2O 4.4 μL。 PCR循环参数: 94 ℃预变性2 min; 94 ℃ 40 s, 60 ℃ 40 s, 72 ℃ 60 s,共35个循环;最后72 ℃延伸5 min。PCR产物经1.5%琼脂糖凝胶电泳,凝胶成像系统拍照,ImageJ软件分析条带灰度值。实验重复3次。
3.5CCK-8检测细胞活力 细胞按每孔2×103个接种于96孔板,过夜孵育贴壁。按贴壁后培养时间0 h、24 h、48 h及72 h每孔加入10 μL CCK-8试剂,37 ℃继续孵育3 h,酶标仪上读取450 nm的吸光度,每组5个复孔,实验重复3次。
3.6平板集落形成实验 细胞按每皿200个接种于3 cm培养皿,每2 d换液一次,连续培养14 d。取出培养皿,PBS洗涤1次,4%中性甲醛固定细胞30 min,PBS洗涤2次,0.1%结晶紫染色15 min,PBS洗涤2次。统计≥50细胞的克隆数量并计算克隆形成率。每组3个复孔。
3.7细胞周期分析 细胞接种于6孔板,48 h后收获细胞,4%冷甲醛固定,PBS洗涤1次, 37 ℃、避光条件下细胞经PI和RNasin处理15 min,采用BD FACS Canto II流式细胞仪分析细胞周期的分布,每组重复3孔。
4 统计学处理
使用GraphPad Prism 7.0软件进行统计分析。数据以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用Student-Newman-Keuls检验,以P<0.05为差异有统计学意义。
结 果
1 不同分化状态NPC细胞系中SETD2的表达
分别应用半定量RT-PCR和Western blot检测SETD2基因在不同分化状态NPC细胞系中的转录及翻译水平,结果显示,与永生化鼻咽黏膜上皮细胞系NP-69相比,高分化CNE1细胞、低分化CNE2Z细胞及未分化C666-1细胞中SETD2 mRNA及蛋白水平均呈逐渐下降趋势(P<0.01),尤其是C666-1细胞中几乎检测不到SETD2 mRNA及蛋白,见图1。
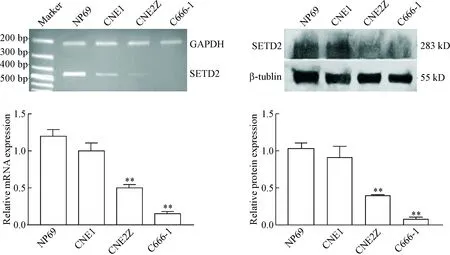
Figure 1.Detection of SETD2 expression in nasopharyngeal carcinoma cells in various differentiation status by RT-PCR (A) and Wes-tern blot (B). Mean±SD. n=3. **P<0.01 vs NP-69 cells.
2 基于CRISPR/Cas9技术成功敲除NPC细胞中的SETD2基因
在明确了CNE1具有较高水平的SETD2表达后,我们采用CRISPR/Cas9方法对该细胞进行SETD2基因组编辑。通过脂质体介导的基因转染,将含SETD2特异性sgRNA的质粒导入细胞,在Cas9蛋白酶的作用下实现对靶DNA的切割。通过转染后的细胞中mCherry发出的红色荧光,初步筛选出转染阳性的细胞。收集细胞,再通过有限稀释法,将转染阳性细胞接种至96孔板进行单克隆细胞筛选,最终挑选出15个单克隆细胞株,再经过Western blot检测,观察到#2、#3、#4、#5、#9、#10、#11、#12、#13和#15等10个单克隆细胞株具有程度不等的SETD2蛋白水平下降,最终挑选#5和#9克隆作为SETD2基因敲除细胞,分别标记为CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9,见图2。以未进行编辑的细胞标记为野生型即CNE1-WT。后续实验即以这3个细胞株为实验对象。
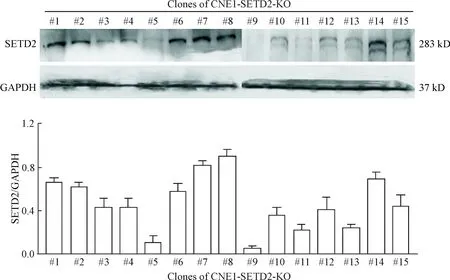
Figure 2.Expression of SETD2 protein in the 15 monoclones of SETD2 knockout cell strains. Mean±SD. n=3.
3 SETD2敲除促进了NPC细胞的活力
CCK-8实验结果提示,CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9细胞的活力均较同一时点的CNE1-WT细胞增加(P<0.05),见图3A;Western blot结果证实,与CNE1-WT细胞相比,CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9细胞中PCNA蛋白表达显著升高(P<0.01),见图3B。平板集落形成实验结果进一步证实,CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9细胞的集落形成效率均高于CNE1-WT细胞(P<0.01),见图3C。
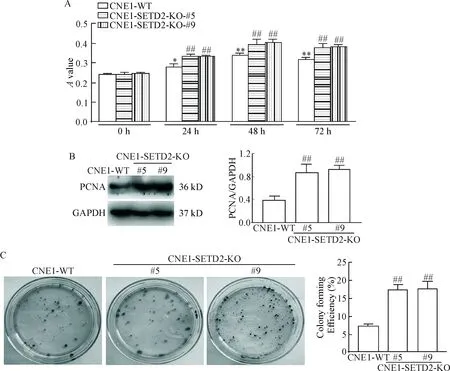
Figure 3.SETD2 knockout promotes the proliferation of NPC cells. A: CCK-8 assay was used to examine the viability of CNE1 cells before and after SETD2 knockout; B: Western blot analysis of PCNA protein levels in CNE1 cells before and after SETD2 knockout; C: plate colony forming assay was used to detect the colony formation efficiency of CNE1 cells before and after SETD2 knockout. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 h; ##P<0.01 vs CNE1-WT.
4 敲除SETD2后干扰了NPC细胞周期分布
流式细胞术结果提示,与CNE1-WT细胞相比,CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9细胞G1期比例均下降(P<0.01),而S期和G2/M期比例也有一定水平的升高(P<0.05),见图4。
5 敲除SETD2后干扰了NPC细胞周期相关蛋白的表达
Western blot检测结果表明,SETD2基因敲除后CNE1-SETD2-KO-#5和CNE1-SETD2-KO-#9克隆中cyclin D1、cyclin B1、cyclin A2、cyclin E1、CDK2和CDK4的表达增加,p21的表达减少(P<0.05), CDK6和p16表达改变不明显,见图5。
讨 论
SETD2基因是编码H3K36me3转移酶的唯一基因,具有重要的生物学功能[3]。SETD2在DNA修复,染色体分离和RNA剪接过程中发挥作用[16-18]。在多数人类肿瘤中均检测到SETD2基因存在突变的情况[19]。迄今,SETD2基因表达异常在肾细胞癌[20- 21]、乳腺癌[22]、骨肉瘤[23]、胃癌[24]、淋巴瘤[25]、白血病[26]和肺癌[27]等均有报道。SETD2基因作为潜在抑癌基因,其低表达与肿瘤预后相关,因而深入了解SETD2基因在人类肿瘤中的表达及失常机制对肿瘤的靶向治疗具有重要的意义。
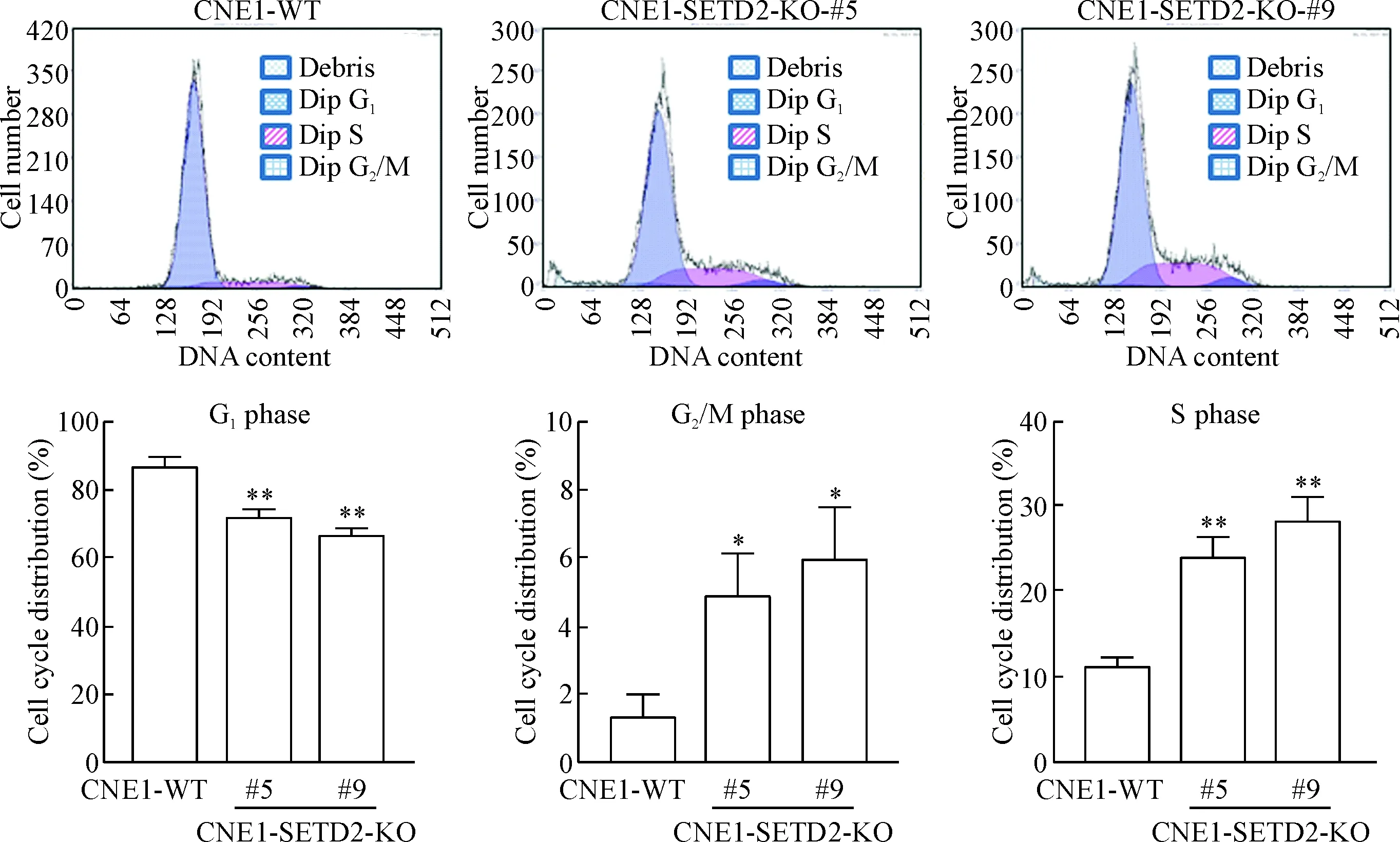
Figure 4.Flow cytometry analysis of cell cycle distribution. Mean±SD. n=3. *P<0.05, **P<0.01 vs CNE1-WT.
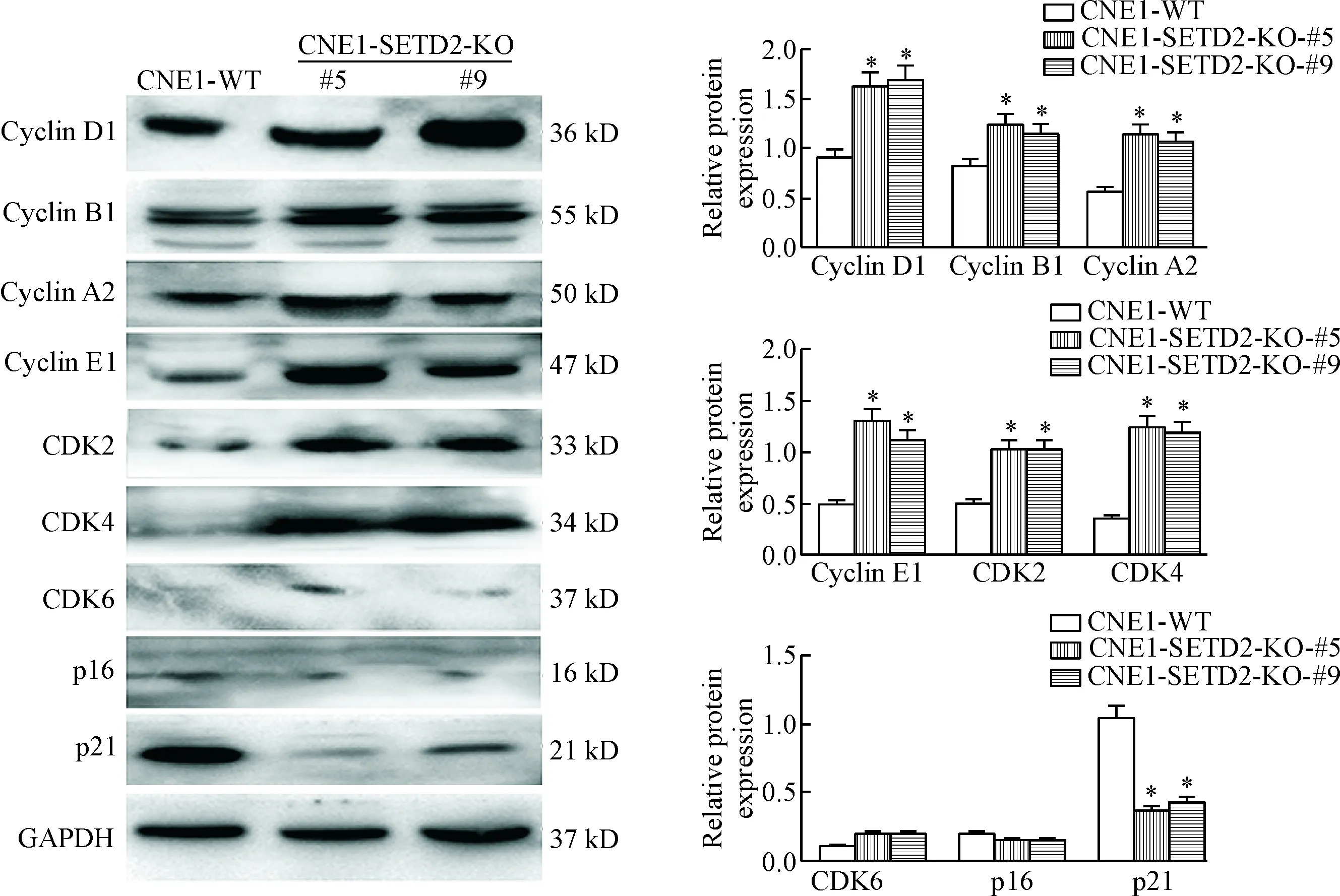
Figure 5.The expression of cell cycle-related proteins. Mean±SD. n=3. *P<0.05 vs CNE1-WT.
截止目前只有1篇有关SETD2与NPC的报道。研究表明,临床转移组NPC组织较未转移组NPC组织中SETD2 mRNA水平下降[13],初步从流行病学角度提示了SETD2在NPC临床进展中的作用,但缺乏具体分子机制的探索。为了解SETD2在NPC中的确切作用,我们首先对临床NPC标本中的SETD2蛋白进行了免疫组化的检测,结果显示相对于对照的鼻咽黏膜慢性炎症组织,NPC肿瘤细胞中SETD2蛋白表达明显下调(未发表资料),这一表达趋势与前述多种人类肿瘤中SETD2蛋白表达下降的趋势是一致的。随后,以永生化鼻咽黏膜上皮细胞系NP-69为对照,对不同分化程度的NPC细胞系进了SETD2转录及翻译产物的检测,结果证实随着分化程度的下降, SETD2的表达亦呈现下降趋势,初步提示了SETD2与NPC肿瘤细胞恶性行为负相关。我们以SETD2表达水平最高的高分化NPC细胞系CNE1为对象,采用基于CRISPR/Cas9的基因编辑技术,对CNE1细胞中SETD2基因进行敲除,最后从15个转染了SETD2 特异sgRNA的单克隆细胞中成功筛选出2个SETD2敲除单克隆作为后续研究的对象。本研究采用GeneCopoeia新开发的pCRISPR-CG系列sgRNA表达载体不仅可表达sgRNA,还可同时表达Cas9核酸内切酶,因此操作简便。SETD2基因敲除NPC细胞株的成功构建可为其生物学功能研究提供了基础。
对SETD2基因敲除前后的细胞进行增殖相关特性的分析表明,无论是检测短期效应的CCK-8实验还是评估长期效应的平板集落形成实验,其结果均证实SETD2敲除后细胞活力得以增加,并在分子水平上也观察到PCNA这一反映细胞增殖能力的蛋白表达水平也被上调。细胞周期分布上,SETD2基因敲除后显著减少了G1期但增加S期及G2/M期分布。从分子水平上,观察到SETD2基因敲除后显著增加了cyclin D1、cyclin B1、cyclin A2、cyclin E1、CDK2和CDK4的表达,明显减低了p21的表达。细胞周期素、细胞周期素激酶及细胞周期素激酶抑制因子的协调表达是介导细胞周期进展的核心机制。已有报道,SETD2通过与p53作用进而影响多个下游基因如p21的表达[28],本项试验再次证实了SETD2对p21的调节作用。然而,一项有关肌母细胞C2C12的研究中指出,SETDE2敲除后导致细胞增殖能力下降,表现为p21表达的上调及G1/S和G2/M周期转换的障碍[29],这一结论与本研究恰好相反,提示了SEDT2对细胞周期的调节作用可能具有细胞类型的差异性。新近的一项研究也指出,SETD2基因是进化上保守的细胞周期调控基因,其突变可能是人类肿瘤发生的机制之一[30]。本研究首次证实,SETD2缺失可从多个细胞周期检测点水平影响NPC细胞周期的进展。
SETD2除了参与组蛋白修饰,还可修饰其他非组蛋白基因,如曹雪涛课题组新近发现SETD2可调节STAT1甲基化而参与IFNα依赖的抗病毒免疫[31]。由此可见,进一步阐明SETD2对基因表达调控的机制,发现有价值的下游靶基因,对疾病的防治具有重要的意义。
总之,本研究结果提示NPC细胞系中SETD2表达呈普遍降低的趋势,且SETD2基因缺失从多个分子水平上影响了细胞周期的分布,促进了细胞的增殖潜能。基于CRISPR/Cas9系统的基因组编辑对NPC中SETD2基因的定点编辑具有可行性,这为后续深入研究SETD2的功能提供了参考资料。

