金针菇菌丝体的液体发酵工艺研究
严燕兵,肖延铭,华 超,金 力,袁 围
(1.长兴制药股份有限公司 工业生物催化与转化浙江省工程研究中心,浙江 长兴313100;2.浙江工业大学 生物工程学院,浙江 杭州310014)
金针菇菌丝体(Mycelium of Flammulina velutipes)是金菌灵胶囊的主要原料。长兴制药股份有限公司最早开发制成的金菌灵胶囊具有扶正固本和调补气血的功能,主要用于治疗中医气血两虚症和被西医评判为肺癌症的患者。目前,受生产金针菇菌丝体的发酵原料大幅涨价的影响,发酵后的菌粉售价已由2010年的100元/kg上升至2017年的200元/kg。利用现有的发酵工艺,每升培养液获得的金针菇菌丝体干重为16~20g,腺苷质量分数为150~200μg/g,这两项指标均处于较低水平,进一步增加了发酵成本[1]。因此,开展金针菇菌丝体的液体发酵工艺研究,降低发酵成本,提高金针菇菌丝体的发酵产能,已经成为企业的迫切任务。工业化金针菇菌丝体发酵培养时,多采用发酵工业用粗料培养基,尽管采用这种方法可以获得较高的菌丝体得率,但是和水溶性碳源、氮源比较,天然来源的粗料培养基存在水溶性差、成分复杂的弊端[3-4]。针对以上情况,笔者研究了不同的培养环境和培养基组成对金针菇菌丝体生物量的影响,为金针菇液体生产发酵成本的降低和菌丝体菌粉质量稳定性的提升奠定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 菌 种
金针菇菌种:由长兴制药股份有限公司研发中心菌种库保藏。
1.1.2 培养基
斜面培养基(PDA):购于BD公司(美国BD公司,Becton,Dickinson and Company)的PDA 粉末,称取39g溶于1L水中,pH自然。
碳源筛选基础培养基:MgSO4·7H2O 1.5g/L,大豆蛋白胨20g/L,酵母粉5g/L,KH2PO43g/L。
氮源筛选基础培养基:MgSO4·7H2O 1.5g/L,膨化玉米粉20g/L,KH2PO43g/L,蔗糖20g/L。
碳源筛选:蔗糖、葡萄糖、膨化玉米粉和可溶性淀粉。
氮源筛选:低温黄豆粉、中温黄豆粉、高温黄豆粉、大豆蛋白胨、花生饼粉和玉米浆干粉。
1.2 试验方法
1.2.1 斜面菌种制备
将取自金针菇冷冻甘油管的菌种在无菌条件下接种于斜面培养基PDA上,恒温25℃培养7~10d,挑选菌落生长状况良好、无污染的斜面菌种,冷藏保存在4℃冰箱,备用。
1.2.2 最佳碳源、氮源的筛选
在500mL三角瓶中加入碳源10g/L,氮源10g/L和玉米浆干粉10g/L,KH2PO43g/L,MgSO4·7H2O 1.5g/L,加水至100mL,混合充分后,用氨水调节pH值至7.2~7.3,121℃灭菌30min,降温冷却,在无菌条件下将斜面培养基中的菌种用接种铲铲出一块1cm2左右的菌种块,切碎,平均接种于各摇瓶,25℃,150r/min摇床转速培养1周,观测金针菇菌丝生长情况,过滤出菌丝体,烘干测干重,采用液相色谱检测菌丝中腺苷含量。
1.2.3 正交试验
以各单因素试验最佳条件为基础,选择低温黄豆粉、玉米浆干粉、膨化玉米粉和蔗糖4个因素,进行4因素3水平的培养基浓度优化设计。正交试验设计依据L9(34)正交试验表完成,主要参考指标为腺苷质量分数和菌丝体质量浓度,确定金针菇菌丝体发酵最适合的培养基浓度的组合。每组试验重复3次,试验水平和因素如表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal experiment g/L
1.2.4 成品指标
1)性状:呈浅黄色至棕褐色细粉,气微香,味淡。
2)水分指标:减失重量不得超过5.0%。
测定方法:取本品2.0g,精密称定,105℃干燥至恒重。
3)含量指标:本品腺苷质量分数(C10H13N5O4)不小于100μg/g。
测定方法:高效液相色谱法(中国药典2000年版一部附录Ⅵ D)[11]。
1.2.5 200L发酵验证
1)种子摇瓶制备
在1 000mL三角瓶中加入筛选后的碳源和氮源,即膨化玉米粉25g/L,玉米浆干粉10g/L,低温黄豆粉25g/L,蔗糖30g/L,以及 KH2PO43g/L,MgSO4·7H2O 1.5g/L,加水至200mL,混合充分后,用氨水调pH 至7.2~7.3,121℃灭菌30min。降温冷却,在无菌条件下将斜面培养基中的菌种用接种铲铲出一块1cm2左右的菌种块,切碎,平均接种于各摇瓶,25℃,150r/min摇床培养1周,对菌丝生长情况进行观测,挑选长势良好的作为种子摇瓶,备用。
2)发酵验证
在200L发酵罐中加入筛选后的碳源和氮源,即膨化玉米粉25g/L,玉米浆干粉10g/L,低温黄豆粉25g/L和蔗糖30g/L,以及 KH2PO43g/L,MgSO4·7H2O 1.5g/L,加水至120L,混合充分,用氨水调pH值至7.2~7.3,121℃灭菌30min。降温冷却,将种子摇瓶的菌种接种至发酵罐,接种量为15%,转速200r/min,25℃培养,通气量为1.0m3/(m3·min)。每隔12h取样检测还原糖含量和氨态氮含量,还原糖质量浓度小于10g/L时放罐,过滤发酵液,收集菌丝体,烘干,打成粉末,检测金针菇菌丝体质量浓度以及腺苷含量。每组实验重复3次。
2 结果与分析
2.1 不同碳源对发酵的影响
由表2可以看出:4种培养基的碳源不同,实验菌种均能成长,且随着碳源浓度的增加,菌丝体干重明显增加,其中膨化玉米粉为最优,蔗糖次之;腺苷含量也呈现明显增加趋势,其中蔗糖最优,膨化玉米粉次之,可溶性淀粉为30g/L时腺苷含量略有下降。膨化玉米粉中的粗蛋白含量一般在10%左右,总糖含量一般在80%以上,是一种理想的碳源培养基原料。可见,金针菇对不同碳源的利用程度和能力依次为膨化玉米粉>蔗糖>葡萄糖>可溶性淀粉。

表2 不同碳源对发酵效果的影响Table 2 Effects of different carbon sources on fermentation efficiency
2.2 不同氮源对发酵的影响
从表3中可以看出:金针菇菌丝体在选取的几种不同氮源中都能生长,从最终的菌丝体干重和腺苷含量可以看出,种类不同则区别相对比较显著。其中,玉米浆干粉和大豆蛋白胨作为可溶性氮源优于不溶性氮源中的高温黄豆粉和花生饼粉;不溶性氮源中的低温黄豆粉效果最为明显,中温黄豆粉次之;高温黄豆粉在所有选用的氮源中效果最差。金针菇菌丝体对不同氮源的利用能力依次为低温黄豆粉>玉米浆干粉>大豆蛋白胨>中温黄豆粉>花生饼粉>高温黄豆粉。
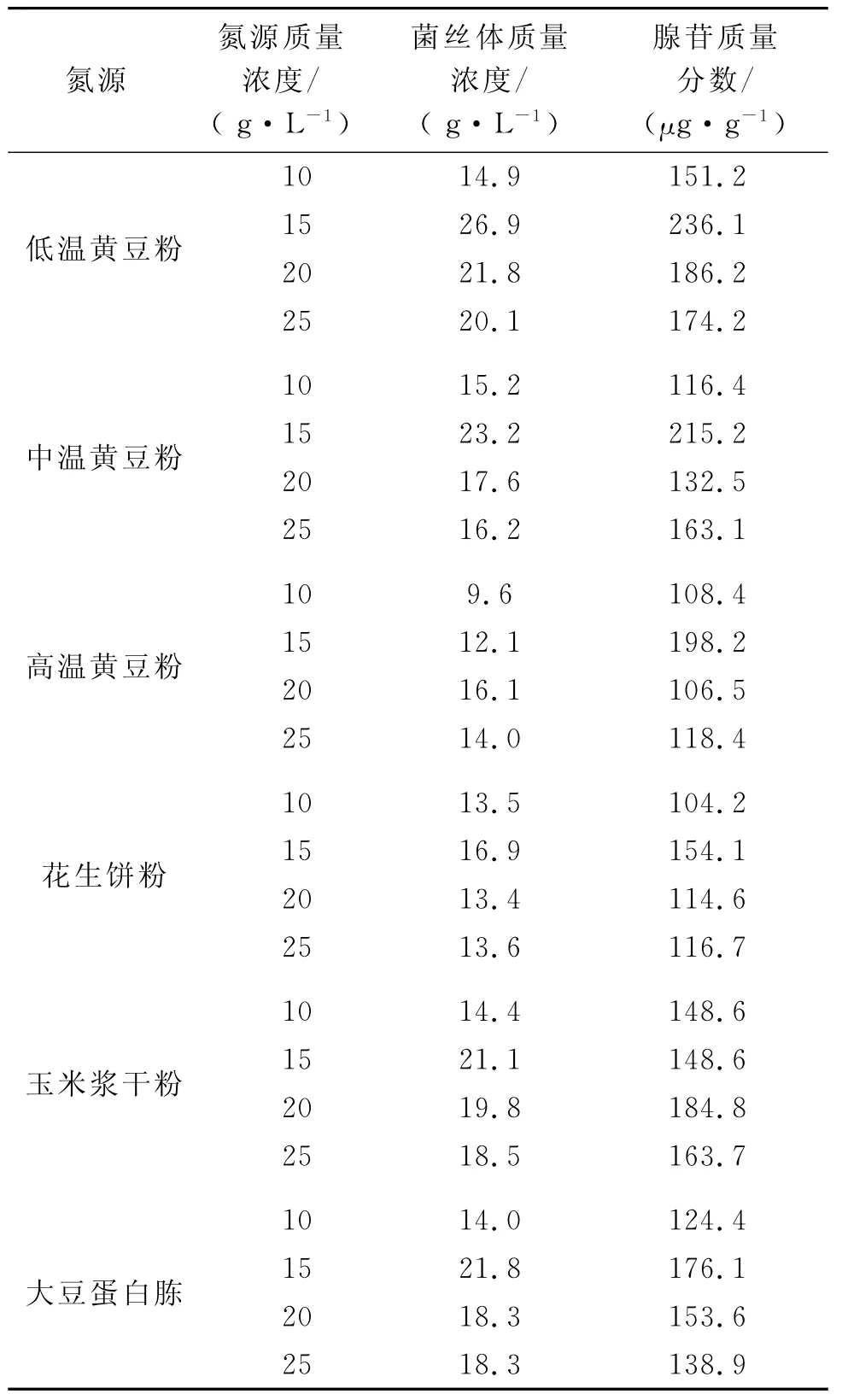
表3 不同氮源对发酵效果的影响Table 3 Effects of different nitrogen sources on fermentation efficiency
2.3 正交试验结果
从表4中可以看出:以腺苷含量为试验指标,培养基中各因素影响的主次顺序为A(低温黄豆粉)>C(玉米浆干粉)>D(膨化玉米粉)>B(蔗糖),最优的培养基组合为A2B2C2D3,即膨化玉米粉25g/L,玉米浆干粉10g/L,蔗糖30g/L,低温黄豆粉20g/L。而根据菌丝体干重指标来看,培养基中各因素的主次顺序为A(低温黄豆粉)>D(膨化玉米粉)>C(玉米浆干粉)>B(蔗糖),最优的培养基组合为A3B2C2D3。即膨化玉米粉25g/L,玉米浆干粉10g/L,低温黄豆粉25g/L,蔗糖30g/L。根据发酵时长和原料成本来看,A(低温黄豆粉)含量高,需要更长的发酵时间和更高的成本,因此选择最优的培养基组合为A2B2C2D3进行后续的200L发酵试验。
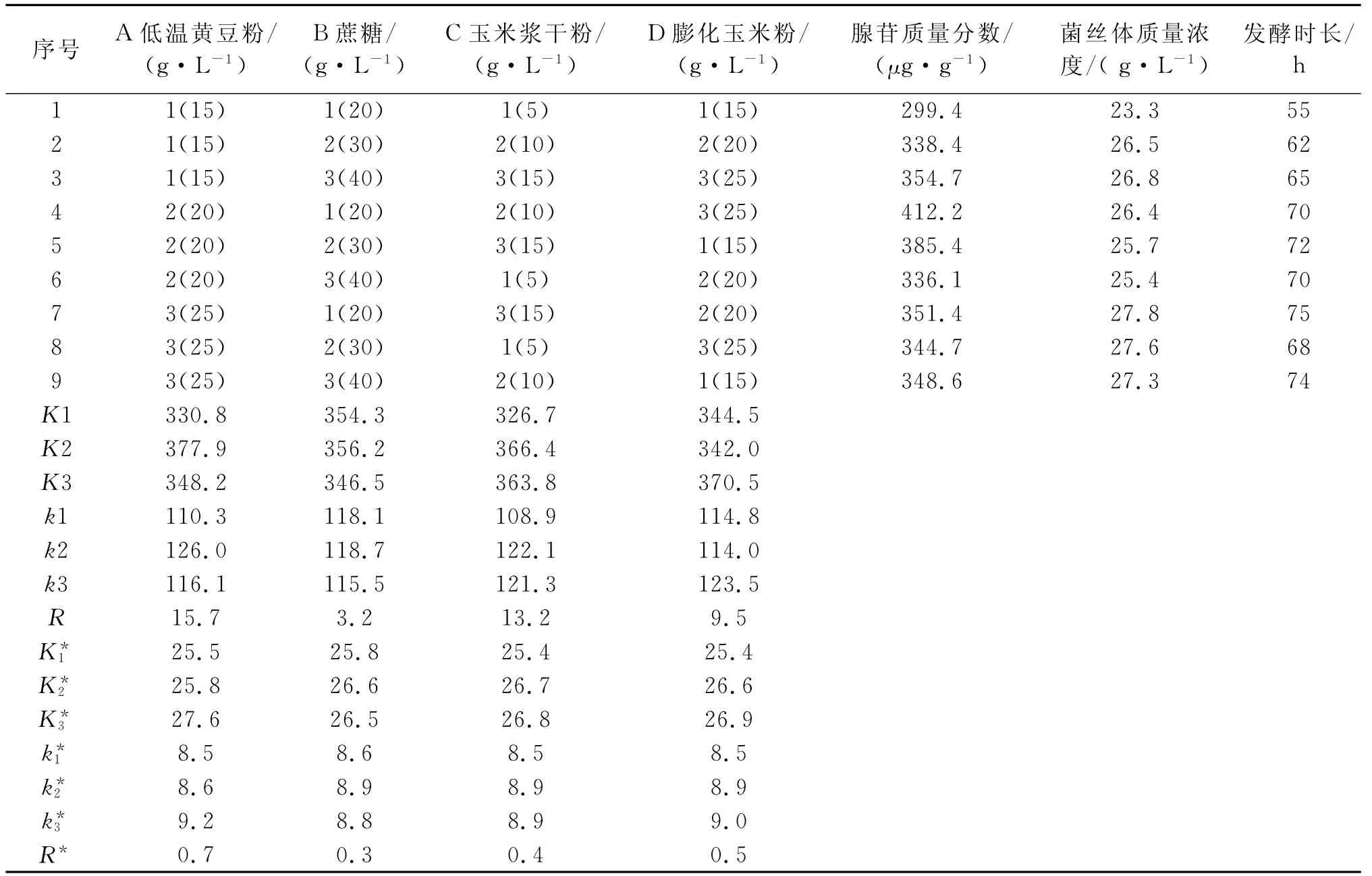
表4 培养基浓度配比的正交试验结果1)Table 4 Orthogonal test results of medium concentration ratio
2.4 发酵结果
200L发酵罐发酵过程中的溶氧和pH变化曲线见图1;氨态氮和菌丝体干重变化曲线见图2;还原糖含量和腺苷含量的变化曲线见图3。

图1 溶氧和pH随时间的变化曲线Fig.1 The curve of dissolvedoxygen and pH

图2 氨态氮和菌丝体质量浓度随时间的变化曲线Fig.2 The curve of time and ammonia nitrogenand dry weight of mycelia

图3 还原糖质量浓度和腺苷质量分数随时间的变化曲线Fig.3 The curve of time and reducing sugar and adenosine content
由图1~3可知:在整个发酵过程中pH和溶氧都呈下降趋势,还原糖质量浓度先上升后下降,这是因为在菌丝体生长前期,快速产生糖化酶,将培养基中的碳源由原来的多糖分解成还原糖单体,但是菌体分解多糖的能力大于消耗碳源的能力,因此前期还原糖含量呈上升趋势,但是随着菌丝体的快速生长繁殖,菌丝体浓度增加,碳源消耗能力迅速增长,因此还原糖含量逐渐下降。在发酵过程中,氨态氮的含量波动范围不大,先下降然后上升,这是由于发酵后期部分菌丝球老化,蛋白质分解自溶释放出氨态氮类物质。菌丝体质量浓度和腺苷质量分数都逐渐上升至一定程度后开始下降。当溶氧下降到一定程度,通过调整搅拌转速和通气量将溶氧维持在一定范围内,当还原糖基本耗完后溶氧开始回升。在全部的过程中,pH持续降低,这是由菌丝体生长产生有机酸类物质所致[6]。发酵后期还原糖耗尽,菌丝体老化并释放氨态氮类物质,pH开始回升。当还原糖低于5g/L时,腺苷质量分数和菌丝体质量浓度都会下降。当还原糖耗尽后并长期缺乏时,菌丝体会将腺苷作为营养物,从而导致腺苷含量大幅下降。因此在发酵过程中可以通过观察溶氧和pH的变化,配合还原糖的检测来决定发酵的终点,当还原糖接近5g/L时即可结束发酵[7]。
选用筛选后的培养基在200L发酵罐重复5次发酵试验,接种量为15%,发酵周期为45~56h。

表5 200L发酵罐发酵效果表Table 5 The fermentation effect of 200Lfermentor
从表5的5组试验可以看出:放罐时的还原糖低于5g/L的第1和2组,其腺苷质量分数明显少于放罐时还原糖高于5g/L的第3~5组。获得的金针菇菌粉质量浓度平均值为24.0g/L,均大于20g/L,符合成品检测标准。菌粉中的腺苷质量分数平均值为394.6μg/g,均大于100μg/g,符合成品检测标准。菌丝体质量浓度和腺苷质量分数分别较原有工艺中的提高了33.0%和97.0%。改进后的发酵工艺效果显著。
3 结 论
金针菇属于木腐生菌,能够供它生长的营养物质种类繁多。现有报道的发酵工艺中菌丝体质量浓度普遍在16~20g/L[4-5],部分质量浓度较高但是没有通过中试以上验证,关于腺苷质量分数的文献报道较少。本研究以菌体质量浓度和腺苷为考察因素,采用单因素和正交试验确定金针菇菌丝生长的最佳培养基组成为低温黄豆粉20g/L,蔗糖30g/L,玉米浆干粉10g/L,膨化玉米粉25g/L,KH2PO43g/L和MgSO4·7H2O 1.5g/L。金针菇菌丝球通过该配方进行培育后直径较大且规整,具有透亮的过滤清液,金针菇香味显著,烘干的菌粉成品中腺苷质量分数和菌丝体质量浓度都符合企业生产要求,且较原有工艺有较大提高,效果显著。

