Fe3O4@SiO2@m-SiO2-NH2磁性纳米材料富集-分光光度法测定不同基质酒中Pb2+
徐小梅, 刘 翻, 万益群*,
(1.南昌大学化学学院,江西南昌 330031;2.南昌大学分析测试中心,江西南昌 330029)
铅是一种毒性较强的重金属,进入人体后将会对人的神经、消化、肾脏、心血管和内分泌等多个系统造成危害,引起头痛、头晕、记忆力下降、睡眠障碍、腹胀便秘等不良症状,重则可以使人致死。饮酒是我国的一种传统民族文化,也是很多人的一种嗜好。由于环境的污染以及在酿酒过程中相关生产原料、设备、用水、贮酒器等均有可能引入重金属Pb2+,使酒的品质受到一定程度的影响,也将直接危害消费者的身体健康。为此,我国制定了各类酒中Pb2+的限量标准[1],其中白酒为0.2 mg/kg,黄酒为0.5 mg/kg。因此,加强酒中Pb2+含量的监测很有必要。
目前,食品中Pb2+的常见检测方法包括原子荧光光谱法[2]、原子吸收光谱法[3]、电化学分析法[4]、电感耦合等离子体发射光谱法[5]、高效液相色谱法[6]等。在这些分析方法中,原子吸收光谱法、电感耦合等离子体发射光谱法等仪器设备相对来讲比较昂贵,且受样品基质干扰较大;相关电化学分析方法重现性较差。因此,探讨构建简便、有效的酒中Pb2+的分析新技术具有较好的实用价值。本研究运用溶剂热法[7 - 9]制备了Fe3O4磁性材料,在此基础上合成氨基功能化磁性纳米材料Fe3O4@SiO2@m-SiO2-NH2[10 - 23]。实验将合成的材料用于不同基质酒中Pb2+的选择性分离富集,并结合紫外-可见分光光度法,建立了酒中Pb2+的分析新方法,并应用于实际样品分析,取得了较好的效果,为酒的品质监测提供了一种新的手段。
1 实验部分
1.1 主要仪器与试剂
UV-2550型紫外-可见分光光度计(日本,岛津公司);pHS-3C型酸度计(上海仪电科学仪器股份有限公司);KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司);电子天平(梅特勒-托利多仪器(上海)有限公司)。
FeC13·6H2O、NaAc、NaOH、氨水、正硅酸乙酯(TEOS)、HCl、HNO3、十六烷基三甲基溴化铵(CTAB)、Y-脲丙基三乙氧基硅烷(A-1160)均为分析纯,购于国药集团化学试剂有限公司;乙二醇、乙醇、异丙醇、二氯甲烷、NH4NO3均为分析纯,购于广东西陇化工股份有限公司;二甲酚橙(XO)、邻菲啰啉均为分析纯,购于美国Sigma-Aldrich公司;Pb(NO3)2(优级纯,华夏试剂有限公司)。实验用水为Mill-Q超纯水仪(美国,Millipore公司)制备。
1.2 实验方法
1.2.1溶液配制0.1 mg/mL Pb2+标准溶液:准确称取0.1599 g Pb(NO3)2于烧杯中,用超纯水溶解,加入1 mL浓HNO3,移入1 000 mL的容量瓶中,用超纯水稀释定容,摇匀。0.1%二甲酚橙(XO)溶液:称取0.05 g XO,用少量超纯水溶解,加入少量HCl,并用超纯水定容于50 mL的容量瓶中,备用。HAc-NaAc缓冲溶液:称取100 g NaAc溶于500 mL水中,加入2.4 mL冰HAc,超纯水60 mL,摇匀,在酸度计上调至溶液pH=6.0。0.25%邻菲啰啉溶液:称取0.25 g邻菲啰啉,溶于7.5 mL的丙酮中,用超纯水稀释至100 mL。
1.2.2Fe3O4@SiO2@m-SiO2-NH2的制备及表征称取1.35 g FeCl3·6H2O,置于250 mL烧杯中,加入75 mL乙二醇,搅拌30 min形成透明溶液。接着加入3.6 g NaAc,继续搅拌至均匀后,并将溶液转移至100 mL 反应釜中,放置于200 ℃烘箱中反应16 h。将制备的材料用超纯水和乙醇反复清洗,在60 ℃下于真空干燥箱中干燥9 h,即得到Fe3O4磁性纳米微粒。称取0.10 g Fe3O4磁性纳米微粒,分散在所配制的混合溶液中(超纯水10 mL、乙醇40 mL、氨水1.2 mL),超声1 h,逐滴加入0.4 mL TEOS,搅拌6 h。然后通过磁分离收集,用乙醇、超纯水清洗多次,60 ℃真空干燥8 h,得Fe3O4@SiO2。
称取0.10 g Fe3O4@SiO2,分散在所配制的混合溶液中(超纯水40 mL、乙醇30 mL、氨水1.2 mL),超声处理,加0.20 g CTAB,超声30 min,逐滴加入0.3 mL TEOS形成均一的溶液,在搅拌下30 ℃反应6 h。将产物分散在6 g/L NH4NO3-乙醇中,在60 ℃条件下分多次进行超声,每次30 min。材料磁分离后,在60 ℃下真空干燥8 h,得Fe3O4@SiO2@m-SiO2。称取0.05 g Fe3O4@SiO2@m-SiO2分散到60 mL异丙醇中,逐滴加入1.0 mL A-1160,N2保护,室温下机械搅拌24 h,反应结束后,所得材料依次用异丙醇和二氯甲烷洗涤数次,将产物在60 ℃下真空干燥12 h,即得Fe3O4@SiO2@m-SiO2-NH2。
1.2.3样品前处理准确移取15.0 mL酒样至50 mL离心管中,加入5 mg Fe3O4@SiO2@m-SiO2-NH2磁性纳米材料,在迷你振荡器上震荡30 min,静置2 min,然后用磁铁将磁性纳米材料与溶液分离。接着用5 mL 0.1 mol/L HCl对磁性纳米材料进行洗脱,洗脱液进行紫外-可见光谱测定。
1.2.4紫外-可见光谱测定在25 mL容量瓶中,依次加入0.25 mL Pb2+标准溶液,5 mL HAc-NaAc缓冲溶液(pH=6.0),1.0 mL 0.1% XO 溶液,用超纯水稀释至刻度。用2 cm比色皿,在535 nm波长处,以相应试剂空白作为参比测量吸光度[24]。
2 结果与讨论
2.1 分光光度法测定条件的优化
2.1.1最佳测定波长选择在25 mL容量瓶中,依次加入0.50 mL Pb2+标准溶液,5 mL HAc-NaAc缓冲溶液(pH=6.0),1.0 mL 0.1% XO 溶液,超纯水稀释至刻度。用2 cm比色皿以试剂空白为参比,测量该显色体系吸光度,并绘制吸收曲线,见图1。从图1可看出当波长为535 nm时,该体系有最大吸收。
2.1.2显色条件的优化在λ=535 nm,固定Pb2+的浓度为0.3 mg/L,分别探讨显色体系pH(5~7),显色剂用量(0.5~2 mL)、显色时间(5~30 min)等因素对显色体系的影响。结果表明,当显色体系的pH=6.0,显色剂用量为1.0 mL、显色时间20 min,可以取得较好的效果。
2.2 工作曲线与检出限
配制Pb2+标准系列工作溶液,按照优化条件进行测定,结果表明,Pb2+的浓度在0.05~3.6 mg/L范围内遵循比尔定律,呈良好的线性关系,线性回归方程为:A=0.0989c+0.00965,相关系数为0.9976,检出限(S/N=3)为0.025 mg/L。
2.3 磁性纳米材料的表征
2.3.1X-射线衍射分析图2为所制备的磁性纳米粒子Fe3O4的X-射线衍射(XRD)图。从图中可以看出,在2θ=30.10°、35.5°、43.09°、53.4°、56.95°、62.83°处出现明显的衍射峰,与JCPDS卡片72-23034比较可知,这些峰与Fe3O4的X-射线衍射图中(220)、(311)、(400)、(422)、(440)、(511)标出峰的位置一致,说明产物为立方尖晶石结构的Fe3O4。

图1 紫外-可见(UV-Vis)吸收光谱图Fig.1 UV-Vis absorption spectruma.absorption spectrum of the complex Pb2+-XO for XO;b.absorption spectrum of the complex Pb2+-XO for water.
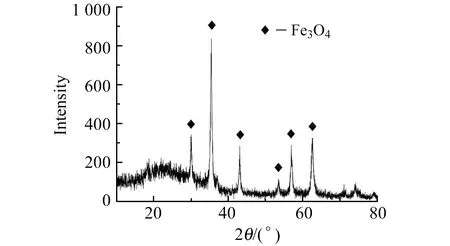
图2 Fe3O4的X-射线衍射(XRD)分析Fig.2 XRD analysis of Fe3O4

图3 Fe3O4(a)、Fe3O4@SiO2(b)、修饰CTAB模板(c)、Fe3O4@SiO2@m-SiO2(d)和Fe3O4@SiO2@m-SiO2-NH2(e)的红外(IR)光谱图Fig.3 IR spectra of Fe3O4(a),Fe3O4@SiO2(b),modified CTAB template(c),Fe3O4@SiO2@m-SiO2(d)and Fe3O4@SiO2@m-SiO2-NH2(e)
2.3.2红外光谱分析图3为所制备的各种材料的红外光谱图。图3a表明,582 cm-1为Fe3O4的Fe-O特征吸收峰;800 cm-1和1 080 cm-1分别为Si-O-Si的对称振动和不对称伸缩振动吸收峰(图3b),表明Fe3O4@SiO2形成;CTAB模板的-CH2在2 800~3 000 cm-1范围内的吸收峰可以确定(图3c),但图3d表明此范围的吸收峰消失,表明CTAB模板已成功洗脱掉,形成了介孔结构;960 cm-1处为Si-OH的吸收峰,图3e表明,当氨基硅烷基团取代硅羟基时,此峰变弱,1 635 cm-1、1 560 cm-1分别为吸附水的O-H和自由的N-H或者质子化的氨基吸收峰,表明氨基成功地修饰在磁性介孔材料上。
2.3.3扫描电镜和透射电镜表征图4为所制备材料的扫描电镜(SEM)和透射电镜(TEM)图。由图4a可见,Fe3O4@SiO2@m-SiO2-NH2为球形的纳米颗粒;由图4b可见,Fe3O4外面明显包裹SiO2层;图4c可见,在SiO2层外面包裹了介孔SiO2层,且SiO2层厚度约45 nm,介孔SiO2层厚度约135 nm,修饰-NH2后厚度并无明显变化。由上述对材料的各种表征结果可知,本实验已成功制备了Fe3O4@SiO2@m-SiO2-NH2磁性纳米材料。

图4 Fe3O4@SiO2@m-SiO2-NH2(a)的扫描电镜(SEM)图和Fe3O4(b)、Fe3O4@SiO2(c)、Fe3O4@SiO2@m-SiO2-NH2(d)的透射电镜(TEM)图Fig.4 SEM images of Fe3O4@SiO2@m-SiO2-NH2(a)and TEM images of Fe3O4(b),Fe3O4@SiO2(c),Fe3O4@SiO2@m-SiO2-NH2(d)
2.4 Fe3O4@SiO2@m-SiO2-NH2富集Pb2+条件优化
2.4.1Fe3O4@SiO2@m-SiO2-NH2用量的选择取15 mL Pb2+溶液,固定Pb2+的浓度为0.3 mg/L,改变Fe3O4@SiO2@m-SiO2-NH2的用量,探讨该材料对Pb2+的富集效果,结果见图5。由图5可知,当所制备磁性纳米材料的用量为5.0 mg以上时,Pb2+能完全被富集。实验选择其用量为5.0 mg。
2.4.2pH的影响改变溶液 pH值,用5.0 mg Fe3O4@SiO2@m-SiO2-NH2对溶液中Pb2+进行富集,结果见图6。当pH在5~7范围时磁性纳米材料对Pb2+的富集效果较好,本实验选择pH为6.0。
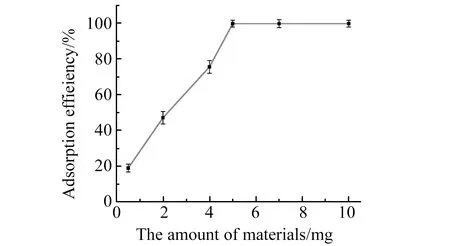
图5 Fe3O4@SiO2@m-SiO2-NH2的用量对Pb2+的富集效率影响Fig.5 Effect of the amount of Fe3O4@SiO2@m-SiO2-NH2 on the enrichment efficiency of Pb2+

图6 pH对Pb2+的富集效率影响Fig.6 Effect of pH on the enrichment efficiency of Pb2+
2.4.3最佳洗脱条件的选择分别采用0.1 mol/L HCl、HNO3对富集了Pb2+的磁性纳米材料进行洗脱。结果表明,HCl的洗脱效果较好。改变HCl的用量,探讨Pb2+的洗脱效果。结果表明,当HCl的用量大于5.0 mL时,Pb2+能较好地从富集的材料上洗脱下来,洗脱效率超过96.0%。实验选择HCl用量为5.0 mL。
2.5 共存离子影响
实验探讨了酒中一些共存物对Pb2+测量的影响。当Pb2+的浓度为0.3 mg/L时,其他一些共存组分浓度(mg/L)为:Na+(2.0)、K+(2.0)、Ca2+(0.3)、Mg2+(0.1)、Zn2+(0.15)、Fe3+(0.2)、Cd2+(0.1)、Co2+(0.1)、Cr3+(0.3)、Mn2+(0.2)、Cu2+(0.2)时对测定的影响。结果表明所制备的磁性纳米材料对Cu2+、Cd2+有一定的吸附,对Pb2+的分析会产生一定影响。实验采用加入0.25%邻菲啰啉溶液1.25 mL,可将Cu2+、Cd2+完全掩蔽,能消除对Pb2+分析的影响。
2.6 样品分析
分别移取红酒、白酒、黄酒等不同基质酒样各15.0 mL至50 mL离心管中,加入1.25 mL 0.25%邻菲啰啉溶液,按所建立分析方法进行测定,结果见表1。由表1可知,采用本方法测定Pb2+的结果与原子吸收光谱法(AAS)分析结果相近,表明本方法具有较好的准确性。

表1 酒样中Pb2+的分析结果
3 结论
本文采用溶剂热法,以TEOS为硅源,CTAB为模板,A-1160为氨基化试剂,制备了磁性纳米材料Fe3O4@SiO2@m-SiO2-NH2,运用该材料对酒样中Pb2+进行分离富集,结果表明所制备的材料能选择性地富集Pb2+,结合分光光度法,建立了酒中Pb2+的分析方法。方法具有检测成本较低、操作简便的优点,能较好的满足不同基质酒样中Pb2+含量的监测。

