抗猪流行性腹泻病毒噬菌体单链抗体库的构建及筛选
孙 举,高倩文,曲雪婷,仝 舟,毕玉海,尹燕博*
(1.青岛农业大学动物医学院,山东青岛 266109;2.中国科学院微生物研究所,北京 100000)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种肠道传染病,该病通常多发于寒冷的冬春季节,临床症状主要表现为腹泻、呕吐、消瘦、脱水,最终导致死亡[1-3]。尽管疫苗的应用对该病的控制起到了一定的作用,但该疫病在部分地区仍有不同程度的发生和流行[4-6]。
通过噬菌体展示系统获得的单链抗体具有免疫原性低、组织穿透力强、易到达靶细胞以及在体内循环的半衰期短、易解毒排出等优点,使其在科研、诊断及治疗方面应用广泛。该技术与传统的杂交瘤制备单克隆抗体技术相比,其抗体的产量低,加之无法制备腹水,限制了其应用[7]。噬菌体抗体技术的出现,结合一些新的表达载体的应用,使猪源单克隆抗体以及抗体片段的制备变得更加便捷和有效[8-9]。本研究构建了抗猪流行性腹泻病毒的噬菌体单链抗体库,经过3轮“吸附-洗脱-富集”噬菌体抗体库的选淘,得到抗猪流行性腹泻病毒的单链抗体,可为猪流行性腹泻的防治提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂 XLI-Blue感受态细胞购自康为世纪公司;pComb3XSS载体由中国科学院微生物所惠赠;限制性内切酶SfiI购自美国NEB公司;T4DNA连接酶、Trizol、PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit、DNA maker DL2000购自Takara公司;M13K07购自Invitrogen公司;猪外周血淋巴细胞分离试剂盒购自北京索莱宝公司。
1.1.2 引物设计 根据GenBank中登录的猪IgG重链(heavy chain,VH)(AK405798)和轻链Kappa链(EU683881)、轻链lamda链(AF345512)基因序列,参考文献设计可变区的特异性引物[10],其中重链上游和轻链下游引入Linker接头(斜体部分),重链下游和轻链上游引入SfiⅠ的酶切位点(下划线部分),序列及扩增片段见表1,引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 动物的免疫及外周血淋巴细胞的提取 初次免疫以1 mL猪流行性腹泻疫苗经皮下注射免疫发病耐过猪,每次免疫间隔14 d,第3次免疫后14 d采集猪外周血液。取新鲜血液10 mL与全血及组织稀释液1∶1~1∶2混匀,用猪外周血淋巴细胞分离试剂盒提取猪的外周血淋巴细胞。
1.2.2 外周血淋巴细胞总RNA的提取 Trizol试剂提取细胞总RNA,经Thermo Scientific NaNODROP2000分光光度计测定其浓度及OD260/OD280值,并计算二者比值,分析其纯度。
1.2.3 VH和VL基因的扩增 采用RT-PCR法。以提取的总RNA为模板,反转录合成cDNA,以其为模板,PCR扩增出VH和VL基因。反应条件为:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 40 s,共35个循环; 72℃再延伸 10 min。PCR产物经10 g/L琼脂糖凝胶电泳鉴定后,回收VH和VL片段。
1.2.4 SOE-PCR合成scFv基因 通过SOE-PCR方法将重链可变区基因VH和轻链可变区基因VL组装成scFv基因,形成VL-linker-VH。将得到的VH和VL的PCR产物等量的加入到体系中进行连接,反应条件为:第一步为95℃ 5 min; 95℃ 30 s,58℃ 30 s,72℃ 40 s,共15个循环(不加引物);第二步95℃ 5 min; 95℃ 30 s,58℃ 30 s,72℃ 40 s,共20个循环(加引物);72℃再延伸10 min。

表1 重链及轻链目的片段扩增引物
1.2.5 scFv片段与pComb3XSS载体的连接 将PCR产物进行胶回收纯化,用Sif I 分别对scFv片段和pComb3XSS载体进行双酶切,胶回收纯化。将scFv酶切片段与pComb3XSS酶切片段进行连接,反应体体系为:insert DNA片段5.5 μL,10×buffer 1 μL,pComb3XSS 2.5 μL,0.4 U/μL T4 DNA ligase 1 μL,共10 μL,混匀后于16℃条件下连接16 h。
1.2.6 构建scFv噬菌体抗体文库 将200 μL的连接产物分10次与80 μL电转感受态细胞在2.5 kV、800 Ω的条件下进行电击转化,每次电击后加入1 mL的SOC培养基重悬,并转移到50 mL离心管中,37℃、220 r/min振荡培养1 h,用100 μL菌液涂在含有Amp+(100 μg/mL)的平板,检测抗体库重组率,菌液加入氨苄和葡萄糖,待菌液OD600=0.5时,加入辅助噬菌体M13K07,37℃感染30 min后,继续摇菌1 h,去除培养基,等体积换成含有终浓度Amp+(100 μg/mL)、Kana(50 μg/mL)和IPTG(0.1 mmol/mL)的培养基,摇菌6 h。离心收集上清,1∶5加入PEG8000,4℃过夜。48 h后离心,用PBS重悬,得到噬菌体单链抗体初级库,用于噬菌体单链抗体库的富集筛选。
1.2.7 噬菌体抗体展示文库的鉴定 构建的噬菌体单链抗体文库分别用VH引物、VL引物和载体通用引物进行扩增鉴定,扩增条件为:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 40 s,共35个循环;72℃再延伸 10 min。
1.2.8 噬菌体抗体展示文库滴度的测定 取1 μL的单链噬菌体抗体初级库,加入到999 μL的PBS中,混匀。从中取出10 μL加入到990 μL的PBS中进行10倍比稀释,稀释4~5个梯度。从每个稀释度的液体中取出20 μL加入到180 μL OD600=0.5的菌液中感染15 min后,各取出20 μL涂布在含有Amp+(100 μg/mL)的平板上,计算噬菌体单链抗体文库滴度。
1.2.9 噬菌体抗体展示文库的筛选 用96孔微孔板法,抗原抗体结合筛选抗体库,用0.1 mol/L的NaHCO3(pH9.6)稀释抗原,浓度为100 μg/μL,100 μL/孔,至于4℃过夜,每孔加入100 μL封闭液放置37℃ 2 h,加入原始文库的噬菌体100 μL/mL,吸附1 h,用PBST洗3~4遍,最后用Elution buffer洗脱,取20 μL测滴度,其余液体感染XLI-Blue感受态,扩增噬菌体单链抗体文库,进行下一轮的选淘。第2、3轮噬菌体选淘,方法同上。
1.2.10 噬菌体抗体的鉴定 采用ELISA检测抗体的结合活性。将筛选出来的噬菌体单链抗体文库加入到已包被抗原的96孔酶标板中,以HRP标记的抗M13的抗体为酶标二抗,M13K07为阴性对照,PBS为空白对照,酶标仪检测OD450值。将阳性噬菌体单链抗体扩增后测序。
2 结果
2.1 重链及轻链可变区基因扩增产物的鉴定
扩增的VH和VL基因经浓度为10 g/L琼脂糖凝胶电泳分析,分别可见400 bp和350 bp的特异性片段,大小均与目的片段相符(图1)。测序结果经NCBI和IMGT网站Blast比对,扩增的片段与猪IgG重链和轻链序列同源性为100%,证明所扩增的片段正确。
2.2 体外重组PCR构建猪的scFv基因
将重链可变区VH与轻链可变区VL借助linker接头连接,在体外形成VL-linker-VH的形式,构建的目的条带为780 bp,在电泳图中的条带与目的条带相符(图2)。
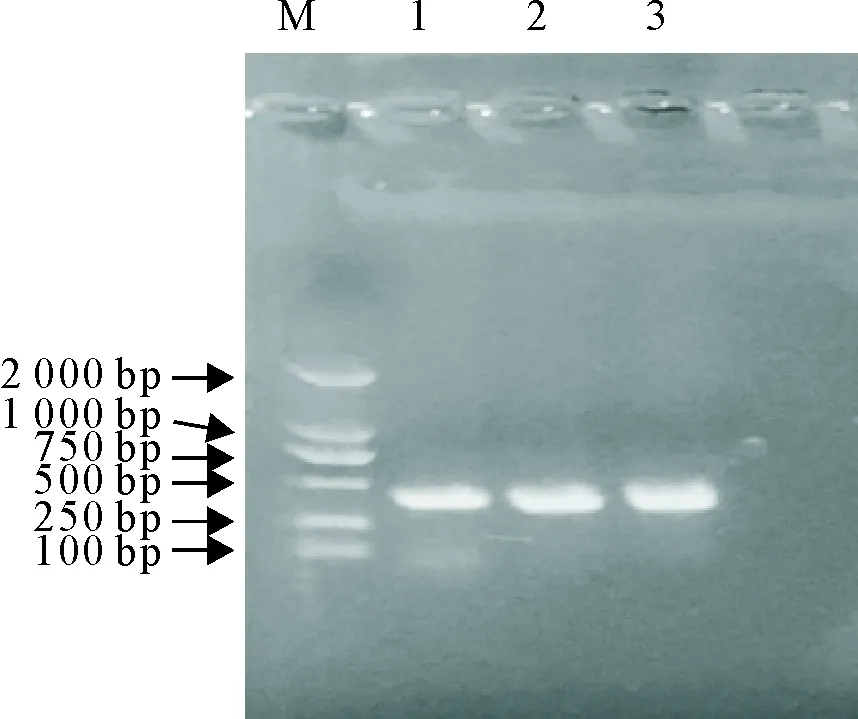
M.DNA标准 DL 2 000;1.VH PCR产物;2.VL(Kappa链)PCR产物;3.VL(Lamda链)PCR产物
M.DNA Marker DL 2 000;1.PCR products of VH;2.PCR products of VL(Kappa链);3.PCR products of VL(Lamda链)
图1 VH和VL基因PCR扩增产物
Fig.1 PCR products of VH and VL genes

M.DNA标准DL 2 000;1.VL(Kappa链)-linker-VH PCR产物;2.VL(Lamda链)-linker-VH PCR产物
M.DNA Marker DL 2 000;1.PCR products of VL(Kappa)-linker-VH;3.PCR products of VL(Lamda)-linker-VH
图2 scFv基因PCR扩增产物
Fig.2 PCR products of scFv gene
2.3 噬菌体抗体展示文库的鉴定
构建的文库经PCR分析,VH、VL和通用引物均被特异性扩增。表明目的基因已连接在噬菌体载体上,条带分别为VH400 bp,VL350 bp,scFv780 bp(图3)。经测定后,所构建的原始文库滴度为9.5×109pfu/mL。对随机挑选的100个噬菌体菌落进行PCR鉴定,重组率为90%。
2.4 scFv文库的富集淘选
用96孔微孔板法抗原抗体结合筛选抗体库。对噬菌体库进行了3轮“吸附-洗脱-富集”,并对每一轮的输入和输出噬菌体进行滴度测定,经过淘选,抗体库的滴度比原始文库高了80倍(表2),有效富集了特异性较好的噬菌体,为下一步构建完整抗体提供了参考。

M.DNA 标准 DL 2 000;1,VH PCR产物;2.VL(Kappa链) PCR产物;3.VL(Lamda链) PCR产物;4.VL(Kappa链)-linker-VH PCR产物;5.VL(Lamda链)-linker-VH的PCR产物
M.DNA Marker DL 2 000;1.PCR products of VH 2.PCR products of VL(Kappa) 3.PCR products of VL(Lamda) 4.PCR products of VL(Kappa)-linker-VH 5.PCR products of VL(Lamda)-linker-VH

图3 噬菌体展示抗体文库PCR鉴定
2.5 噬菌体抗体的鉴定
用ELISA方法,将筛选出来的噬菌体抗体加入到重组蛋白猪流行性腹泻S蛋白包被的96孔酶标板中,用HRP标记的抗M13的抗体为酶标二抗,M13K07为阴性对照,用酶标仪检测OD450nm值。发现一株和猪流行性腹泻S蛋白亲和活性较好的噬菌体,其OD450nm值为0.762(图4),测序结果显示该单链抗体轻、重链分别为VK1和VH1族,且序列顺序为VL-linker-VH,与我们构建的单链抗体顺序相同。

图4 噬菌体抗体结合活性
3 讨论
噬菌体抗体展示技术为基因工程抗体的高效筛选和定向改造提供了更高效的途径。首先,随着动物免疫技术的发展空间将会变得越来越狭小,用体外方法筛选抗体将会越来越受到关注。噬菌体展示技术可以实现抗体的靶动物源化,减少抗体在使用过程中的抗抗体现象。其次,在养猪业,现有的猪流行性腹泻疫苗无法全部防控该病的暴发,给养猪业带来了巨大的经济损失,所以研发抗猪流行性腹泻病毒的单克隆抗体以及抗体类药物治疗该病,是一种必然趋势。
噬菌体展示技术在筛选抗体方面与传统的单克隆抗体制备有所差异,该技术通过在噬菌体表面展示,与靶抗原结合,通过简单易行的96孔微孔板法,用抗原抗体结合,“吸附-洗脱-富集”大大缩减了筛选时间及步骤。
目前,猪源噬菌体抗体展示平台较少,抗体分子量偏大,与抗原结合区域容易被封闭,且单链抗体的折叠能力有限,并且传统单抗基本为鼠源抗体,在使用过程中容易产生抗抗体,影响其治疗效果。本研究通过在猪抗体序列上设计特异性引物,扩增出重链可变区和轻链可变区,构建出猪源抗猪流行性腹泻病毒的scFv噬菌体抗体库,并且在轻链的Kappa和Lamda链上分别设计引物,满足抗体库的多样性,所构建猪源噬菌体文库量为9.5×109pfu/mL。理论上,若噬菌体文库的原始库量较小,会造成重链与轻链的自然配对减少或丢失,会出现低亲和力的配组。本试验用XlI-Blue电转感受态,较以往通过化学转化建立噬菌体文库提高了转化效率,并通过多次电转累积噬菌体库量。在噬菌体筛选过程中,通过3轮的“吸附-洗脱-富集”的筛选,由于猪源抗体数量较多,特异性抗体所占比例不高,通过富集,最后的抗体库滴度是原始抗体库滴度的80倍,有利于富集特异性好的噬菌体单链抗体。但是其中有大量的抗体链丢失,最后导致结果只有少量的完整的VL-linker-VH,且与猪流行性腹泻病毒亲和性较高的只有一条噬菌体抗体链,这可能与ELISA抗原的包被量有关,我们调整抗原包被量以及优化ELISA条件后,ELISA显示的OD值有所上升,阳性克隆数量增加,这与其他研究的结论相一致[11]。所以我们将会按照不同的连接方法构建不同的抗体库,来比较两者的区别。我们用噬菌体展示技术筛选出噬菌体单链抗体,即使单链抗体有分子质量小、组织穿透力强等优点,但其半衰期较短,抗体效价消失较快,不利于抗体在动物体内发挥其治疗作用。故本试验在制备噬菌体单链抗体的基础上,通过噬菌体展示的方法缩短抗体筛选的时间,筛选得到抗猪流行腹泻病毒抗体重链及轻链可变区序列,通过设计引物,将重链可变区与重链恒定区的CH1、CH2和CH3部分通过搭桥PCR的方法连接,同理将轻链可变区与轻链恒定区CL接连,得到完整的抗猪流行性腹泻病毒完整的IgG抗体序列,为下一步构建完整的单克隆抗体做准备。本试验既可以得到抗猪流行性腹泻病毒的单链抗体作为药物治疗,又可以在构建单链抗体库的基础上获得抗猪流行性腹泻病毒的完整的IgG,可为猪流行性腹泻的防治提供参考。

