纳豆菌发酵扇贝裙边制备ACE抑制肽的工艺优化
高洁,高翔,于佳,魏玉西,焦奎,张雪梅,王金梅,李钰金
(1.青岛大学生命科学学院,山东青岛 266071)
(2.荣成泰祥食品股份有限公司,山东省冷冻调理食品加工技术企业重点实验室,山东荣成 264309)
高血压疾病是严重危害人类健康的慢性病之一,也是世界范围内的常见病,其危害仅次于肿瘤,被认定为“生命第一杀手”[1,2]。据资料统计显示,世界各国高血压平均发病率为10%~20%,全球每年因高血压死亡的人数达1200万[3],在我国高血压患者已超过1.6亿人[4]。
目前,化学合成的降血压药物如赖诺普利、卡托普利等虽然对治疗高血压具有一定的疗效,但往往会引起咳嗽、味觉失调、皮疹、头痛等副作用[5~7]。因而寻找一种安全、无副作用的食物源 ACE抑制肽替代传统的降压药物变得十分迫切。
扇贝属软体动物门、瓣腮纲、珍珠贝目(Pterioida)、扇贝科(Pectinidae),被誉为海产八珍之一,是国际上公认的高档水产品[8,9]。近几十年来,我国扇贝养殖业发展迅速,主要养殖品种为栉空扇贝、海湾扇贝和虾夷扇贝,在规模和产量上均居世界第一位,而扇贝加工过程中产生的下脚料亦因量大、营养价值高等原因引起了人们的广泛关注[10]。但由于技术水平的限制,导致大量扇贝裙边未得到合理有效的利用[11,12]。因此,探讨其高值化利用方法与途径势在必行。
纳豆菌(Bacillus natto)是从传统发酵食品纳豆上发现并分离纯化出来的一种益生菌,属细菌科、芽孢杆菌属,是枯草芽孢杆菌的亚种[13,14]。枯草芽孢菌属的重要特点是能够分泌各种胞外酶,包括蛋白酶、淀粉酶、纤维素酶、脂肪酶和植酸酶,而纳豆菌分泌的酶活性比其它枯草芽孢杆菌分泌酶活性高几十倍[15,16]。因此,本文将利用纳豆菌能够产生多种蛋白酶的特性,发酵扇贝裙边蛋白制备 ACE抑制肽。在前期工作中,已经从七种市售纳豆产品中分离保藏了一株蛋白酶活性较高的菌株,为本次发酵扇贝裙边制备ACE抑制肽的工艺探究奠定了基础。
1 材料与方法
1.1 材料与试剂
纳豆芽孢杆菌(实验室分离保藏菌种,菌株保藏号为M 2018081);扇贝裙边:栉孔扇贝(Chlamys farreri),于2017年11月购自青岛市沙子口农贸市场,取出贝柱和扇贝壳,余者即为扇贝裙边;蛋白胨、牛肉膏、琼脂、葡萄糖、碳酸钠、三氯乙酸、磷酸二氢钠、磷酸氢二钠、酪蛋白、酪氨酸、盐酸、硼酸盐、氯化钠 、硼酸、乙酸乙酯、硫酸铜、酒石酸钾钠、氢氧化钠、碘化钾等(均为分析纯,购于国药集团化学试剂有限公司);马尿酸-组氨酰-亮氨酸(Hip-His-Leu,HHL)、血管紧张素转化酶(ACE)、四肽标准品(Gly-Gly-Tyr-Arg),(美国 Sigma公司)。
1.2 主要方法
1.2.1 扇贝裙边预处理
将新鲜栉孔扇贝裙边清洗干净、切碎后置于50 ℃烘箱中干燥,于粉碎机中粉碎后过100目筛即得扇贝裙边粉;再将扇贝裙边粉:95%乙醇按照1:10的比例[W(g)/V(mL)]在60 ℃条件下脱脂处理1 h[17],晾干,所得脱脂扇贝裙边粉于-20 ℃贮存备用。
1.2.2 种子菌悬液的制备
参照文献[19]进行。保存的纳豆菌经活化后,从斜面上挑1~2环纳豆菌接到LB液体培养基中,于37 ℃恒温摇床180 r/min培养24 h,制得种子菌悬液。
1.2.3 纳豆菌生长曲线的制备
参照文献[20,21]进行,将斜面上的纳豆菌接入 LB液体培养基中,于37 ℃、180 r/min恒温摇床培养,以未接种培养基作对照,每3 h取一次样于600 nm测定吸光值(OD),每个样品重复测定三次,结果取其平均值,绘制纳豆菌生长曲线,找出对数生长期。
1.2.4 ACE抑制肽的制备工艺
准确称取脱脂扇贝裙边粉2.0 g,加入一定体积蒸馏水,121 ℃灭菌20 min,接种活化后的纳豆菌进行液体摇瓶发酵,发酵结束后10000 r/min离心10 min,取上清液分别测多肽含量和 ACE抑制率,每组做三个平行,结果取平均值。
1.2.5 单因素和响应面试验
分别以不同的发酵温度(X1)、发酵时间(X2)、接种量(X3)、液料比(X4)为单因素,其中发酵温度设置33、37、41、45、49 ℃五个水平,发酵时间设置24、32、40、48、56 h五个水平,接种量设置1%、3%、5%、7%、9%五个水平,液料比设置10、15、20、25、30五个水平,改变其中一个因素,其他因素保持不变,考察各因素对发酵液多肽含量(Y1)和ACE抑制率(Y2)的影响,并以此为指标确定影响因素以及其水平的取值范围。然后采用Box-Behnken响应面分析法设计4因素3水平试验,并建立二次多项数学模型得出最优发酵条件。
1.3 测定指标
1.3.1 多肽含量的测定
参照文献[22,23]进行。以Gly-Gly-Tyr-Arg标准溶液浓度为横坐标,OD540值为纵坐标,制作多肽含量标准曲线。取2 mL发酵液,加入2 mL 10% TCA溶液,于旋涡混合器上混合均匀,静置5 min,然后在3500 r/min下离心15 min,取上清液全部转移至5.0 mL容量瓶中,并用5% TCA定容至刻度,摇匀,然后取3.0 mL上述溶液置于另一管中,加入双缩脲试剂2.0 mL,于旋涡混合仪上混合均匀,静置5 min,2000 r/min离心10 min,取上清液于540 nm处测定吸光值OD540,对照标准曲线求得样品溶液中的多肽浓度c(mg/mL)。空白对照管加3 mL蒸馏水和2 mL双缩脲试剂,于旋涡混合器上混合均匀,静置4 min,2000 r/min离心10 min,取上清液于540 nm测定吸光值OD540(对照)。
1.3.2 多肽含量标准曲线
多肽含量标准曲线如图1所示:回归方程为y =0.1563x - 0.0022,R2= 0.9994。

图1 多肽含量标准曲线Fig.1 Standard curve of peptide content
1.3.3 ACE抑制率的测定
ACE抑制率的测定参考文献[24]进行。取100 μL 5.0 mmol/L HHL溶液和40 μL离心后的发酵物上清液混合,于37℃水浴中保温10 min,加入0.1 U/mL ACE 20 μL,混匀后于37 ℃恒温水浴中反应35 min。从水浴锅中取出,向反应体系中加入200 μL 1 mol/L HCl终止反应,再加入1.2 mL冷冻乙酸乙酯提取产生的马尿酸,旋涡震荡混匀后,以3500 r/min离心5 min,吸取1.0 mL的乙酸乙酯层,在90 ℃烘箱中经1 h烘干、冷却后加入4 mL蒸馏水充分溶解,漩涡混合后于228 nm处测吸光值OD228。平行对照管除在反应前先加入200 μL 1 mol/L HCl以终止反应外,其余操作步骤均同反应管,重复测定3次结果取平均值,根据下列公式计算发酵液ACE抑制率。
发酵液ACE抑制率(%)=(Ab-Aa)/(Ab-Ac)
注:Aa-发酵液和ACE酶同时与HHL反应的吸光值,Ab-不含发酵液时,ACE酶和HHL反应的吸光度值,Ac-发酵液和ACE酶都不存在时的吸光度值。
1.4 数据分析
采用Microsoft Office Excel 2016和Design Expert 8.0.6进行绘图并作方差与显著性分析,p<0.05认为有统计学意义。
2 结果与分析
2.1 纳豆菌生长曲线
纳豆菌生长曲线见图2。由图2可知,纳豆菌生长曲线大致可以分为4个阶段:纳豆菌在1~3 h,处于生长平缓期;3~12 h,处于对数生长期;在12~18 h,处于生长稳定期;21 h后进入生长衰亡期。根据益生菌一般发酵培养规律,细菌在对数生长期生长平衡,菌体内酶系活跃,代谢旺盛,群体的形态与生理特征最一致,且抗不良环境能力强。因此,在后续实验中均以培养9 h的纳豆菌作为发酵扇贝裙边制备ACE抑制肽的种子液。
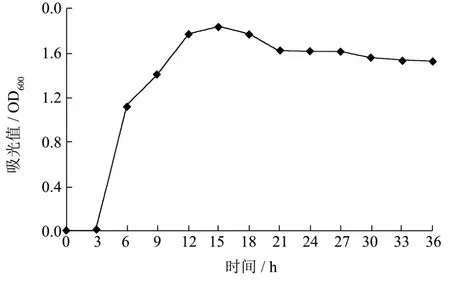
图2 纳豆菌的生长曲线Fig.2 The growth curve of Bacillus natto
2.2 单因素试验结果及分析
2.2.1 发酵温度对多肽含量和 ACE抑制率的影响

图3 发酵温度对多肽含量和ACE抑制率的影响Fig.3 Effect of fermentation temperature on peptide content and ACE inhibition rate
不同的发酵温度对多肽含量和 ACE抑制率的影响见图3。由图3可知:不同的发酵温度对扇贝裙边发酵液中多肽含量和 ACE抑制率有一定的影响。当温度较低时,纳豆菌生长不佳,代谢能力差,产酶量也较少,而温度较高时,导致纳豆菌生长繁殖受到抑制,代谢受到干扰,致使蛋白酶的活性减弱。当发酵温度在41 ℃时,发酵液中多肽含量和ACE抑制率均达到最大值(分别为197.42 mg/g和76.13%)。因此,选择41 ℃作为纳豆菌发酵扇贝裙边制备ACE抑制肽的发酵温度。
2.2.2 发酵时间对多肽含量和 ACE抑制率的影响
不同的发酵时间对多肽含量和 ACE抑制率的影响见图4。由图4可知:不同的发酵时间对发酵液的多肽含量和ACE抑制率具有显著的影响。当发酵40 h时多肽含量和 ACE抑制率均达到最大值(分别为189.22 mg/g和70.27%),此后随着时间的延长,多肽含量和 ACE抑制率均降低。这是由于随着发酵的进行,已经发酵产生的部分 ACE抑制肽被蛋白酶分解形成不具有 ACE抑制活性的短肽或游离氨基酸,导致多肽含量和ACE抑制率均降低,该结果与梁美艳[25]报道的研究结果相吻合。因此,纳豆菌发酵扇贝裙边制备ACE抑制肽的最优发酵时间为40 h。

图4 发酵时间对多肽含量和ACE抑制率的影响Fig.4 Effect of fermentation time on peptide content and ACE inhibition rate
2.2.3 料液比对多肽含量和 ACE抑制率的影响

图5 料液比对多肽含量和ACE抑制率的影响Fig.5 Effect of material-to-liquid ratio on polypeptide content and ACE inhibition rate
不同的料液比对多肽含量和 ACE抑制率的影响见图 5。扇贝裙边蛋白作为本试验纳豆菌发酵的唯一氮源,一方面可以为纳豆菌生长繁殖提供充足的氮源和碳源,另一方面扇贝裙边蛋白可被纳豆菌分解形成多肽。当料液比较低时,培养基中含水量较少,不利于纳豆菌生长繁殖,产酶相对较少,导致多肽含量和ACE抑制率都不高,料液比较高时,稀释了发酵液中营养物质的浓度从而影响了发酵的速度,产生的多肽较少,导致 ACE抑制率也不高。因此,料液比对发酵液中多肽含量和 ACE抑制率具有显著的影响。当料液比为1:20时,多肽含量和ACE抑制率达到最高(分别为190.51 mg/g和74.01%)。因此选择料液比1:20作为纳豆菌发酵扇贝裙边制备ACE抑制肽的料液比。
2.2.4 接种量对多肽含量和 ACE抑制率的影响
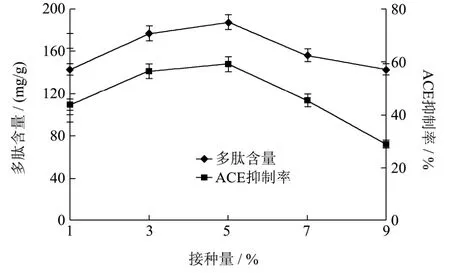
图6 接种量对多肽含量和ACE抑制率的影响Fig.6 Effect of inoculation amount on polypeptide content and ACE inhibition rate
不同的接种量对多肽含量和 ACE抑制率的影响见图6所示。由图6可知,接种量为5%时,发酵液多肽含量和 ACE抑制率均达到最佳(分别为 187.96 mg/g和59.21%)。这是由于当接种量较少时,产生的蛋白酶量会较少,导致纳豆菌分解扇贝裙边蛋白产生的多肽含量较少,ACE抑制率较低;当接种量过大时,纳豆菌生长过快,培养基中有限的营养条件限制了纳豆菌的生长繁殖和产酶能力,菌体自溶凋亡,导致多肽含量和 ACE抑制率都不高,常通[26]在对枯草芽孢杆菌发酵棉仔蛋白制备 ACE抑制肽条件的优化研究中也发现了这个规律。因此选择 5%的接种量作为纳豆菌发酵扇贝裙边制备ACE抑制肽最佳接种量指标。
2.3 响应面分析因素及水平
根据Box-Behnken试验设计原理,以多肽含量(Y1)和ACE抑制率(Y2)为响应变量,从单因素试验结果选出4个因素即发酵温度(X1)、发酵时间(X2)、接种量(X3)和料液比(X4)进行4因素3水平的响应面试验,试验因素水平见表1。

表1 响应面试验因素水平Table 1 Response surface test factor levels
2.4 响应面结果及分析
2.4.1 回归模型的建立和显著性检验
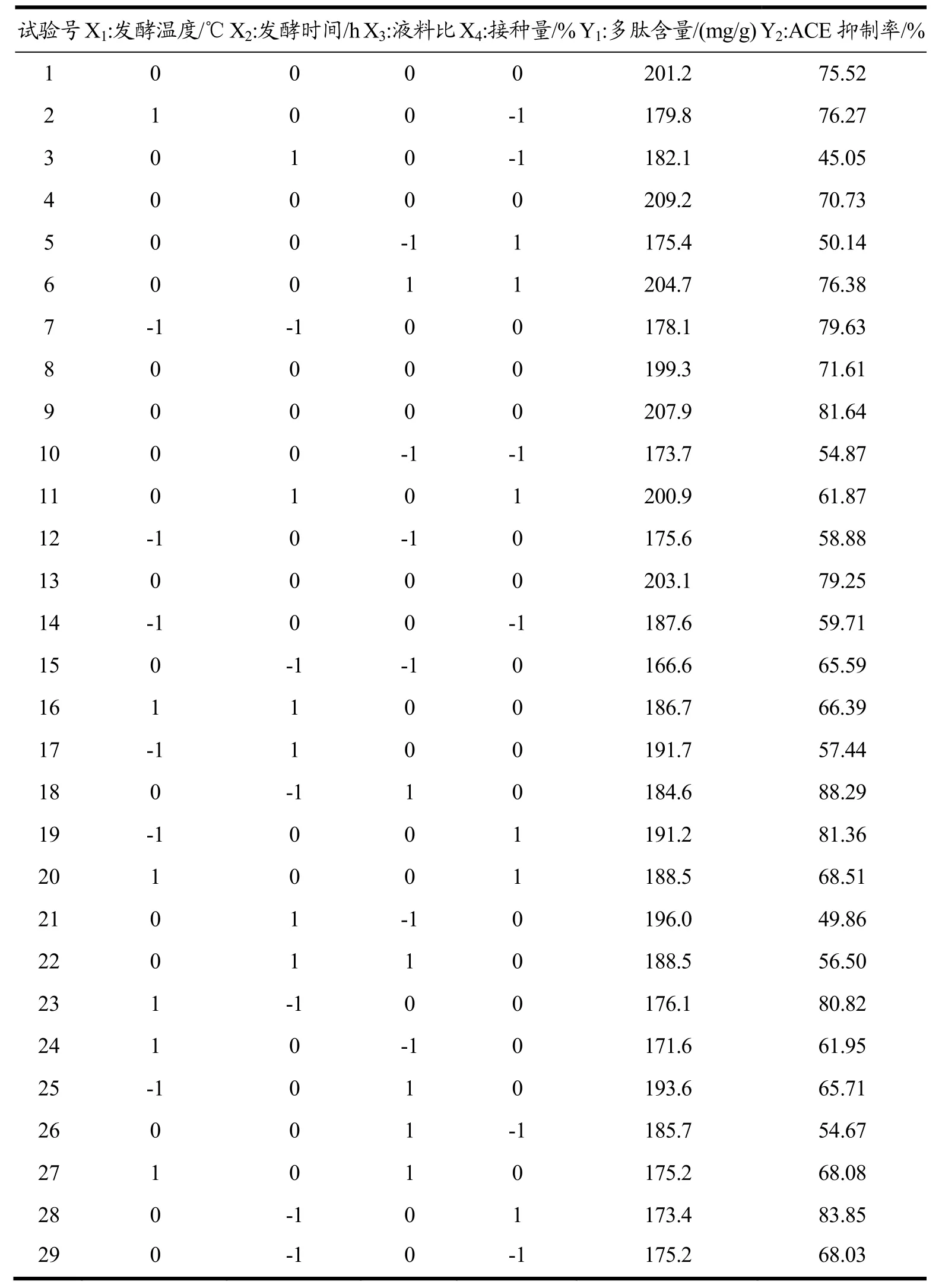
表2 响应面法试验设计及结果Table 2 Response surface methodology design and results

表3 多肽含量回归模型方差分析和方差系数显著性检验Table 3 Variance analysis of polypeptide content regression model and variance coefficient significance test
转下页
接上页

注:***差异极显著(p<0.001);**差异高度显著(p<0.01);*差异显著(p<0.05)。
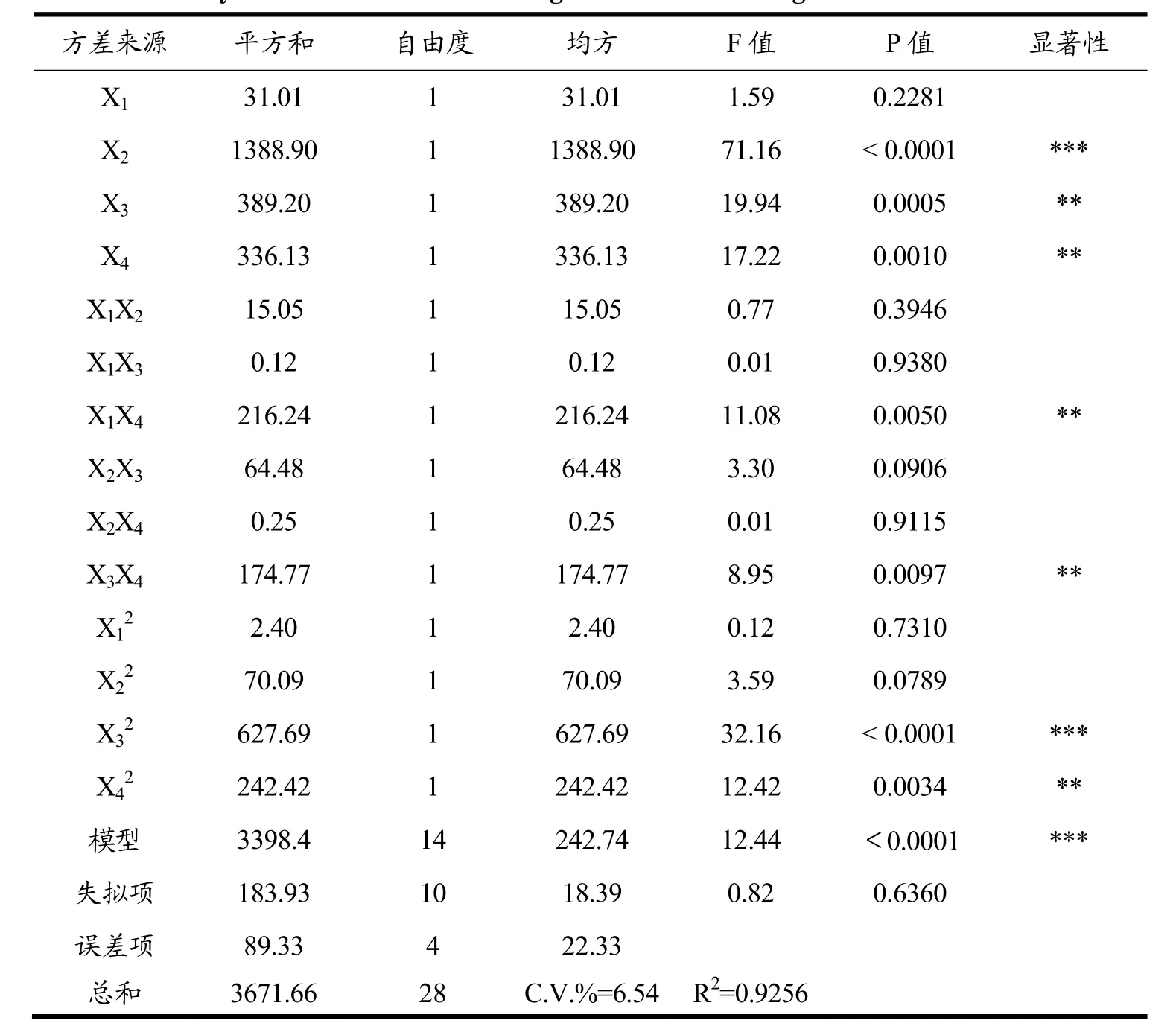
表4 ACE 抑制率回归模型方差分析和方差系数显著性检验Table 4 Variance analysis of ACE inhibition rate regression model and significance test of variance coefficient
各因素经二次多项回归拟合后,得到多肽含量Y1与发酵温度X1、发酵时间X2、液料比X3、接种量X44个因素的二次多项回归方程为:

对回归方程做显著性检验与方差分析,方差分析结果见表4,结果显示:多肽含量模型的F值为11.18,p<0.0001,说明试验所选用的二次多项模型具有高度的显著性,失拟项p>0.05,差异不显著,说明未知因素对实验结果的干扰较小,实验误差主要来源于随机误差;由统计学计算得出模型的确定系数R2=0.9179,说明此模型拟合度较好,可以用此模型对多肽含量进行分析和预测。
一次项 X2对扇贝裙边发酵液中多肽含量的影响极显著,X3影响高度显著,X1和X4影响显著;交互项中X2X3影响显著;二次项中影响极显著,X42影响高度显著。同时由表4中F值的检验还可知各因素对多肽含量影响的大小顺序为:X2(时间)>X3(液料比)>X4(接种量)>X1(温度)。因此,各个因素对扇贝裙边发酵液中多肽含量的影响不是简单的线性关系,而是呈二次关系。
各因素经二次多项回归拟合后,得到多肽含量Y1与发酵温度X1、发酵时间X2、液料比X3、接种量X44个因素的二次多项回归方程为:
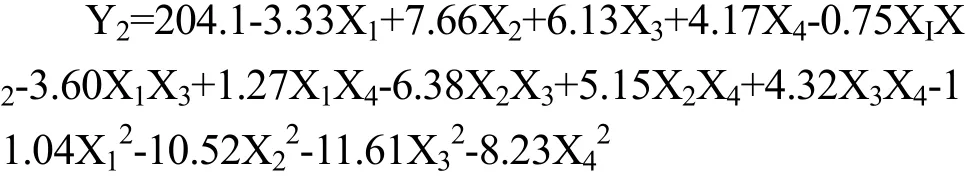
对回归方程做显著性检验与方差分析,方差分析结果见表 5,结果显示:ACE抑制率模型的 F值为12 .44,p<0.0001,说明试验所选用的二次多项模型具有高度的显著性,而且失拟项p>0.05,差异不显著,说明未知因素对实验结果的干扰较小,实验误差主要来源于随机误差;由统计学计算得出模型的确定系数R2=0.9256,说明此模型拟合度较好,能够很好地描述试验结果,因此可以用此模型对发酵液多肽含量进行分析和预测。
一次项X2对扇贝裙边发酵液ACE抑制率的影响极显著,X3和X4影响高度显著;交互项中X1X4、X3X4影响高度显著;二次项中影响极显著,X42影响高度显著。同时由表 5中 F值的检验还可知各因素对ACE抑制率影响的大小顺序为:X2(时间)>X3(液料比)>X4(接种量)>X1(温度)。因此,各个因素对扇贝裙边发酵液ACE抑制率的影响不是简单的线性关系。
2.4.2 响应面分析
2.4.2.1 多肽含量响应面结果分析
Y1模型的时间与温度、液料比与温度、接种量与温度、料液比与时间、接种量与时间、接种量与液料比的两因素间交互作用对扇贝裙边发酵液中多肽含量的影响见图7所示。

图7 多肽含量响应曲面图Fig.7 Response surface plot of polypeptide content
由图7a、7b可知,固定料液比为20,接种量为5%,当温度处于较高水平时,随着发酵时间的增大多肽含量先急剧升高后平缓降低,当发酵温度处于较低水平时,多肽含量随着发酵时间的增大先急剧升高后平缓降低;当发酵时间处于较低水平时,多肽含量随着发酵温度的升高而降低,变化趋势不是很明显,当发酵时间处于较高水平时,多肽含量随着发酵温度的升高先升高后降低。
由图7c、7d可知,固定发酵时间为40 h,接种量为 5%,当料液比处于较低水平时,随着发酵温度的升高,多肽含量先升高后降低,升高和降低都很明显,当料液比处于较高水平时,随着发酵温度的升高多肽含量先平缓上升后再急剧下降;当发酵温度处于较低水平时随着液料比的增大,多肽含量先急剧升高后趋于平缓,当发酵温度处于较高水平时随着液料比的增大,多肽含量先升高后降低。
由图7e、7f可知,固定发酵时间为40 h,液料比为20,当发酵温度处于较低和较高水平时,随着接种量的增大,多肽含量先增加后减少,变化幅度不明显;当接种量处于较高或较低水平时,随着发酵温度的升高,多肽含量先升高后降低。
由图7g、7h可知,固定发酵温度为41 ℃,接种量为 5%,当发酵时间处于较低水平时,随着料液比的增大多肽含量先急剧升高后缓慢下降,当发酵温度处于较高水平时,随着液料比的增大多肽含量先升高后降低;当液料比处于较低水平时,随着多肽含量先急剧升高后缓慢降低,当料液比处于中等水平时,多肽含量处于较高水平。发酵时间和液料比之间的交互作用显著。
由图7i、7j可知,固定发酵温度为41 ℃,料液比为20,当接种量处于较低水平时,多肽含量随着发酵时间的增大先升高后降低,当接种量处于较高水平时,随着发酵时间的延长,多肽含量急剧升高后趋于平缓;当发酵时间处于较低水平时,随着接种量的增大,多肽含量先升高后降低,变化趋势不是很明显,当发酵时间处于较高水平时,随着接种量的加大多肽含量先升高后趋于平缓。
由图7k、7l可知,固定发酵时间为40 h,发酵温度为 41 ℃,当接种量处于较低水平时,随着料液比的增大多肽含量先升高后降低,当接种量处于较高水平时,随着料液比的增大多肽含量急剧升高后趋于平缓;当料液比处于较低水平时,随着接种量的不断增大,多肽含量先升高后降低,变化趋势不是很明显,当料液比处于较高水平时,随着接种量的增大多肽含量先升高后趋于平缓。
2.4.2.2 ACE抑制率响应面结果分析

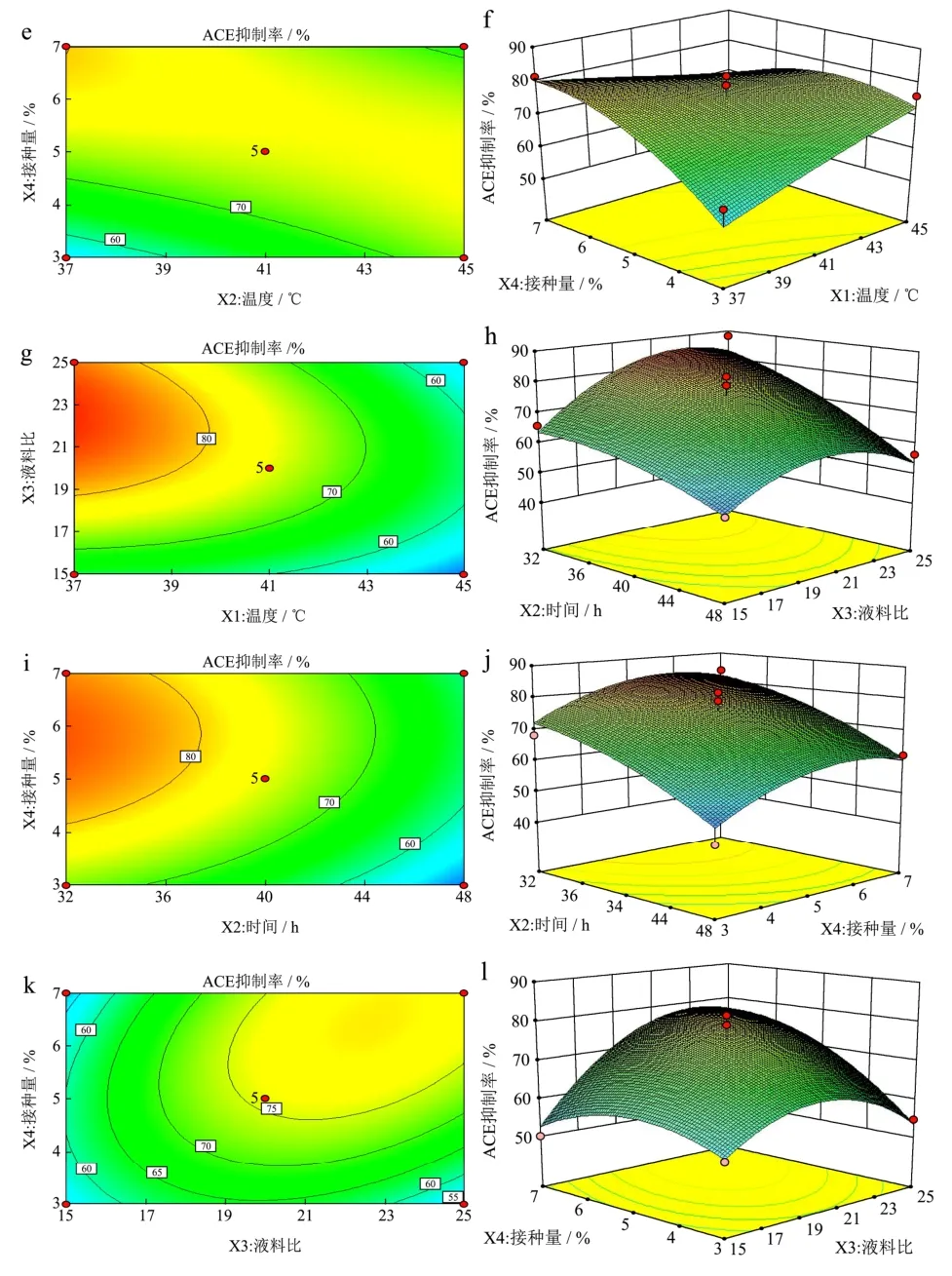
图8 ACE抑制率响应曲面图Fig.8 ACE inhibition rate response surface map
Y1模型的时间与温度、液料比与温度、接种量与温度、料液比与时间、接种量与时间、接种量与液料比的两因素间交互作用对扇贝裙边发酵液 ACE抑制率的影响见图8所示。
由图8a、8b可知,固定接种量为5%,液料比为20,当发酵温度处于较低和较高水平时,随着发酵时间的延长,ACE抑制率呈先平稳不变后下降的趋势;当发酵时间处于较高或者较低水平时,随着发酵温度的升高ACE抑制率无明显的变化。
由图8c、8d可知,固定发酵时间为40 h,接种量为 5%,当发酵温度处于较低和较高水平时,随着液料比的增大,ACE抑制率先升高后趋于平缓;当料液比处于较高和较低水平时,随着发酵温度的升高ACE无明显的变化。
由图8e、8f可知,固定发酵时间为40 h,液料比为20,当发酵温度处于较低水平时,随着接种量的增大,ACE抑制率先升高后趋于平缓,当发酵温度处于较高水平时,随着接种量的增大 ACE抑制率先升高后降低,变化趋势不明显;但当接种量处于较低和较高水平时,随着发酵温度的升高,ACE抑制率先升高后趋于平缓,接种量与发酵温度之间的交互作用显著。
由图8g、8h可知,固定发酵温度为41 ℃,接种量为 5%,当发酵时间处于较低水平时,随着液料比的增大 ACE抑制率先急剧上升后趋于平缓,当发酵时间处于较高水平时,随着液料比的增大 ACE抑制率先升高后降低,变化幅度不明显;当液料比处于较低水平时,随着发酵时间的延长,ACE抑制率逐渐升高后降低,当液料比处于较高水平时,随着发酵时间的延长,ACE抑制率变化幅度不明显。
由图8i、8j可知,固定发酵温度为41 ℃,液料比为20,当发酵时间处于较低水平时,随着接种量的增大 ACE抑制率先平缓升高后降低,当发酵时间处于较高水平时,随着接种量的增大 ACE抑制率先急剧升高后降低;当接种量处于较高或者较低水平时,随着发酵时间的延长,ACE抑制率先升高后降低,变化趋势不是很明显。
由图8k、8l可知,固定发酵时间为40 h,发酵温度为 41 ℃,当接种量处于较低水平时,随着液料比的增大,ACE抑制率先升高后降低,变化趋势不是特别明显,当接种量处于较高水平时,随着液料比的增大,ACE抑制率先急剧升高后趋于平缓;当液料比处于较低水平时,随着接种量的不断增大 ACE抑制率先升高后降低,当料液比处于较高水平时,随着接种量的不断加大 ACE抑制率先急剧升高后降低。接种量和液料比之间的交互作用显著。
2.4.3 最优发酵工艺的验证试验
经Box-Behnken设计试验可以得到纳豆菌发酵扇贝裙边制备 ACE抑制肽的最佳工艺条件为:发酵时间38.38 h,发酵温度39.78 ℃,接种量6.08%,液料比22.45。在此最佳发酵条件下,多肽含量和ACE抑制率的理论值是203.70 mg/g和82.22%。为方便操作,将发酵条件设定为:发酵时间 38.4 h,发酵温度39.8 ℃,接种量6.0%,液料比22.5。在此发酵条件下,多肽含量高达238.91 mg/g,ACE抑制率达到83.70%,明显高于陈飞平等[27]利用碱性蛋白酶酶解菜籽蛋白、周晓晴等[28]利用胃蛋白酶酶解鲫鱼下脚料达到了46.45%、75.79%的抑制率,说明响应面分析法对纳豆菌发酵扇贝裙边制备 ACE抑制肽的条件优化是可行的。
3 结论
3.1 本文以扇贝裙边为原料,利用实验室分离并保藏的纳豆菌作为发酵菌株,以多肽含量和 ACE抑制率为检测指标,采用响应面法优化 ACE抑制肽制备工艺,考察发酵时间、发酵温度、液料比和接种量对发酵液多肽含量和ACE抑制率的影响,以得到制备ACE抑制肽的最佳发酵工艺。在单因素的基础上,采用Box-Behnken试验设计方法对ACE抑制肽的制备工艺进行四因素三水平设计,并采用Design-Expert8.0.6对试验的数据进行分析处理。试验结果表明,发酵时间、发酵温度、液料比和接种量对肽含量均具有显著影响,发酵时间与接种量的交互作用对多肽含量具有显著影响;发酵时间、液料比和接种量对 ACE抑制率具有显著影响,接种量与发酵时间、接种量与液料比之间的交互作用对 ACE抑制率具有显著影响。响应面法优化制备 ACE抑制肽的最佳工艺条件为发酵时间38.4 h,发酵温度39.9 ℃,接种量6.0%,液料比22.5。在此最佳发酵条件下,多肽含量和 ACE抑制率的理论值是203.70 mg/g和82.22%。3次平行验证试验结果为多肽含量238.91 mg/g,ACE抑制率为83.70%,IC50为5.70 mg/ml,与理论值较接近,模型可靠。该发酵工艺简单可靠,多肽含量高且ACE抑制率较高,为扇贝裙边源 ACE抑制肽的研究与开发提供理论依据。
3.2 虽然本文已验证在最优发酵条件下利用纳豆菌发酵扇贝裙边的产物具有较高的 ACE抑制率,但发酵得到的扇贝裙边多肽仍是混合物,ACE抑制肽的具体序列及作用机理尚有待进一步探究。

