6-姜烯酚诱导人结肠癌细胞HT29凋亡及与VEGFR2表达变化的关系
王宇锋,孙游,李海,杨春
(1.上海交通大学医学院附属上海儿童医学中心,上海 200127)(2.上海市宝山区仁和医院眼科,上海 201900)(3.宁夏医科大学总医院,宁夏银川 750004)
结直肠癌是消化道最常见的恶性肿瘤之一,根据最新临床数据表明,其发病率和死亡率呈逐年上升趋势,其发病率已位居恶性肿瘤的第三位,而死亡率位居第四位[1]。在我国,尤其是近年来随着居民物质生活水平的不断提高以及饮食结构的改变,结直肠癌的发病率及死亡率一直呈现升高态势,且发病多在 40岁以后,男女之比例大约为 2:1,严重危害了人们的生存质量[2]。结直肠癌早期得到确诊的只有 5%,60~70%的结直肠癌患者就诊时已是中晚期,结直肠癌患者的5年生存率:I期为93%,II期约为80%,III期约为60%,IV期约为8%,早期诊断能明显提高患者生存率[3]。目前外科手术辅助放、化疗治疗手段仍是治疗结直肠癌的主要方法,但是却给患者带来了巨大的心理负担和经济压力[4]。故探索结直肠肿瘤的发生发展机制,对于寻找新的治疗方案,降低结直肠肿瘤的发病率和死亡率具有很大的意义。
近年来,根据最新调查研究表明[5],饮食因素和饮食习惯的改变与结直肠癌的关系甚为紧密,这为结直肠癌的有效预防和控制提供了更深层次、更全面的依据。而生姜作为一种膳食补充剂、调味作料和中药成分,姜酚和姜辣素是其中最主要的辣味活性物质[6],当遇热后,姜酚一方面通过醇醛缩合化学反应转化为脂肪醛和姜油酮,另一方面可以通过脱水反应生成6-姜烯酚[7],而其中 6-姜烯酚(6-shogoal,6S)不仅具有提高机体免疫力[8]、诱导细胞自噬[9]、杀菌消毒[10]、止吐[11]等功效,还可有效抑制平滑肌细胞增殖[12]、抑制肿瘤增殖[13]等特性。
本研究拟通过体外细胞实验应用不同浓度6-姜烯酚诱导结肠癌细胞HT29凋亡,并检测VEGFR2蛋白的表达水平变化,进而探讨6-姜烯酚抑制结肠癌细胞HT29增殖的相关可能机制,旨在为进一步研究6-姜烯酚抑制结直肠肿瘤增殖的相关靶点或具体机制研究奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
6-姜烯酚纯度97%,购自于成都德瑞可生物科技有限公司;Mc Coy's 5A培养基、胎牛血清(FBS)进口于美国GIBCO公司;1.5 M TRIS HCL缓冲液、1.0 M TRIS HCL缓冲液、Tris-甘氨酸-SDS电泳缓冲液、Tris-甘氨酸电泳缓冲液、甲醇、TBST、TEMED均购自于美国 Sigma公司;双抗(青霉素加链霉素)、10×Loading Buffer、CCK8试剂盒、BCA蛋白提取试剂盒、BCA蛋白定量试剂盒、Annexin V-FITC/PI细胞凋亡周期检测试剂盒购自于南京凯基生物公司;脱脂牛奶、ECL显色液购于新西兰生物公司;0.45 umPVDF膜、抗VEGFR2抗体(鼠抗人,1:2000稀释)购于 ABCAM 公司;30%聚丙烯酰胺购于 Bio-Rad Laboratories(Berkeley,CA);蛋白marker(10~180 Ku)、Tween20、山羊抗兔 IgG抗体(含辣根酶)、Annexin V-FITC/PI凋亡检测试剂盒购自于美国GIBCO公司。
1.1.2 实验仪器
超净工作台(Bio-Rad,型号ESCO AC2);相差倒置荧光显微镜(型号CKX 41),日本NICON公司;NICON图像采集系统(型号MM 200),日本NICON公司;Bio-Rad凝胶成像分析仪(型号Gel Doc 2000),美国 Bio-Rad公司;-80 ℃低温冰箱(型号FYL-YS-81A),日本SANYO公司;-20 ℃冰箱(型号 BCD-205 HK)青岛海尔公司;4 ℃冰箱(型号BD-105 DEW),青岛海尔公司;低温高速离心机(型号5430 R),美国EPPENDORF公司;电子天平(型号FA 1004),上海京孚仪器有限公司;水平脱色摇床(型号WD-9405 C/D),江苏海门其林贝尔仪器制造有限公司。
1.1.3 实验细胞
HT29(原位结肠癌细胞)细胞株购自美国ATCC细胞库(American type culture collection),单层贴壁生长,集落形成率40%,裸鼠致瘤性100%。细胞培养条件:Mc Coy's 5A培养基+10%胎牛血清+0.1%双抗(100 U/mL青霉素、100 mg/L链霉素),置于37 ℃、95% O2、5% CO2细胞培养箱中培养。
1.2 实验方法
1.2.1 细胞复苏与常规培养
将Mc Coy's 5A培养基、胎牛血清(FBS)提前室温或 37 ℃温箱内预热处理,并将可能用到的实验耗材(15 mL、50 mL离心管,EP管,1.5 mL冻存管,微量加样器,各型枪头等)提前放在超净工作台内,打开紫外线灯照射 30~40 min,调整水浴锅温度至37.5 ℃,快速从液氮罐中提出所需要的1.5 mL冻存管,将其底部半浸入水浴锅内快速震荡1 min左右,待到1.5 mL冻存管内的冻存细胞液迅速融化后,立即转入超净工作台内,移液器吸出冻存液并及时转入已经提前加入了2~3 mL含胎牛血清和双抗(100 U/m L青霉素、100 mg/L链霉素)培养基的15 mL离心管内,混匀后低温高速离心机离心(4 ℃,1500 r/min,5 min),吸除上清液,并向离心管内加入1~2 mL预先配好的完全细胞培养液,轻轻均匀混悬细胞后继续转入新的培养皿,并在培养皿上标识细胞系名称及复苏时间,置于37.5 ℃、5% CO2培养箱中培养备用。
1.2.2 分组药物干预
设立 4组不同浓度药物干预组:HT29-对照(DMSO)、HT29-6姜烯酚(10 μM)、HT29-6姜烯酚(20 μM)、HT29-6 姜烯酚(40 μM)组,于37 ℃、5% CO2培养箱中培养24 h,应用相差倒置显微镜观察不同浓度6-姜烯酚对不同分组细胞增殖的影响及细胞形态的不同变化,并拍照。
1.2.3 CCK8法制作细胞抑制率标准曲线
采用细胞计数板计数不同分组细胞悬液中的细胞数量,根据细胞计数数量,再按比例接种培养细胞,在96孔板中按照1:2比例依次加入用Mc Coy's 5 A培养基等比例稀释成一个细胞浓度梯度(0、5、10、15、20、25、30、40、45、50 μL),每组设置3 到6 个副孔,再将 96孔板内按比例接种的细胞悬液配成 100 μL/孔,最后置于37.5 ℃、5% CO2培养箱中分别培养24、48 h。每孔加入10 μL CCK-8溶液,将细胞培养板在37.5 ℃、5% CO2培养箱中孵育1~4 h,调至酶标仪490 nm波长处检测每个细胞孔的光密度值。按照公式抑制率=1-加药组OD值/对照组OD值(Optical Density),并计算出细胞存活率及抑制率=50%时的药物浓度,即IC50。
1.2.4 提取细胞蛋白,并测定蛋白含量
将所培养的不同分组细胞培养皿中的细胞培养液全部吸除,根据比例(10 mL:150 mm培养板)加入之前4 ℃冰箱预冷处理的PBS液重复冲洗2~3遍,摇晃均匀,最大限度的吸除培养皿内培养液,在1 mL预冷的Lysis Buffer中分别加入10 μL磷酸酶抑制剂、5 μL 100 mM PMSF及1 μL蛋白酶抑制剂,加入并充分晃动细胞培养皿,置于冰上保存1~2 h待用。PBS重复细胞洗涤2~3次后,再次将细胞及其悬液转入预冷的15或50 mL离心管中,根据细胞数量和培养皿大小加入上述配置的冷Lysis Buffer,最后将加入裂解液的细胞培养皿再次置于4 ℃水平摇床平台上,剧烈震荡30 s,再次放置于冰上4~5 min,重复本次操作4~5次,低温高速离心机内离心(12000 r/min,4 ℃,5 min),吸出离心管内上清液即为细胞全蛋白提取物,细胞蛋白含量检测试剂盒检测蛋白分子量后分装保存于-80 ℃冰箱内备用。
1.2.5 Annexin V-FITC/PI流式细胞术检测细胞凋亡
将所培养的不同分组细胞,先用胰酶消化,细胞计数板计数,取 5×105~1×106个/mL细胞,低温高速离心机内离心(1500 r/min,4 ℃,10 min),弃上清液,加入1 mL预冷的PBS,充分摇晃均匀使细胞悬浮,再次低温高速离心机内离心(1500 r/min,4 ℃,10 min),弃上清。重复 2~3次,将细胞重悬于 200 μL Binding Buffer,加入10 uL Annexin V-FITC轻轻混匀,避光室温反应15 min。加入300 μL Binding Buffer(总反应体积500 μL)以及5 μL PI,1小时内在流式细胞仪上进行观察、记录检测结果,并绘制细胞凋亡结果图进行比较。
1.2.6 细胞周期检测试剂盒检测细胞凋亡周期
加入不同浓度的6-姜烯酚诱导细胞凋亡,同时设立阴性对照组,消化、收集不同分组细胞,预冷的PBS洗涤细胞 2~3次,并低温高速离心机内离心(2000 r/min,4 ℃,5 min),弃上清液,调整细胞浓度为1×106个/mL细胞。取1 mL上述细胞悬液,加入体积分数为70%冷乙醇500 μL进行固定,过夜,4 ℃冰箱保存,染色前用PBS洗去固定液2~3次,加入100 μL RNaseA后置于37.5 ℃水浴锅中30 min,再加入400 μL PI染色均匀,4 ℃冰箱内避光、保存30 min,最后在488 nm激发波长处检测周期变化。
1.2.7 Western-Blot 检测蛋白表达
根据上述操作所测蛋白样品浓度,将不同分组蛋白样品经SDS-PAGE电泳100 V,1.5~2 h(浓缩胶5%、分离胶10%),然后电转液中湿性电转100 V、1 h,电转至PVDF膜,4%脱脂奶粉37 ℃封闭1.5~2 h,水平摇床摇匀,加入相应的抗体VEGFR2(1:2000稀释)、β-actin(1:1500稀释),4 ℃冰箱孵育、过夜。应用1%TBST洗膜2~3次,加入相应的二抗(鼠抗兔)进行免疫杂交反应,37.5 ℃室温孵育2 h,再用1% TBST洗膜2~3次后,最后再加入适宜剂量的ECL显色液(A液和B液在EP管内等体积混合),在暗室凝胶成像仪下曝光成像,并用扫描仪扫描出胶片图像,采用凝胶图像分析软件(Quantity One)对结果进行定量分析。每个实验重复2~3次,取其平均值
1.3 统计学分析
应用SPSS20.0统计软件进行数据处理,实验数据以平均数±标准差(±s)表示,组间比较采用ANOVA方差分析,p≤0.05为检验水准,差异具有统计学意义。
2 结果与讨论
2.1 6-姜烯酚可明显抑制HT29细胞增殖
不同分组HT29加入不同浓度6-姜烯酚干预后,置于37 ℃、5% CO2培养箱中培养24 h,在相差倒置显微镜下观察细胞的生长状况及形态变化(放大倍数:40×10 倍)。
结果如图1所示,阴性对照组细胞生长良好,随着6-姜烯酚浓度由10 μM增加到40 μM,细胞生长状态明显受抑制,活性较差,细胞体积变小,细胞间连接减少,脱离较多,且随药物浓度增加,细胞生长活性受影响越明显。

图1 显微镜下不同浓度6-姜烯酚干预HT29 24 h后细胞的形态变化Fig.1 Morphological changes of HT29 intervened under different concentrations of 6-shogoal by microscope after 24 h(±s,n=3)
2.2 CCK8法检测药物干预后细胞抑制率变化
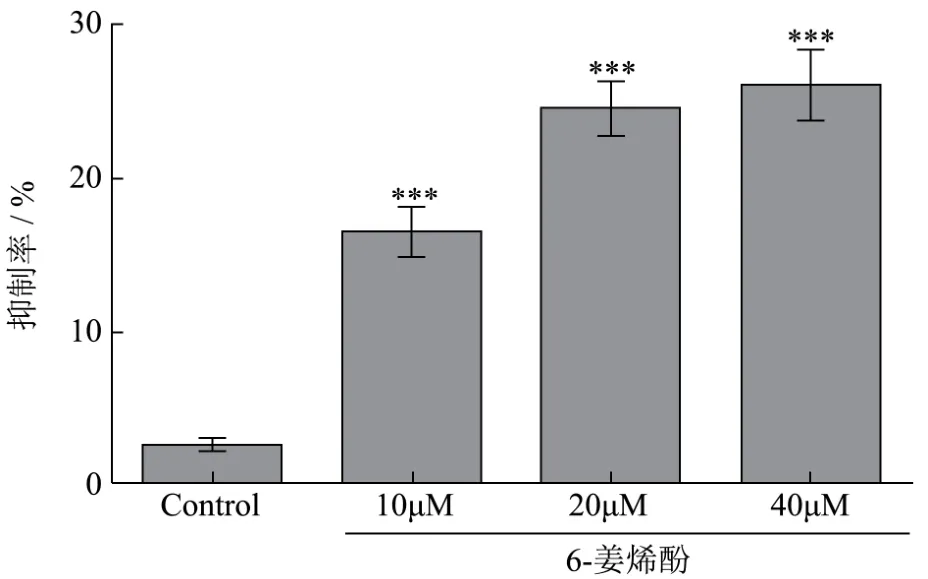
图2 CCK8法检测不同浓度6-姜烯酚对HT29增殖能力的调控Fig.2 CCK8 assay was used to detect the proliferation of HT29 at different concentrations of 6-shogoal (24 h)(±s,n=3)
不同分组细胞培养板在培养箱内孵育 1~4 h,并用酶标仪测在490 nm处检测、记录吸光度值,并计算出细胞抑制率。结果如(图 2)显示,与阴性对照组相比,HT29-6姜烯酚组细胞存活抑制率明显升高,尤其在HT29-6姜烯酚浓度达到40 μM时细胞存活抑制率升高更为明显(p<0.05);并计算出 6-姜烯酚对HT29 细胞的IC50为 18.7 μmol/L。
2.3 Annexin V-FITC/PI流式细胞术检测 6-姜烯酚诱导HT29凋亡
国内有报道研究[14],在研究6-姜烯酚对结肠癌细胞HCT116的抑制作用中发现,6-姜烯酚(20 μM)通过促进FTL(Recombinant Ferritin,Light Polypeptide)、GCLC(谷氨酰半胱胺酸合成酶抗体)、核蛋白Nrf2(核因子E2相关因子2)表达及抑制Keap1(Kelch like ECH Associated Protein 1)、胞浆蛋白中Nrf2表达诱导结肠癌细胞HCT116发生凋亡,进而抑制肿瘤细胞增殖。还有研究表明[15],Tan通过对微阵列基因表达谱和连通图的进一步分析对比中发现6-姜烯酚是通过激活PPARγ(peroxisome proliferator activated receptor-γ)介导的分子信号通路来增加其对肿瘤增殖的抑制作用。而本实验将培养的各分组细胞(HT29)分别用流式细胞仪检测细胞凋亡情况,从荧光双参数点图可以观察(图3),其中右上象限和右下象限为死亡细胞数。与阴性对照组相比,HT29-6姜烯酚组随着药物浓度由低-中-高,右上象限和右下象限死亡细胞数明显不同程度增加(p<0.05)。从而证实6-姜烯酚可以诱导HT29发生凋亡,进而抑制肿瘤细胞增殖。

图3 Annexin V-FITC/PI流式细胞术检测不同浓度6-姜烯酚诱导人HT29凋亡Fig.3 Annexin V-FITC/pI flow cytometry was used to detect the apoptosis of human HT29 induced by 6-shogoal (±s,n=3)
2.4 细胞凋亡周期检测试剂盒检测 6-姜烯酚诱导HT29凋亡后细胞增殖周期改变
本课题组在前期研究中发现[16],6-姜烯酚可诱导结直肠肿瘤细胞SW480发生凋亡,并导致G0/G1期的细胞数由高降到低,而G2/M期的细胞数由低到高,致使该细胞增殖周期被阻断在G2/M期,进而抑制肿瘤细胞增殖。同时赵行宇[17]在研究 6-姜烯酚对胃癌BGC-823细胞凋亡及其机制实验中指出不同浓度 6-姜烯酚处理胃癌细胞24 h后,随药物浓度增加,胃癌BGC-823细胞的早期凋亡率也呈现升高态势,与对照组相比,差异具有统计学意义。本实验将培养的各分组细胞(HT29)分别用流式细胞仪检测,如表1所示,可以观察到 HT29-6姜烯酚组随着药物浓度由低-中-高,细胞增殖周期中各期细胞构成比发生明显变化。与阴性对照组相比,其中G0/G1期的细胞数由49.48%下降到24.39%和17.18%(p<0.05),而G2/M期的细胞数由3.44%增加到34.78%和49.54%(p<0.05),提示HT29细胞被阻断在G2/M期。
表1 细胞凋亡周期检测试剂盒检测不同浓度6-姜烯酚诱导人HT29凋亡细胞周期变化Table 1 The cell cycle changes of apoptosis induced by different concentrations of 6-shogoal in human HT29 were detected by cell cycle detection kit (±s,n=3)
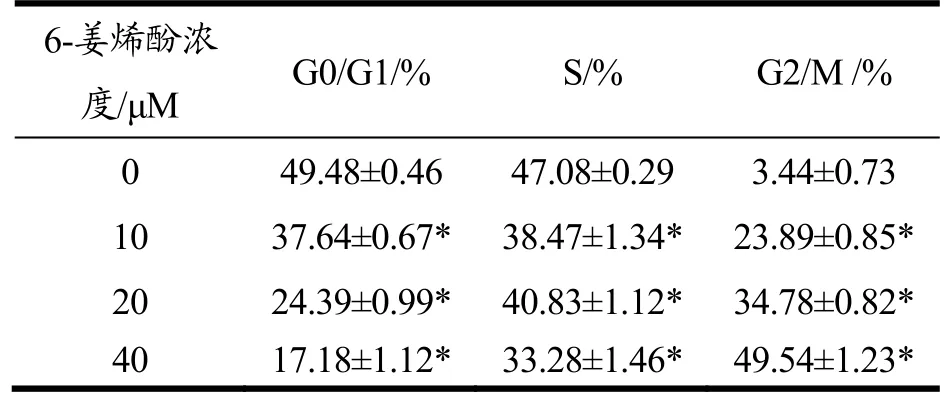
表1 细胞凋亡周期检测试剂盒检测不同浓度6-姜烯酚诱导人HT29凋亡细胞周期变化Table 1 The cell cycle changes of apoptosis induced by different concentrations of 6-shogoal in human HT29 were detected by cell cycle detection kit (±s,n=3)
注:与对照组相比,*p<0.05,**p<0.01,***p<0.001。
6-姜烯酚浓度/μM G0/G1/% S/% G2/M /%0 49.48±0.46 47.08±0.29 3.44±0.73 10 37.64±0.67* 38.47±1.34* 23.89±0.85*20 24.39±0.99* 40.83±1.12* 34.78±0.82*40 17.18±1.12* 33.28±1.46* 49.54±1.23*
2.5 6-姜烯酚可不同程度抑制VEGFR2的表达
国内学者刘洪金[18]在研究贝伐珠单抗对结直肠癌细胞VEGFR1和VEGFR2表达的影响中发现贝伐珠单抗可诱导血管内皮生长因子(VEGF)表达下调,却使VEGF相关受体(VEGFR1、VEGFR2)表达升高,而VEGFR1和VEGFR2可直接不同程度的提高肿瘤新生血管的生长、侵袭能力,间接导致了贝伐珠单抗对新血管新生和肿瘤侵袭的抑制作用减弱,进而产生临床耐药性。同时还有报道[19]在研究不同浓度的藤黄酸诱导结肠癌细胞SW480凋亡与VEGFR2蛋白的表达影响一文中指出,藤黄酸可以诱导人结肠癌细胞株SW480发生凋亡,并使SW480细胞发生G2/M期阻滞,而VEGFR2蛋白的表达随药物浓度的增加而减少,进而推断其作用机制可能与抑制VEGFR2表达有关。本研究结果显示如图4(a、b)所示,药物干预4组细胞24 h后,与阴性对照组比较,Western-blot检测不同浓度的6-姜烯酚对VEGFR2表达水平呈现不同程度降低(p<0.05),提示6-姜烯酚诱导HT29凋亡进而抑制肿瘤细胞增殖,可能与不同程度抑制VEGFR2有关。
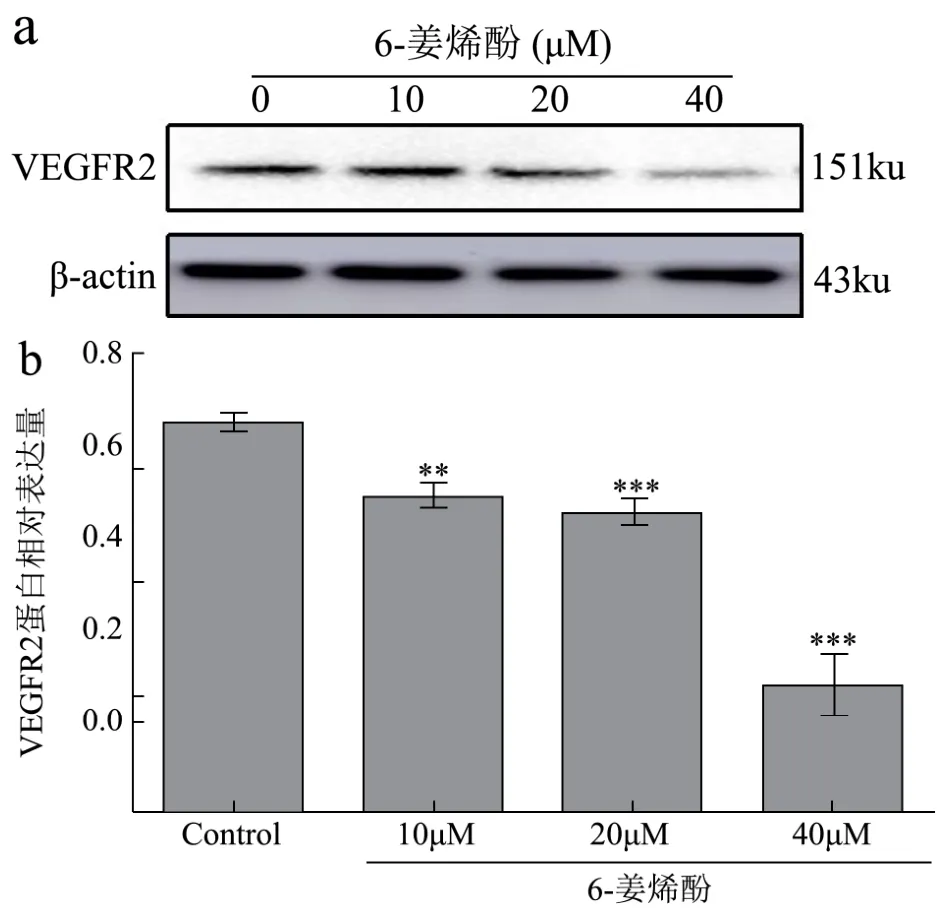
图4 Western-blot 检测不同浓度6-姜烯酚对HT29中VEGFR2表达的影响Fig.4 The effect of 6-shogoal on the expression of VEGFR2 in HT29 was detected by Western-blot(±s,n=3)
3 结论
3.1 细胞凋亡是多细胞生物整个生命过程中不可缺少的环节,对机体内损伤、衰老细胞的清除、更新及各组织器官的发育都起着十分重要的作用[20,21]。近年来,细胞凋亡越来越受到广大科研工作者的关注,目前发现真核细胞的凋亡过程主要有以下四种:外部凋亡途径(经死亡受体介导)、内部凋亡途径(经线粒体介导)、细胞凋亡途径(经B粒酶介导)、内质网应激途径[22]。一般情况下,细胞凋亡过程都会受到机体严格、紧密的调控,以维持机体各组织器官的正常发育和免疫系统的建立[23]。
3.2VEGFR2(血管内皮细胞生长因子受体2),又称FLK-1,一般存在于血管和淋巴管内皮等处。VEGFR2可与VEGF-C、VEGF-D等结合进而发挥对淋巴管内皮细胞和血管内皮细胞的调节作用,其还具有介导淋巴管和血管的新生,有效调节淋巴细胞的迁移等功能[24]。众所周知,血管生长因子和血管生长抑制因子共同调节新生血管的形成,其中最主要的影响因子是VEGF(血管内皮生长因子)及其受体 VEGFR-2,而VEGFR-2作为VEGF调节新生血管生成的核心因子,对内皮细胞的增殖、分化以及肿瘤新生血管的形成都具有重大的意义[25]。张靖宇[26]在探讨胰岛素样生长因子 1受体(IGF-1R)和血管内皮细胞生长因子受体2(VEGFR2)蛋白在结直肠癌组织中的表达意义中发现结直肠癌患者肿瘤组织中IGF-1R、VEGFR2及mRNA表达明显升高,且蛋白的表达水平受到结直肠肿瘤组织学分级、浸润深度、有无淋巴结转移及术后辅助化疗的影响,并指出IGF-1R和VEGFR2联合检测可为结直肠癌患者的靶向治疗提供临床依据。
3.3 本实验从细胞形态学上可以发现随着 6-姜烯酚浓度由低到高,细胞生长活性状态明显受抑制,且随药物浓度增加,细胞生长活性受影响越明显,具有浓度依赖性。进一步通过流式细胞术检测发现6-姜烯酚可诱导HT29发生凋亡,并致使细胞增殖周期被G2/M期,干扰了DNA合成和有丝分裂,抑制结肠癌细胞HT29增殖。而 Western-blot 检测不同浓度的 6-姜烯酚对VEGFR2表达水平却呈现不同程度降低,提示6-姜烯酚诱导HT29凋亡进而抑制肿瘤细胞增殖,可能与不同程度抑制VEGFR2有关。
3.4 本研究结果虽然证实了 6-姜烯酚诱导结肠癌细胞HT29凋亡可能与不同程度地抑制VEGFR2表达水平有关,但是6-姜烯酚是否通过影响其它凋亡途径或者具体的抑制结直肠肿瘤细胞机制是与哪些信号通路有关尚未完全明确,还需要进一步更加系统、深入的研究。随着国内外学者对6-姜烯酚的不断深入研究,其对结直肠癌的具体相关机制或信号通路必将更加明确,也必将为我们针对结直肠癌的诊治提供更加广阔的空间。

