结直肠癌组织中锌指E盒同源结合蛋白-1、赖氨酸酰氧化酶-2的表达变化及意义
何月新,王斌,穆雅,边莲,高立娟
(天津市北辰医院,天津300499)
结直肠癌是消化道常见恶性肿瘤之一。据美国癌症学会统计,结直肠癌在所有确诊的恶性肿瘤中发病率高居第三,且结直肠癌的发病率有年轻化趋势[1]。结直肠癌的治疗手段除传统外科手术切除外,近年化疗、放疗、靶向治疗等方法陆续用于临床,但目前仍以外科手术切除为主[2]。随着影像技术、内镜检查及检验技术的进步,全直肠系膜切除术手术方式的确立,使结直肠癌患者手术切除率可达75%[3],但由于较高的复发率及转移率,结直肠癌患者远期预后并不乐观。因此探究结直肠癌组织中肿瘤细胞浸润转移的机制,从而找到针对性的防治方法,是改善结直肠癌患者预后的重要手段。锌指E盒同源结合蛋白-1(ZEB1)作为锌指蛋白的一种,参与调控机体的胚胎发育和细胞分化过程[4]。研究[5]发现,ZEB1在多种恶性肿瘤中过表达,且与肿瘤细胞的上皮-间质转化(EMT)密切相关。赖氨酸酰氧化酶-2(LOXL2)属于赖氨酰氧化酶(LOX)家族,能够通过影响肿瘤细胞的微环境,促进肿瘤细胞的浸润转移[6]。本研究利用免疫组化法检测ZEB1与LOXL2的表达情况,结合患者临床资料及术后随访结果,以探究ZEB1、LOXL2在结直肠癌组织中的表达变化及其临床意义。
1 资料与方法
1.1 临床资料 选取天津市北辰医院2010年1月~2017年1月收治的结直肠癌患者83例,均经病理检查确诊。取病理科结直肠癌患者癌组织及对应的癌旁组织存档蜡块83例份。纳入标准:癌组织、癌旁组织的石蜡标本保存完整且一一对应;临床病历资料完整;术前未经放、化疗等其他抗肿瘤手段治疗;未合并其他严重疾病。排除标准:患者临床病历资料缺失或石蜡标本缺失;合并其他恶性肿瘤;合并其他影响免疫组化结果的疾病;术前已经放、化疗等其他抗肿瘤手段治疗;失访。其中患者男44例,女39例;年龄34~71(57.31±11.09)岁,<65岁53例,≥65岁30例;经病理科确认,组织分化程度高者30例,中、低程度者53例;TNM分级Ⅰ、Ⅱ级者46例,Ⅲ、Ⅳ级者37例;浸润程度T1、T2者46例,T3、T4者37例;淋巴结转移者38例,无转移者45例。本研究经本院医学伦理委员会批准,患者及家属知情同意。
1.2 组织中ZEB1、LOXL2表达的检测 采用免疫组织化学法。将石蜡组织切片,常规脱蜡、水化,自来水轻柔冲洗,加入柠檬酸钠抗原修复液(上海士锋生物科技有限公司),微波修复20 min。冷却至室温,PBS洗涤,加入内源性过氧化物酶阻断剂(上海士锋生物科技有限公司),PBS冲洗3×3 min。加入一抗(美国Gene Tex公司),4 ℃孵育过夜。次日,将切片放置至室温后,PBS冲洗3×5 min,加入聚合物增强剂(Elivision试剂盒A试剂,上海士锋生物科技有限公司),室温孵育20 min,PBS冲洗3×3 min。加入酶标抗兔聚合物(Elivision试剂盒B试剂),室温孵育30 min,PBS冲洗3×3 min。DAB显色(上海士锋生物科技有限公司),梯度乙醇脱水,常规中性树胶封片。PBS替代一抗作为阴性对照。染色结果判定:本研究结果由两位病理科高年资医师双盲法独立判定。ZEB1染色定位于细胞核,LOXL2染色定位于细胞质。取400倍光学高倍镜下4个视野,每个视野至少含有100个细胞,最终结果取4个视野评分的算术平均值。染色结果评分由两部分组成:染色强度计分:无染色计0分,淡黄色计1分,黄色至黄棕色计2分,褐色计3分;染色数目计分:染色细胞<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。最终染色评分为强度计分+数目计分,≥2分则该组织切片的免疫组化结果视为阳性。
1.3 随访 患者出院后,利用电话、电子通讯等手段结合复诊病历对患者及其家属进行随访调查,随访截止于2017年12月,时长11~62个月,中位随访时间为30个月。
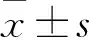
2 结果
2.1 结直肠癌组织与癌旁组织中ZEB1与LOXL2的表达比较 结直肠癌组织中ZEB1、LOXL2阳性表达率分别为30.12%(25/83)、75.90%(63/83),癌旁组织中分别为0(0/83)、13.25%(11/83),二者比较,χ2分别为29.433、65.932,P均<0.01。
2.2 结直肠癌组织中ZEB1、LOXL2表达与患者临床病理特征的关系 结直肠癌组织中,ZEB1及LOXL2的阳性表达率与患者TNM分期、浸润程度、淋巴结转移相关(P均<0.05),与性别、年龄、肿瘤组织分化程度无关(P均>0.05)。见表1。
2.3 结直肠癌组织中ZEB1、LOXL2之间的关系 Spearman秩相关检验显示,结直肠癌组织中ZEB1与LOXL2的表达呈正相关(rs=0.348,P=0.001)。
2.4 结直肠癌组织中ZEB1、LOXL2表达与患者预后的关系 将ZEB1/LOXL2阴性组(19例)与ZEB1/LOXL2阳性组(24例)患者随访结果制成Kaplan-Meier生存曲线,见图1。结果显示,ZEB1/LOXL2阴性组术后生存率为63.16%(12/19),生存时间为(48.37±4.48)个月,ZEB1/LOXL2阳性组患者的生存率16.67%(4/24),生存时间(32.50±2.85)个月,与ZEB1/LOXL2阳性组比较,ZEB1/LOXL2阴性组生存率高、生存时间长(χ2=8.811,P=0.002;t=14.135,P=0.000)。
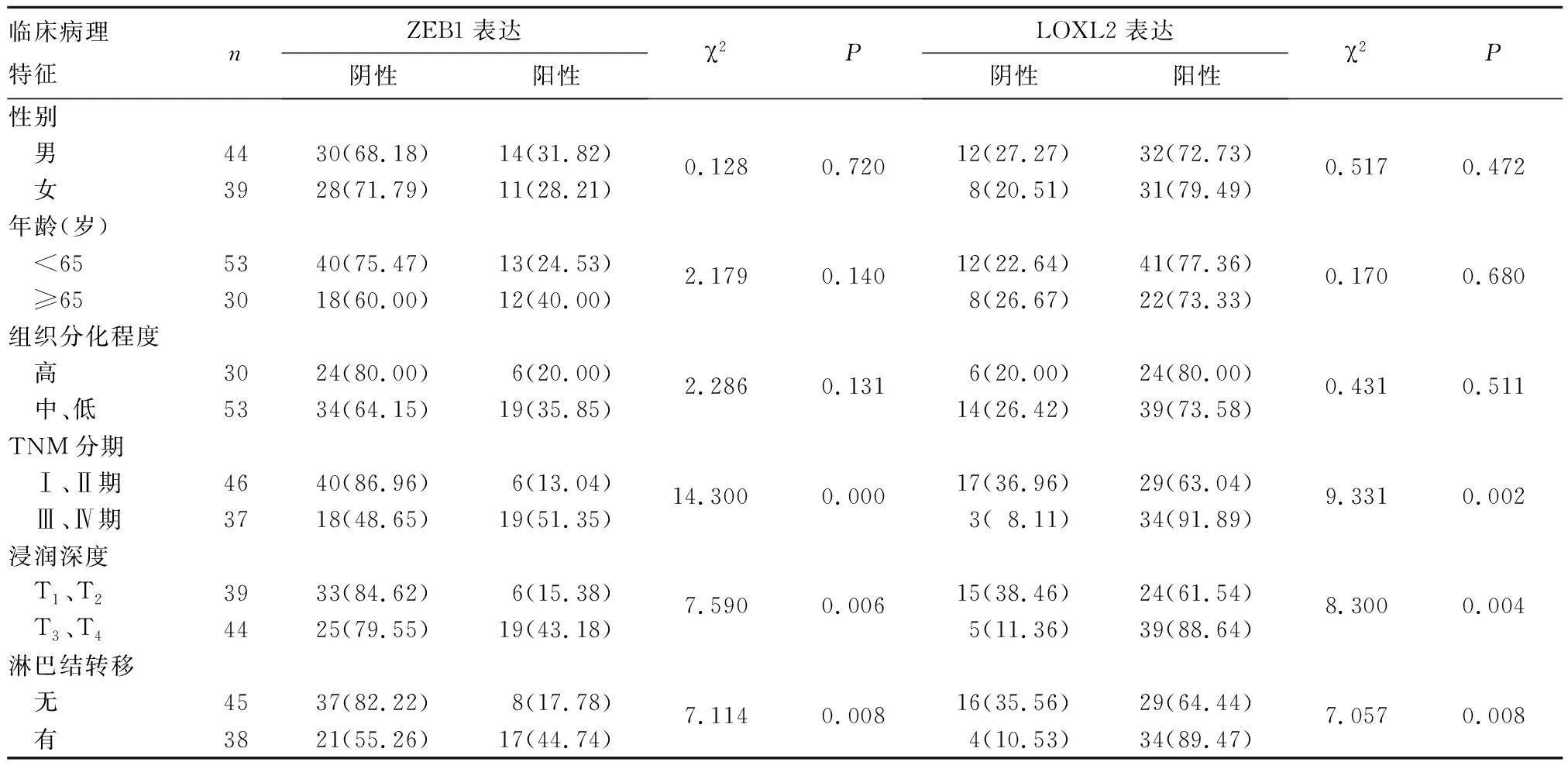
表1 结直肠癌组织中ZEB1、LOXL2表达与患者临床病理特征的关系[例(%)]
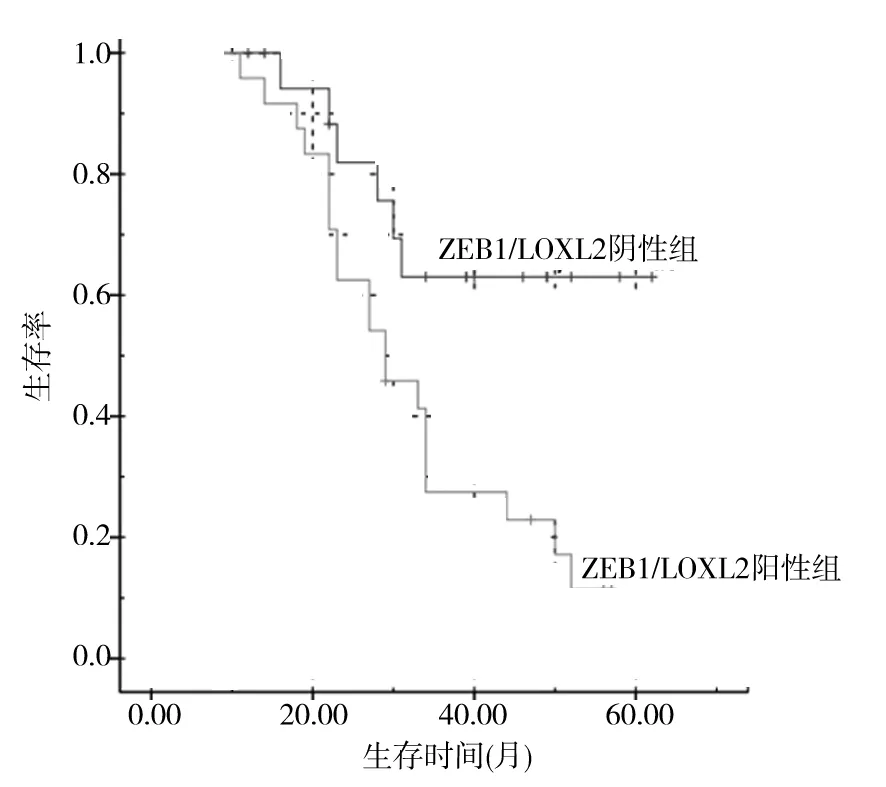
图1 ZEB1/LOXL2阳性与阴性组的生存曲线
3 讨论
近年,我国居民由于饮食传统、构成变化,结直肠癌的发病率不断升高,每年约有30万新发病例[7],发病率高居恶性肿瘤第四位,病死率则为第五位[8]。研究[9,10]发现,相较于原发肿瘤位置,患者临床基础情况、肿瘤的TNM分期、组织分化程度和区域淋巴结转移等因素对患者预后影响更大,其中TNM分期、淋巴结转移与其复发密切相关。因此,对结直肠癌复发转移相关机制的研究是提高结直肠癌临床诊疗水平、改善患者预后的关键因素。
EMT是指上皮细胞在特定因素影响下,细胞极性丢失,胞间连接和黏附连接遭到破坏,从而使上皮细胞转化为具有间质细胞特性的特殊细胞,获得一定的浸润性与游走迁移能力[11]。目前认为,EMT不仅与肿瘤细胞的远处转移有关,也同时影响其原位侵袭[12]。一般认为,EMT以E-钙黏蛋白的丢失为主要标志[13]。ZEB1能够通过抑制E-钙黏蛋白的转录表达,降低肿瘤细胞间的黏附力,从而促进EMT进程[14]。近期一项体外研究[15]显示,siRNA抑制ZEB1表达后,骨肉瘤细胞呈现出凋亡增强、迁移受抑制现象。Hanrahan等[16]关于前列腺癌的研究则显示,ZEB1在前列腺癌中同样能够促进肿瘤细胞的EMT,从而增强肿瘤的侵袭力,促进肿瘤局部浸润与远端转移。在乳腺癌中,ZEB1则通过沉默Ngn3基因,促进乳腺癌的发生与恶性进展[17]。本研究发现,ZEB1在结直肠癌组织中的阳性表达率高于癌旁组织中,且与TNM分期、浸润程度、淋巴结转移等与肿瘤侵袭力相关的临床病理参数相关,因此可知ZEB1在结直肠癌中的作用与其他恶性肿瘤中相似,即能够促进肿瘤原位浸润与远端转移。
本研究选择的另一研究对象LOXL2同样是EMT调节因子之一,能够通过与Snail相互作用促进肿瘤细胞EMT作用[18],同时LOXL2还参与细胞粘连、细胞迁移作用[19]。LOXL2作为分泌型铜依赖氨基酸氧化酶的一种,能够通过催化特定共价蛋白的交联,起到促进细胞外基质中胶原质与弹性纤维的稳定作用,从而影响肿瘤细胞的生存微环境,进而促进细胞的迁移与侵袭[20]。本研究结果表明,LOXL2在结直肠癌组织中的阳性表达率高于癌旁组织,说明LOXL2同样参与结直肠癌的发生。结合患者临床病理参数,LOXL2的阳性表达率与TNM分期、浸润程度、淋巴结转移等相关,表明LOXL2同样能够影响结直肠癌的浸润与转移。
Peng等[21]通过利用miRNA调控基因表达从而发现肺癌组织中ZEB1对LOXL2的表达具有相互促进作用,两者共同作用于肿瘤细胞EMT。本研究中,肺癌组织中ZEB1与LOXL2的表达呈正相关,与此结果可以互相印证,因此ZEB1与LOXL2在结直肠癌组织中具有类似的协同作用。本研究统计随访结果显示,ZEB1与LOXL2表达阳性的患者预后差于表达阴性的患者,表明ZEB1与LOXL2表达阳性预示患者生存率低与生存时间短,提示需要对这类患者加强监护。
综上所述,ZEB1与LOXL2在结直肠癌组织中过表达,且与TNM分期、浸润程度、淋巴结转移密切相关。因此ZEB1与LOXL2可能参与结直肠癌的发生与恶性进展。ZEB1与LOXL2表达阳性提示患者预后较差,需要适当加强监控,合理结合辅助抗肿瘤手段,从而提高患者生存率,延长生存时间。

