黑皮质素受体-4在正常大鼠瘦素诱发交感神经活性和压力感受性反射功能变化中的作用
李宝新,田茜,张云良,常文龙,王翯,李娜,郭淑芹
(1保定市第一中心医院,河北保定071000;2河北医科大学)
近年高血压发病率逐年升高,已成为重大公共卫生问题之一,探究高血压发病机制一直是研究热点[1]。交感神经活性(SNA)的增加是高血压发病的原因之一[2],瘦素(LPN)作为一种调节能量代谢、食欲和生理的神经内分泌因子,可以通过影响交感神经活性、肾素血管紧张素醛固酮系统、压力感受性反射功能等参与高血压发生发展[3]。已有研究报道,LPN和其下游因子α-促黑素细胞刺激素(α-MSH)可以影响食欲中枢,α-MSH结合黑皮质素受体-4(MC4R)后可以抑制进食量[4]。研究发现MC4R能够调节葡萄糖耐量和交感神经活性[5,6],从而增加患高血压的风险,LPN是否可以通过MC4R进而调节交感神经活性尚不清楚。本研究通过对大鼠侧脑室注射LPN,观察SNA变化,并在室旁核(PVN)显微注射MC4R抑制剂SHU9119,探讨其对LPN引起的交感神经活性和压力感受性反射功能变化的影响及MC4R在其中的作用。
1 材料与方法
1.1 材料 选择SD雄性大鼠(购自北京维通利华实验动物技术有限公司,合格证编号:11400700150970)20只,220~250 g,饲养于河北大学医学部实验动物中心SPF级动物室,室内通风良好,室温保持在18~20 ℃。基础饲料喂养,自由饮食饮水。适应性喂养1周后开始实验。Biopac MP100 数据获得和分析系统(美国Biopac Systems公司),α-氯醛糖(美国Sigma公司),异氟醚(美国Sigma公司),LPN(美国R&D Systems公司),SHU9119(英国Tocris Bioscience公司)。
1.2 股动静脉插管及定位 应用5%异氟醚诱导麻醉,氧气吸入后逐渐减为2%异氟醚维持,使用直肠热敏电阻监测,体温保持在(37±1)℃。气管插管保持人工通气,然后股动脉(1支)和股静脉(3支)导管植入用于监测动脉压和药物注射。在下腹部取正中切口,找到腰椎神经,固定神经后以电脑显示出现神经传导信号为准,然后应用立体定位仪定位侧脑室及PVN注射部位,大鼠需稳定60 min以上开始进行实验。
1.3 动物分组及处理 将SD大鼠20只随机分为PVN-aCSF组和PVN-SHU9119组,每组10只。首先进行侧脑室定位:应用立体定位仪定位大鼠头部,使其暴露出扁平的头骨,使用前囟和硬膜的背表面为基准(计为零),坐标如下(毫米前囟):尾1.0 mm,侧1.4 mm,背4.2 mm,玻璃移液管用于侧脑室注射LPN(5 μg/h)。其次进行PVN定位用于注射SHU9119 (0.5 mmol/L)或人工脑脊液(aCSF):使用微量移液管在显微镜下进行PVN药物注射,仍使用前囟和硬膜的背表面为基准(计为零),坐标定位:尾侧1.8~2.0 mm, 外侧0.5 mm,腹侧7.4 mm。aCSF配制:氯化钠、氯化钾2.6 mmol/L,氯化钙1.3 mmol/L,氯化镁0.9 mmol/L,碳酸氢钠20 mmol/L,磷酸氢二钠1.3 mmol/L,葡萄糖2.0 mmol/L,pH为7.4。实验结束后将2.5%阿利新蓝溶解在醋酸钠中注入100 nL,去除脑后发现脑室有染料存在,证实注射部位正确。两组均在手术后稳定1 h,绘制0 h压力感受性反射曲线,然后均在侧脑室注射LPN 1 h,绘制1 h LPN压力感受性反射曲线;大鼠稳定后继续注射LPN的同时分别在双侧PVN显微注射aCSF和MC4R抑制剂SHU9119均60 nL,注射10 min后绘制PVN-aCSF/PVN-SHU9119压力感受性反射曲线。
1.4 数据获得及压力感受性反射曲线生成 基础SNA、平均动脉压(MAP)、心率(HR)应用Biopac MP100 数据获得和分析系统记录,2 000 Hz进行采样。SNA经带通滤过和放大,数据采集后SNA信号整合成1 s内的频数,以%为单位。压力感受性反射曲线是静脉微量注射泵注射硝普钠使血压快速下降至50 mmHg,而后应用盐酸苯肾上腺素使血压缓慢上升,3~5 min升至175 mmHg,观察由血压、HR变化而形成的拟合S曲线。压力感受性反射曲线是应用Boltzmann方程[(P1-P2)/[1+exp(MAP-P3)/P4]+P2]进行绘制。P1是HR或SNA最大值(Max), P2是HR或SNA最小值(Min), P3是MAP在HR或SNA取中值时的血压(BP50), P4是宽度。参数最大值、最小值和中点均在曲线图中标出,压力感受性反射功能变化由SNA压力反射曲线中Max、Min和BP50来反映和表示[7]。
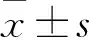
2 结果
2.1 两组不同时间SNA、MAP、HR基础值比较 PVN-aCSF组中,与注射LPN 0 h相比,注射LPN 1 h后和PVN注射aCSF后的SNA、HR值均升高(P均<0.05),且以PVN注射aCSF后的SNA、HR值最高(P均<0.05)。与注射LPN 0 h相比,注射LPN 1 h的MAP差异无统计学意义(P>0.05),但PVN注射aCSF后的MAP升高(P<0.05)。PVN-SHU9119组中,与注射LPN 0 h相比,注射LPN 1 h和PVN注射SHU9119后的SNA均升高(P均<0.05),但PVN注射SHU9119后的SNA低于注射LPN 1 h后的SNA(P<0.05)。与注射LPN 0 h相比,注射LPN 1 h后HR升高(P<0.05),PVN注射SHU9119后的HR差异无统计学意义(P>0.05),且PVN注射SHU9119后的HR低于注射LPN 1 h后的HR(P<0.05)。PVN注射SHU9119后的SNA、MAP及HR均低于同时期PVN-aCSF组的对应值(P均<0.05)。见表1。
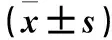
表1 两组不同时间SNA、MAP、HR基础值比较
注:与注射LPN 0 h比较,*P<0.05;与注射LPN 1 h比较,△P<0.05;与PVN-aCSF组比较,#P<0.05。
2.2 两组不同时间交感神经压力反射功能参数Max、Min、BP50比较 PVN-aCSF组中,与注射LPN 0 h相比,注射LPN 1 h后和PVN注射aCSF后的Max、Min均升高(P均<0.05),且以PVN注射aCSF后的Max、Min最高(P均<0.05),PVN注射aCSF后的BP50升高(P<0.05)。PVN-SHU9119组中,与注射LPN 0 h相比,注射LPN 1 h后和PVN注射SHU9119后的Max、Min均升高(P均<0.05),但PVN注射SHU9119后的Max低于注射LPN 1 h后(P<0.05)。PVN注射SHU9119后的Max低于同时间PVN-aCSF组(P<0.05)。见表2。
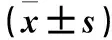
表2 两组不同时间交感神经压力反射功能参数Max、Min、BP50比较
注:与注射LPN 0 h比较,*P<0.05;与注射LPN 1 h比较,△P<0.05;与PVN-aCSF组比较,#P<0.05。
2.3 两组不同时间心率压力反射功能参数Max、Min和BP50比较 PVN-aCSF组中,与注射LPN 0 h相比,注射LPN 1 h后和PVN注射aCSF后的Max、BP50均升高(P<0.05)。与注射LPN 0 h相比,注射LPN 1 h后的Min差异无统计学意义(P>0.05),但PVN注射aCSF后的Min升高(P<0.05)。PVN-SHU9119组中,与注射LPN 0 h相比,注射LPN 1 h后和PVN注射SHU9119后的Max、Min、BP50均升高(P均<0.05),但PVN注射SHU9119后的Max低于注射LPN 1 h后的Max(P<0.05)。PVN注射SHU9119后的Max、Min、BP50值低于同时间PVN-aCSF组(P均<0.05)。见表3。
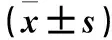
表3 两组不同时期心率压力反射功能参数Max、Min、BP50比较
注:与注射LPN 0 h比较,*P<0.05;与注射LPN 1 h比较,△P<0.05;与PVN-aCSF比较,#P<0.05。
3 讨论
已知高血压常与其他心血管病危险因素共存,可损伤重要脏器,如心、脑、肾的结构和功能,最终导致这些器官的功能衰竭,故了解高血压的发病机制尤为重要。在高血压发生的不同阶段,均发现交感神经系统过度兴奋,且高血压患者的交感神经兴奋程度与血压增加绝对值呈正相关,同时压力反射敏感性明显降低,压力感受器受损,对生理刺激的反应性下降。LPN作为一种由脂肪细胞合成和分泌的蛋白质类激素,是内分泌系统中影响肥胖的一个重要因子。LPN不仅通过中枢系统抑制食欲、增加能量消耗以调节能量平衡,而且能通过各种方式参与高血压、冠状动脉粥样硬化性心脏病等疾病的发生。已有研究表明注射LPN可以使大鼠血压和HR上升,但具体机制不清。有研究表明,LPN可以通过作用于下丘脑,刺激MSH表达,同时上调PVN及孤束核区域的MC4R水平。本研究目的是探讨MC4R是否参与了LPN调控交感神经活性及压力感受性反射功能,并观察其参数的变化趋势。
LPN是由ob基因(位于人染色体7q32)编码的一种由167个氨基酸组成的分泌型蛋白质类激素。Simonds等[8]发现,LPN可以增加啮齿动物和人类的交感神经活动,且仅仅对啮齿动物的血压有长期持续增加的效果,它增加啮齿类动物血压的能力是通过下丘脑和额外的下丘脑区域调节。有研究表明,静脉注射LPN降低了内脏血流量,这有助于其升压作用[9],选择性显微注射LPN到下丘脑细胞核及孤束核后,可明显增加SNA。MC4R属于含7个跨膜区的G蛋白耦联受体,是中枢黑皮素旁路的重要组成部分。MC4R广泛表达于中枢神经系统,位于下丘脑核、PVN、背内侧核及下丘脑后部等,可控制能量平衡、葡萄糖稳态及交感输出。MC4R活化必须与配体相结合,α-MSH是MC4R主要的激活型配体,α-MSH与MC4R结合可以激活MC4R的活性。PVN是中枢神经系统的整合区域,是直接调控交感神经传出活动最主要的中枢位点。LPN调节的可能机制是激活下丘脑弓状核和PVN神经元上的LPN受体,通过中枢神经系统下行通路,从而调节糖代谢及增强SNA等。本研究通过绘制各时间压力感受性反射曲线,观察到PVN-aCSF组中,与0 h LPN相比,注射1 h LPN后和PVN注射aCSF后的SNA、HR均升高,且以PVN注射aCSF后的SNA、HR最高,说明LPN的持续作用增强了SNA,升高HR。在PVN-SHU9119组中,PVN注射SHU9119后的SNA、HR低于注射LPN 1 h后SNA、HR,同时均低于同时期PVN-aCSF组的对应值,说明MC4R可能是LPN激活交感神经系统的介质因子,并且了解到LPN影响SNA可能是通过PVN整合信号。我们发现PVN-SHU9119组中注射SHU9119后的SNA较注射LPN 1 h时降低,但较注射LPN 0 h时仍升高,说明MC4R抑制剂SHU9119可能部分参与了调控LPN影响交感神经的机制中。我们推测PVN-MC4R是LPN增强交感神经活性的一部分途径。
压力感受性反射功能对维持正常交感输出具有关键作用,反射功能低下可导致交感活动反射性抑制功能缺乏,从而导致交感输出的增加,即外周交感神经活动亢进,因此我们推测LPN影响交感神经活动的兴奋,使得压力感受性反射功能异常。本研究对LPN影响交感神经和HR的压力感受性反射功能做了较全面的分析,结果表明在持续侧脑室注射LPN的前提下,PVN注射aCSF后,交感神经和心率压力反射曲线中Max、BP50均升高,交感神经压力反射曲线中PVN注射SHU9119后的Max低于同时间PVN-aCSF组的对应值,而心率压力反射曲线显示PVN注射SHU9119后的Max、Min、BP50均低于同时间PVN-aCSF组,进一步证实MC4R参与了LPN调控压力反射性感受功能。
综上所述,LPN增加SNA、引起压力感受性反射功能变化,可能是由于整合中枢PVN的MC4R部分参与,但是否有其他神经内分泌因子参与其中仍需进一步研究。该研究揭开了LPN及MC4R对大脑交感神经活性及压力感受性反射功能的关系,有助于进一步更好地理解MC4R在中枢神经系统中对高血压、心血管功能的作用机制,并可能对治疗心血管及内分泌疾病提供了新的治疗策略。

