芋头可溶性酚类物质及其与芋头疫病抗性关系
陈竹芳 莫俊杰 胡汉桥 甄珍 蔺中 任磊*

摘 要:广泛存在于植物中的酚类物质具有许多重要功能。本研究收集了不同地区32个芋头(Colocasia Esculenta)品种,鉴定了它们对疫霉菌(Phytophthora colocasiae)的抗性,选取抗感不同的7个芋头品种用高效液相色谱法测定芋头中酚类物质的种类及其含量。结果表明不同芋头品种对疫霉菌的抗性差异显著,大多数品种感病,2个抗病。芋头中含没食子酸和芦丁,不同芋头品种中没食子酸和芦丁含量差异显著。叶片没食子酸的含量在 529.4~1910.8 ng/g;叶片芦丁的含量在12247.7~91189.6ng/g之间。没食子酸和芦丁的含量与芋头的抗病性没有相关性。
关键词:芋头;疫霉菌;高效液相色谱;没食子酸;芦丁
中图分类号:S-3 文献标识码:A DOI:10.11974/nyyjs.20181032002
芋头(Colocasia esculenta(L.)schott),又称芋艿,属南星科多年生草本植物芋的地下块茎,是一些热带或亚热带地区人们的主要食品。芋头的种植量在食根作物中位于马铃薯、木薯、甘薯和山藥之后,位列第五。芋头依食用部位不同,分为叶用变种及球茎变种。栽培的芋头品种主要分为2种类型:魁芋类,2倍体,植株高大,食母芋为主;多子芋类,3倍体,子芋大而多[1]。芋头疫病由芋疫霉菌(Phytophthora colocasiae Racib)侵染所致。疫病是芋头生产过程中的一种主要限制因素,可引起芋头减产25%~30%[2]。
植物酚类化合物是植物次生代谢物的主要类型之一,在植物体内具有重要的作用。植物体内的酚类物质以自由和共价的形式存在,自由的酚类物质称为可溶性酚[3]。已发现芋头中总的可溶性酚类物质的含量与芋头疫病的抗性相关[4]。
本研究收集了不同地区的芋头品种,鉴定了它们对疫霉菌的抗病性,选取疫病抗性不同的芋头品种,用高效液相色谱法测定芋头叶片中酚类物质的种类和含量,探讨它们与芋头抗病的相关性。
1 材料与方法
1.1 材料与试剂
选取广东省、广西省和湖南省芋头32品种进行抗病性鉴定。阿魏酸、白藜芦醇、对香豆酸、绿原酸、芦丁、没食子酸、杨梅素、肉桂酸和鞣花酸均购自Sigma Aldrich 公司。甲醇、乙酸、乙腈购自国药集团化学试剂有限公司(均为色谱纯级)。水为娃哈哈牌纯净水。
1.2 仪器设备
Agilent 1200高效液相色谱仪;真空干燥箱(上海之信仪器有限公司)。
1.3 方法
1.3.1 芋头的疫病抗病性鉴定
芋头疫病抗性参考Brooks [2]的方法进行,稍作改进。培养3~5d的疫霉菌打出直径为0.5cm的菌块。接种于第2或第3最嫩的叶片的背面,用透明胶封住菌块,接种5d后,测定病斑的直径,作为芋头抗疫霉菌的标准。每个材料接种3张叶片。抗病鉴定于2016年在广东海洋大学农学院实验基地进行。
1.3.2 标准储备液
称取色谱纯级别的没食子酸0.05g,置于10mL的容量瓶中,加入甲醇(色谱纯)溶解,定容。浓度为5000mg/L。然后经0.2μm孔径的滤膜过滤后置于4℃冰箱中避光保存,作为贮备液;使用时用甲醇(色谱纯)稀释500倍。终浓度为10μg/mL。阿魏酸、白藜芦醇、对香豆酸、绿原酸、芦丁、杨梅素、肉桂酸和鞣花酸的配制方法同没食子酸,终浓度为100μg/mL。
1.3.3 样品前处理
选芋头最嫩叶片0.5g,加液氮充分研磨,按De Ascensao的方法提取可溶性酚类物质[5]。
1.3.4 色谱条件
色谱柱:Agilent XDB-C 18 柱(4.6mm×150mm,5μm);流动相:乙腈与10%乙酸溶液,梯度洗脱:0 min → 10min→20min→30min → 40min→55min,乙腈35% →40%→ 55% → 80%→0;检测波长:280 nm;流速:1.0 mL/min;柱温:30℃;进样量:10μL。
2 结果与分析
2.1 芋头的疫病抗病性
分离出疫霉菌后,经形态学观察及分子鉴定确定为疫霉菌,以此菌作为接种的病原菌。接种后测定病斑的直径,以其病斑直径的大小作为衡量芋头抗病性的指标。通过方差分析,差异极显著,表明不同芋头品种之间的抗病性存在极显著差异。参考Singh等[6]离体鉴定芋头疫病的抗性指标,将田间芋头抗病性的标准定为:直径小于0.20 cm为抗病,0.21~0.40 cm为中等抗病,大于0.40 cm为感病。不同类型的品种中,魁芋有9个,除3个表现中抗外,其余均感病;而在22个多仔芋中,感病12个,中抗9个,抗病2个。从这里可以看出芋头品种中抗病品种较少,魁芋比多仔芋的抗病性差。选取抗性不同类型的材料用于测定有机酸的含量。
2.2 芋头不同抗性样品有机酸种类的测定
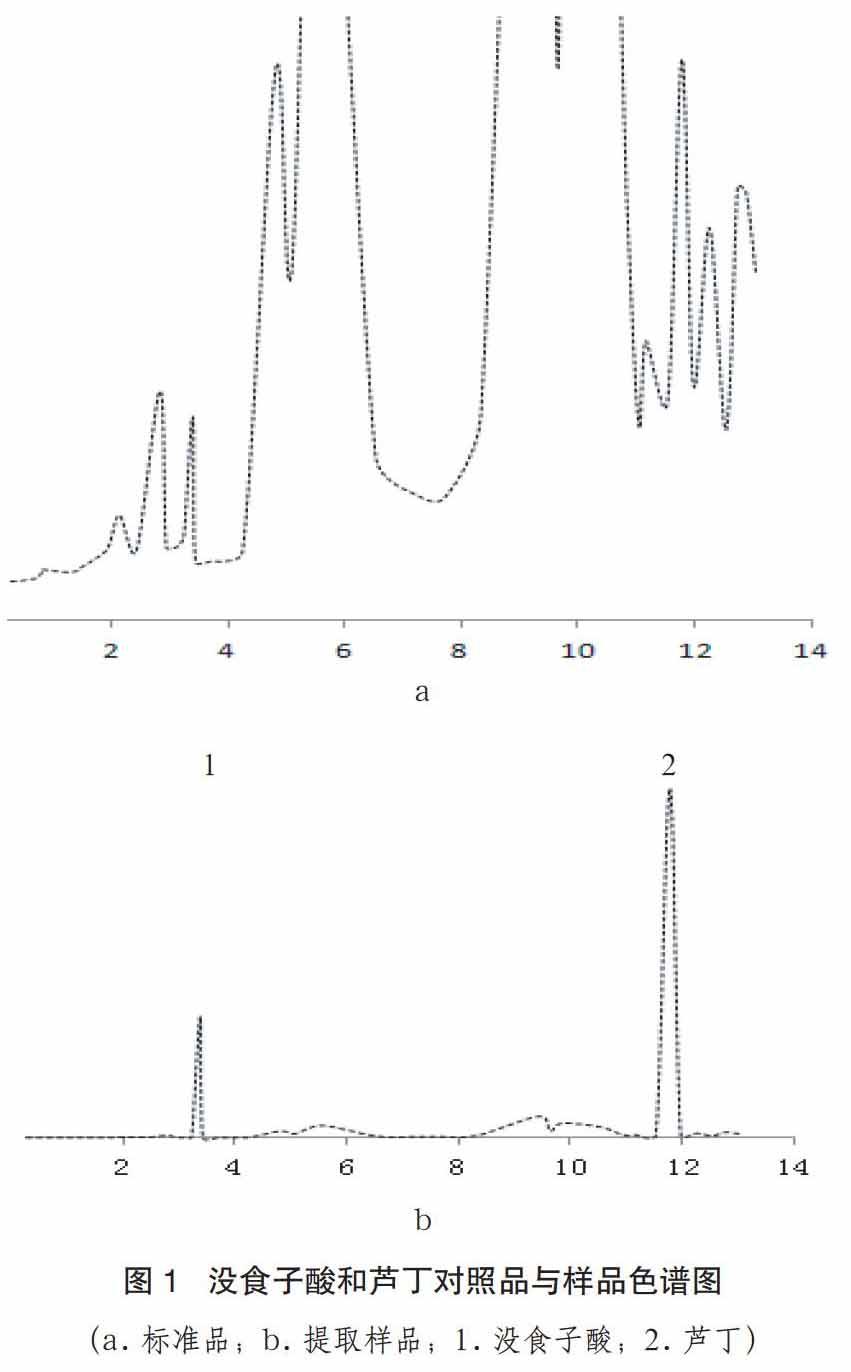
将各标样分别取10μl进样,重复测定3次,测定各自的保留时间。将抗病品种湘潭-1和感病品种湛江-5的有机酸的提取物分别取10μl进样,每个样品重复测定3次。标样中没食子酸的保留时间为3.433±0.00;芦丁标样的保留时间为11.854±0.02。而湘潭-1和湛江-5分别出现了保留时间为3.449±0.04、3.394±0.01和11.909±0.02和 11.935±0.00的峰值,说明芋头中含有没食子酸和芦丁。芋头没有其它种类的酚类物质,结果见图1。
(a.标准品;b.提取样品;1.没食子酸;2.芦丁)
2.3 标准品谱图及标准曲线
分别取没食子酸和芦丁5μl、10μl、15μl、20μl、25μl、30μl、35μl,测定峰面积。对进样量和峰面积进行线性回归,没食子酸的标准曲线为:Y(峰面积)=1509.5X (进样量)+10.7(R2=0.9972);芦丁的标准曲线为:Y=3480.6X-2567.6(R2=0.9992)。没食子酸和芦丁的进样量与峰面积相关极显著。
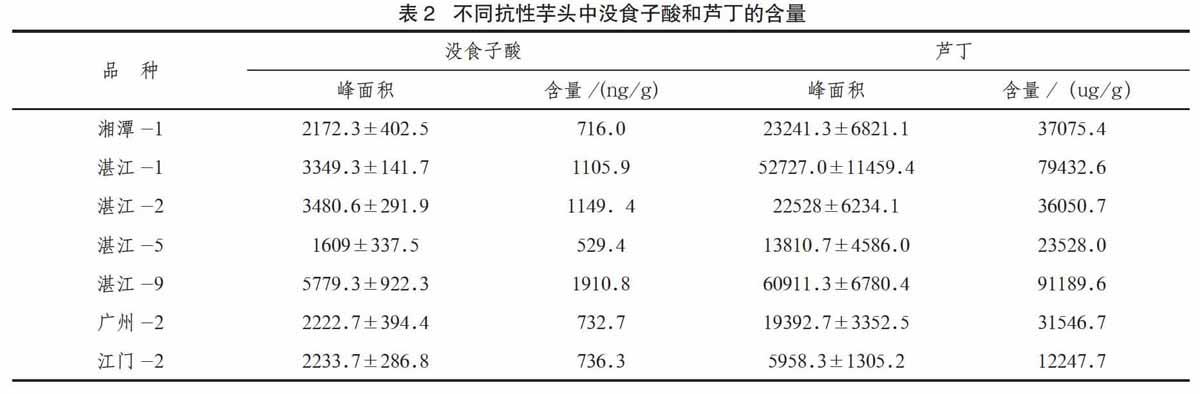
2.4 芋头没食子酸含量的测定
测定得到各样品中没食子酸和芦丁的峰面积值,经方差分析,差异均极显著,不同芋头品种中没食子酸和芦丁的含量差异明显。计算芋头中没食子酸和芦丁的含量,结果见表2。芋头中芦丁的含量比没食子酸高,每克鲜重叶片芦丁的含量在12247.7~91189.6 ng/g之间。则每克鲜重叶片没食子酸的含量在 529.4~1910.8 ng/g。
分析没食子酸和芦丁的含量与芋头抗病性(病斑面积)的相关性,发现它们没有相关性。说明没食子酸和芦丁含量高并不能提高芋頭的抗病性。
3 讨论
芋头是一种重要的作物。收集芋头品种并确定其的疫霉菌的抗性对该病的防治具有一定的意义。芋头抗疫霉菌的品种较少,本文所筛选的抗病品种将为提高芋头的抗病性提供抗病材料。酚类物质广泛存在于植物中并且具有多种重要的功能,特别是在抗病方面具有重要的作用[3]。在橡树有人认为4种酚类物质可作为由疫霉菌引起的橡树抗猝死病抗性的生化指标[7]。在芋头中总的可溶性酚类物质的含量与芋头的抗病性相关[4]。然而植物酚类化合物是由多种物质组成的,主要由类黄酮、酚酸和单宁等3类物质构成。确定它们的组成成份,并确定它们在抗病中作用,将有助于理解植物的抗病机理。目前有关芋头酚类物质的种类及其作用还未见报道。高效液相色谱是检测酚类物质的有效方法。有人用液相色谱分析了水稻茎杆和谷壳中酚类物质的种类,发现没食子酸和芦丁是其主要的2种酚类物质[8]。本文用9种酚类物质标样,用高效液相色谱法确定了抗性不同类型的芋头品种中含有没食子酸和芦丁2种酚类物质。
芦丁作为一种黄酮类化合物,黄酮类化合物多数具有抗菌作用,对细菌具有广泛的抑制活性,能够保护植物免受病原微生物侵害[9]。在几种旱生植物中,总酚和类黄酮的含量与抗真菌的活性存在很强的正相关性[10]。没食子酸是酚酸的一种,目前已发现没食子酸能有效地抑制真菌的繁殖[11]。本文研究发现芋头中没食子酸和芦丁的含量与疫病的抗性没有相关性,其原因可能是:酚类物质是多种物质的混合物,它们共同作用能抑制病原的生长,但单独一种或几种对病原物的生长影响不大;酚类物质通常与糖或有机酸结合形成可溶的共轭物,或者与细胞壁结合形成木质素。还有部分没食子酸和芦丁共价接合,没能测定出来[3]。
参考文献
[1] Irwin SV, Kaufusi P, Banks K, de la Pe?a R, Cho JJ. Molecular characterization of taro (Colocasia esculenta) using RAPD markers[J]. Euphytica, 1998, 99(3):183-189.
[2] Brooks FE. Detached-leaf bioassay for evaluating taro resistance to Phytophthora colocasiae [J]. Plant Disease,2008,92(1):126-131.
[3] Lattanzio V, Lattanzio VMT, Cardinali A. Role of phenolics in the resistance mechanisms of plants against fungal pathogens and insects. In: Phytochemistry: Advances in Research (M). (Imperato, F., Ed.). Kerala, India: Research Signpost.2006,p23–67.
[4] Mo JJ, Liang JX, Liu CL, Lv SL, Huang H, Wu RF, Hu HQ. Correlative evidence for involvement of phenolics compounds and peroxidase in resistance against Phytophthora colocasiae leaf blight in Colocasia esculenta[J]. Journal of Horticultural Science & Biotechnology,2015,90(4):433–438.
[5] De Ascensao AR, Dubery IA. Panama disease:cell-wall reinforcement in banana roots in response to elicitors from Fusarium oxysporum f. sp. cubense race four[J]. Phytopathology, 2000,90(10):1173–1180.
[6] Singh D, Mace ES, Godwin ID, Mathur PN, Okpul T, Taylor M, Hunter D, Kambuou R, Ramanatha Rao V, Jackson G. Assessment and rationalization of genetic diversity of Papua New Guinea taro (Colocasia esculenta) using SSR DNA fingerprinting[J]. Genetic Resources and Crop Evolution, 2008,55(6):811-822.
[7] Conrad AO, McPherson BA, Wood DL, Madden LV, Bonello P. Constitutive phenolic biomarkers identify na?ve Quercus agrifolia resistant to Phytophthora ramorum, the causal agent of sudden oak death[J]. Tree Physiology,2017,37(12):1686-1696.
[8] Karimi E, Mehrabanjoubani P, Keshavarzian M, Oskoueian E, Jaafar HZ, Abdolzadeh A. Identification and quantification of phenolic and flavonoid components in straw and seed husk of some rice varieties (Oryza sativa L.) and their antioxidant properties[J].Journal of the Science of Food and Agriculture,2014,94(11): 2324-2330.
[9] Hu W, Pan X, Li F, Dong W. UPLC-QTOF-MS metabolomics analysis revealed the contributions of metabolites to the pathogenesis of Rhizoctonia solani strain AG-1-IA[J]. PLoS One, 2018,13(2): e0192486.
[10] Mohamed MSM Saleh AM, Abdel-Farid IB,El-Naggar SA. Growth, hydrolases and ultrastructure of Fusarium oxysporum as affected by phenolic rich extracts from several xerophytic plants[J]. Pesticide Biochemistry and Physiology,2017,141(9):57-64.
[11] 王艷娜.鸭梨果实轮纹病寄主一病原菌互作机理[D].北京:中国林业科学研究院,2007.

