QuEChERS-GCMS/MS法检测马铃薯中30种农药
汤乐金 陈孟君 黄子敬 杨钦沾 林玉婵 吴燕梅
摘 要:建立QuEChERS作为样品前处理结合气相色谱-串联质谱(GC-MS/MS)作为仪器检测,对马铃薯中30种农药多残留进行检测的方法。马铃薯样品用乙腈溶液萃取,涡旋震荡,摇床提取,加入氯化钠和无水硫酸镁,离心,上清液通过固相分散萃取商业包净化,过滤膜,然后用GC-MS/MS分析。分别以定量限和(10/3)倍定量限浓度值对马铃薯空白样品进行添加回收实验,方法的回收率75.6%~112.9%,相对标准偏差为1.5%~17.2%。方法的检出限和定量限分别为0.0025~0.0150mg/kg、0.0083~0.0500mg/kg。此方法和GC-MS相比,在对农药组分定性方面更为准确,同时前处理快速简单、分析时间少,准确度和精密度符合标准要求,灵敏度响应较好,适用于马铃薯多农残的定性定量检验检测分析。
关键词:马铃薯;QuEChERS; GC-MS/MS;农药多残留
中图分类号:S-3 文献标识码:A DOI:10.11974/nyyjs.20181032001
随着人民生活水平不断提高,社会对食品质量安全越来越重视。纵观近年来,因农药残留造成食品安全事件时有发生,对人民群众健康对社会稳定都造成了不利影响。食品质量安全提高对“健康中国”有着重要的意义,时代发展对食品安全检测灵敏度和检测覆盖面要求越来越高[1]。农药残留检测技术也在飞速发展。为适应大批量样品处理,农药残留分析前处理日趋简单化、流程化和节约化[2],多种前处理方法,如:基质固相分散萃取、固相微萃取(SPME)、分散液液微萃取(LLME)等在农药多残留分析领域得到广泛应用[3]。由美国农业部开发的QuEChERS[4]方法,自建立以来就因其快速、简单、低成本等优点得到广泛应用,并在实践过程中不断改进,成为实验室普遍采用的农药多残留分析前处理方式[5]。
本实验前处理方法采用QuEChERS方法,乙腈作为提取剂,结合净化管,大大缩短了前处理时间,通过采用基质溶液配制标准工作液减少基质效应带来的干扰,提高了净化效率,在仪器分析阶段使用三重串联四级杆质谱仪(GC-MS/MS)进行分析,相比单极气相色谱质谱仪(GC-MS),定性更加准确,灵敏度响应好,满足当前农药多残留一次多组分定性定量的技术要求。
1 实验部分
1.1 仪器与材料
气相色谱-串联质谱GCMS-TQ8040,日本SHIMADZU公司;气相毛细管色谱柱为Rxi-5sil MS,30m×0.25mm×0.25μm膜厚,美国RESTEK公司;Milli-QR Advantage A10纯水发生器,美国Millipore公司;IKAR MS 3 digitalR;TGL-16M高速台式冷冻离心机;HS 260 CTRL 摇床。
所用农药标准物质(纯度≥95%),全部购自农业部环境保护科研监测所和农业部环境质量安全监督测试中心;乙腈、正己烷、丙酮等均为色谱纯,购自默克公司;实验室用水为一级水;固相分散萃取净化管(50.0mgPSA,50.0mgC18,150.0mg硫酸镁),购自美国Agilent公司;无水硫酸镁,购自Sigma,在600℃灼燒4h,冷却后置于干燥器中备用。
1.2 气相色谱-质谱测定
1.2.1 气相色谱条件
载气:氦气,纯度≥99.999%;进样方式:分流进样;分流比:20;总流量:26.0mL/min,其中柱流量为1.00mL/min,吹扫流量为5.0mL/min;进样口温度程序:初始温度65℃,保持1min,后以200℃/min程序升温至250℃,保持15min;柱温程序:初始温度40℃,保持4min,后以25℃/min程序升温至125℃,再以10℃/min升温至300℃,保持10min;流量控制方式:恒线速度。
1.2.2 质谱条件
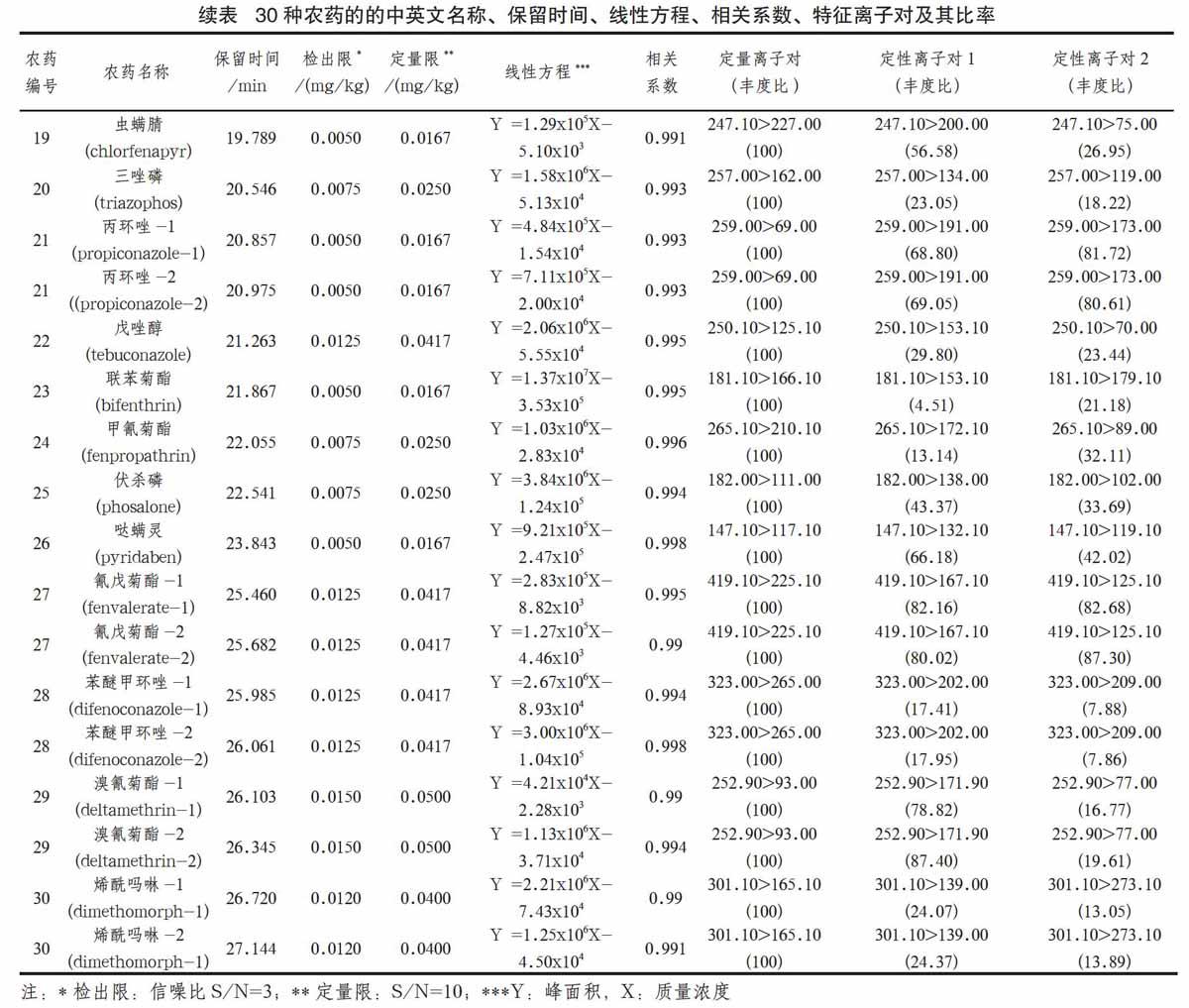
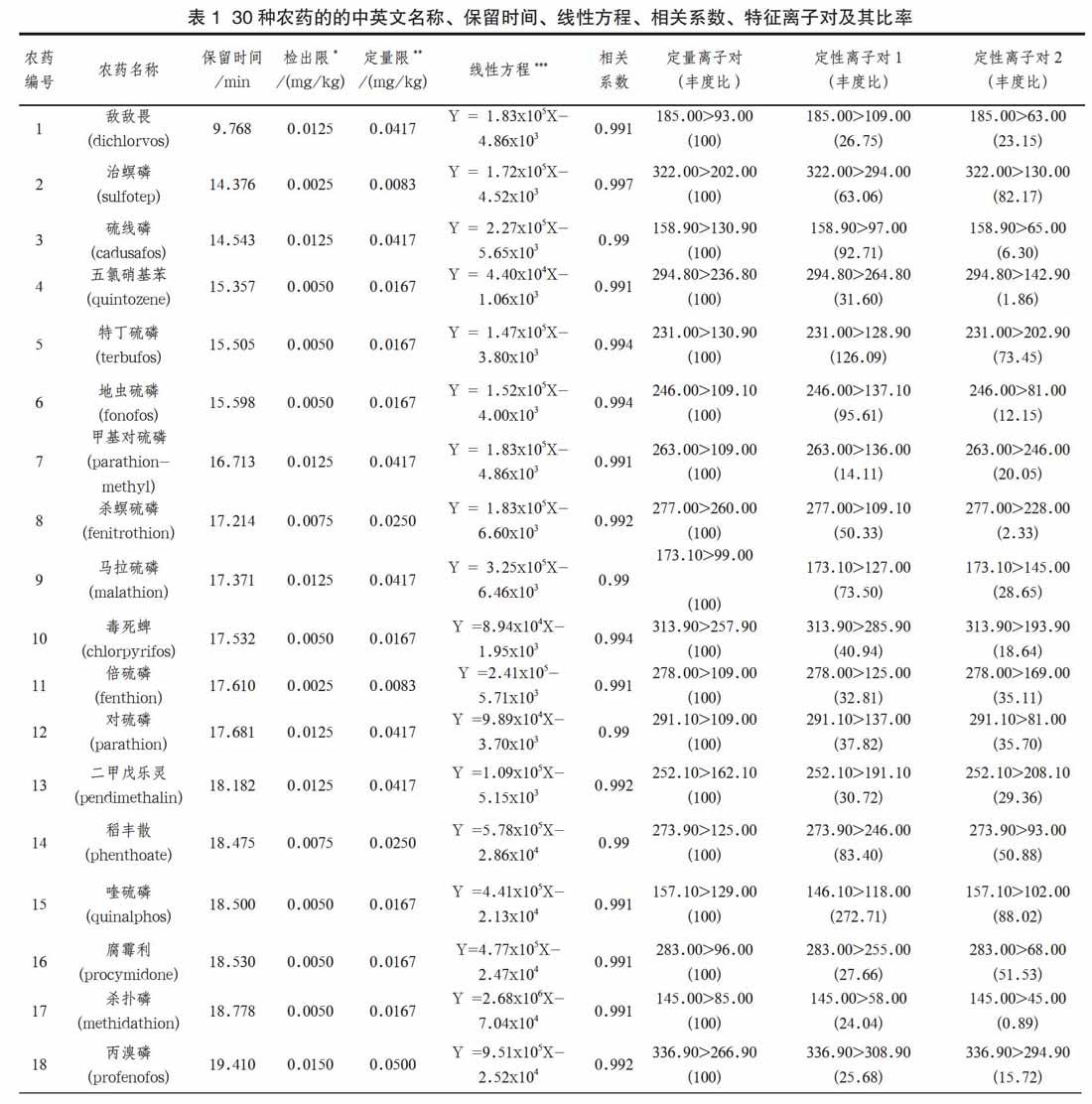
色谱-质谱接口温度:300℃;离子源温度230℃;离子化方式:电子轰击(EI);电子能量:70eV;质谱检测方式:多反应监测模式(MRM)。基于岛津数据库,为30种农药自动计算保留时间,给出最优离子对(包括一个定量离子对,两个定性离子对)。30种农药的保留时间、定量离子对和定性离子对及其丰度比等见表1。
1.3 标准溶液的配制
根据各农药组分保留时间以及其仪器响应灵敏度,确定各组分浓度,取适应量单标准储备液于100mL容量瓶中,用乙腈定容至刻度。混合标准溶液在冰箱中0~4℃避光保存,有效期1个月。
一般将基质效应绝对值处于0%~20%作为弱基质效应、20%~50%为中等基质效应、大于50%为强基质效应[6]。为消除基质效应[7]带来的影响,将上述混合标准溶液用基质溶液配制成系列标准溶液,分别为0.005mg/L、0.01mg/L、0.05mg/L、0.1mg/L、0.5mg/L。按1.2所述条件进行GC-MS/MS测定, 30种农药及相关化合物的保留时间、特征定量定性离子对等信息见表1。
1.4 样品前处理
准确称取10g样品(精确至0.01g)于50mL带盖塑料离心管中,加入10mL乙腈溶液。在涡轮振荡器上涡旋2min,在摇床上震荡提取30min,加入4g氯化钠,4g无水硫酸镁,剧烈震摇1min,涡旋1min,在离心机中以4000r/min离心5min,取上清液2mL加入到固相分散萃取净化管中,涡旋混合1min,离心机4000r/min离心2min,取上清液过0.22μm微孔滤膜。上机,用气相色谱质谱联用仪测定,外标法定量。
2 结果与讨论
最初的QuEChERS方法处理过程为:称取10g样品,加入10mL乙腈震荡提取,然后加入1g氯化钠和4g硫酸镁进行盐析分层,取1mL上清液,加入150mg硫酸镁和25mgPSA进行净化,净化后的上清液直接上机分析[8]。本实验通过对提取剂种类、吸附剂种类、上机定容溶液等条件进行实验优化,通过设计L9(34)正交试验方案,确定了适用于此次实验的QuEChERS的前处理方法。
2.1 提取剂的选择
提取剂分别选择乙腈、丙酮、1%醋酸乙腈。通过正交实验,结果表明:乙腈提取效果最好,农药回收率高,基质带来的干扰较少;丙酮容易提取到色素,提取较多杂质,基质干扰较多,影响后续的净化步骤;醋酸乙腈提取效果较好,基质干扰也较少,农药回收率不及乙腈提取剂。综合考虑,选择乙腈作为提取剂。
2.2 吸附剂的选择
常用的吸附剂有PSA、NH2、C18、GCB。其中,PSA和NH2去除极性的有机酸、一些糖类和脂类,C18去除非极性物质如类胡萝卜素,GCB去除色素。本实验试验了C18、GCB混合粉末和PSA、C18、GCB混合粉末以及NH2、C18、GCB混合粉末3種吸附净化方法。结果表明,使用PSA和NH2的混合粉末净化效果优于C18、GCB混合粉末。由于PSA有2个氨基PKa值分别为10.1和10.9而具有更强的离子交换能力,也就是PSA具有更高的净化能力[9]。由于GCB对平面结构农药有吸附作用。同时考虑到进一步除水的需要,本实验选择PSA(50mg)、C18(50mg)、GCB(7.5mg)、MgSO4150(mg)SPE净化管作为吸附剂。
2.3 上机定容溶液的选择
比较乙腈、甲醇、正己烷分别作为定容溶液对农药回收率和重复6次进样重复性的影响。实验结果表明,乙腈和正己烷作为定容溶液时农药回收率和重复性优于甲醇作为定容溶液。乙腈作为定容溶液重复性和正己烷作为定容溶液重复性相当,乙腈作为定容溶液回收率高于正己烷,由于PTV进样口允许乙腈直接进样,因此本次实验选择乙腈作为定容溶液,上机测定。
2.4 检出限、定量限和回收率
分别选择定量限和4倍定量限浓度值做加标回收试验。马铃薯添加农药混合标准溶液后,静置30min,让农药被充分吸收,然后按照前面实验部分所述的前处理方法和实验条件进行测定。实验通过2个浓度水平,且每个水平重复进行6次实验, 30种农药的低水平也即定量限浓度加标回收率为75.6%~112.9%,相对标准偏差为1.5%~15.4%;高水平加标回收也即4倍定量限浓度加标回收率为79.2%~97.1%,相对标准偏差为3.2%~17.2%。此次实验以信噪比S/N=3确定方法的检出限,范围为0.0025~0.0150mg/kg;S/N=(10/3)确定方法的定量限,范围为0.0083~0.0500mg/kg。方法的检出限和定量限列于表1。从表中可以看出此次实验方法检出限和定量限能很好地满足国家对马铃薯上述30种农药多残留检测的要求。
3 结论
本实验通过乙腈提取、采用固相分散萃取净化管净化来改善QuEChERS前处理方法,仪器使用气相色谱-串联质谱仪GCMS-TQ8040检测,建立了马铃薯中30种农药残留的气相色谱-串联质谱(GC-MS/MS)检测方法,方法快速、简单,提取时间效率高、溶剂使用少、萃取效率高。相比较气相色谱单极质谱仪该,提高了定性的准确定,同时改善了灵敏度,满足标准方法对准确度和精密度的要求,可用于马铃薯中农药多残留的测定。
参考文献
[1] 王冬玲.我国食品检测的现状及发展趋势[J].食品安全导刊,2017(15):67.
[2] 张驰,宋莹,潘家荣,等.气相色谱-质谱大体积进样法测定果汁中90种农药残留[J]. 分析化学,2015(08):1154–1161.
[3] 段劲生,王梅,董旭,等.基质固相分散萃取-超高效液相色谱-串联质谱法快速测定蔬菜中的农药多残留[J].农药,2015,54(04):292-295.
[4] Min Wu,Jiye Hu. Residue analysis of fosthiazate in cucumber and soil by QuEChERS and GC-MS[J]. Chemical Papers,2014,68(10):1368-1374.
[5] 葛谦,马芸,苟春林,等.QuEChERS结合HPLC-MS/MS法测定小麦和土壤中吡蚜酮的残留量[J].农药,2016, 55(07):520-523.
[6]李岩.气相色谱-质谱法筛查测定浓缩果蔬汁中73种农药残留[J].食品与发酵工业, 2016(07): 217–222.
[7] 于建华.色谱法测定多种农药残留的基质效应研究进展[J]. 广东化工, 2017(03): 101–104,100.
[8] 白小军,吴燕,牛艳,等. 玉米中乙草胺和莠去津残留量GC-MS/MS分析法的建立[J]. 江苏农业科学,2014,42(11):
334-336.
[9] 徐宜宏,蒋施,付海滨,等.苹果、番茄、玉米中7种植物生长调节剂的气相色谱-串联质谱检测方法[J].农药,2014,
53(02):113-115.

