二甲双胍联合胰岛素泵治疗妊娠期糖尿病及对血清YKL-40、Irisin水平的影响*
宋鸿碧,徐飏,曹婷,王颖,杨晓武
(贵州省人民医院 产科,贵州 贵阳 550002)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指孕前无糖尿病,在妊娠过程中发生糖耐量异常的合并性疾病,容易导致胎儿胰岛细胞或神经发育受损[1]。GDM首选疗法为饮食运动疗法,疗效不佳者应给予药物治疗[2]。胰岛素是治疗GDM的首选药物,近年来,口服降糖药二甲双胍逐渐用于GDM治疗中。二甲双胍对胎儿影响小、无致畸作用、安全、有效[3],76.6%的GDM患者患者会选择接受二甲双胍治疗[4],然而,单独的口服降糖药控制血糖,效果不显著。据报道[5-6],二甲双胍与胰岛素联用能更高效地控制血糖,促进新生儿神经系统发育,改善妊娠结局。胰岛素常规给药方式为皮下注射,但胰岛素泵皮下注射起效更快、控制血糖效果更为平稳,因此,本研究拟采用二甲双胍联合胰岛素泵皮下注射治疗GDM,以提高疗效。炎症因子如人软骨糖蛋白-39(YKL-40)[7]、肿瘤坏死因子α等促进GDM炎症反应,介导胰岛素抵抗,鸢尾素(Irisin)能够通过促胰岛β细胞增殖激素Betatrophin的表达来调节胰岛β细胞的功能[8],二者均与糖尿病进展相关。本研究观察二甲双胍联合胰岛素泵皮下注射对GDM患者血清YKL-40及Irisin水平的影响,为两者联用提供理论依据。
1 资料与方法
1.1 一般资料
选取2015年7月—2017年1月贵州省人民医院收治的140例GDM患者。年龄24~31岁,平均(27.6±1.0)岁;发病孕周22~29周,平均(25.4±1.1)周。依照随机数字表法分为观察组和对照组,每组70例。两组患者一般资料比较差异无统计学意义(P>0.05)(见表1)。本研究获贵州省人民医院医学伦理委员会批准。纳入标准:①符合《妇产科学》(第8版)[9]中GDM诊断标准;②所有患者经饮食运动控制血糖均难以达标;③单胎妊娠;④所有患者均自愿参与本研究,并签署之情同意书。排除标准:①肝肾功能不全者;②药物过敏者;③白细胞减少者;④合并高血压;⑤合并肝、心、肺部疾病者;⑥未进行正规孕检和产检。
表1 两组患者基本资料比较(n =70,±s)
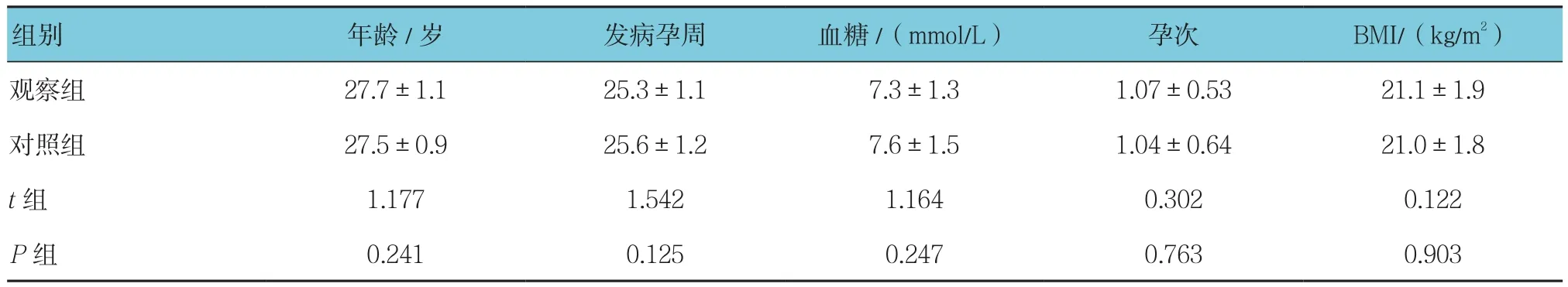
表1 两组患者基本资料比较(n =70,±s)
组别 年龄/岁 发病孕周 血糖/(mmol/L) 孕次 BMI/(kg/m2)观察组 27.7±1.1 25.3±1.1 7.3±1.3 1.07±0.53 21.1±1.9对照组 27.5±0.9 25.6±1.2 7.6±1.5 1.04±0.64 21.0±1.8 t组 1.177 1.542 1.164 0.302 0.122 P组 0.241 0.125 0.247 0.763 0.903
1.2 方法
1.2.1 治疗方案 两组患者服药时间在妊娠(27.1±0.36)周。观察组采用二甲双胍联合胰岛素泵皮下注射治疗:依据患者病情计算每日胰岛素总量,然后将相应剂量的胰岛素(门冬胰岛素30注射液,批号:CVG0330,规格:100 u/ml,诺和诺德制药有限公司)装入韩国丹纳胰岛素泵中,针头埋入皮下,固定,确保胰岛素能够顺利输出;同时晚餐之后口服二甲双胍缓释片(批号:140312,规格:0.5 g,成都恒瑞制药有限公司)1次,1片/次。对照组采用二甲双胍联合胰岛素皮下注射治疗:餐前5 min皮下注射胰岛素4~6 u,过程中严密监测血糖水平,每3天调整1次用量,每次增加或减少2~4 u,每天总量变化不得超过6 u;同时晚餐之后口服二甲双胍缓释片1次,1片/次,共0.5 g。两组患者均治疗12周。所有孕妇服药期间均进行饮食控制和运动指导:少食多餐,每日进食为5或6餐,多食用高纤维食物,尽量减少淀粉类、高脂肪、高蛋白食物的摄入,不食用生冷、坚硬、辛辣刺激性食物;每日晚餐后1 h开始运动,每次45 min,每周3~4次,运动方式为上下楼梯、做操、散步或慢跑,以微微出汗、睡眠及食欲良好、略微疲乏、不引起宫缩最为适宜。
1.2.2 观察指标 ①疗效评估:治疗结束后参照文献[10]疗效评估标准评估治疗效果,分为显效:症状显著减轻,空腹血糖(fasting plasma glucose, FPG)降低至7.0 mmol/L以下或降低30%以上;有效:症状减轻,FBG降低至8.5 mmol/L以下或降低10%~30%以上;无效:症状无减轻,FBG无改变或下降低于10%。计算总有效率=显效率+有效率。②血糖相关指标:记录患者血糖达标时间和胰岛素用量,治疗前后测定血清糖化血红蛋白(glycosylated hemoglobin lc, HbAlc)、FPG、 餐 后 2 h血 糖(postprandial 2 hour plasma glucose, 2 h PG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(1ow density lipoprotein cholesterol,LDL-C)和三酰甘油(triaeylglyeerol, TG)水平,其中,FPG采用葡萄糖氧化酶法测定空腹血糖(FPG),其余项采用贝格曼LX-20全自动生化仪测定。③血清YKL-40、Irisin水平:治疗前后测定血清YKL-40、Irisin水平,两者均采用酶联免疫吸附试验(ELISA)测定,YKL-40试剂盒购自(美国)Biotek公司,Irisin试剂盒购自(美国)Phoenix Pharmaceutical,Inc公司,具体参照说明书操作步骤进行。④记录母婴结局。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,等级资料采用秩和检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗效果比较
观察组治疗效果显效40例,有效27例,无效3例;对照组治疗效果显效28例,有效30例,无效12例。观察组治疗总有效率与对照组比较,差异有统计学意义(χ2=6.048,P =0.014),观察组95.7%(67/70)高于对照组82.9%(58/70)。
2.2 两组患者血糖相关指标比较
观察组血糖达标时间为(7.2±2.1)d,胰岛素用量为(10.5±3.6)u/d;对照组血糖达标时间为(11.7±2.7)d,胰岛素用量为(30.1±3.3)u/d。组间比较差异均有统计学意义(t=11.007和33.578,均P=0.000)。
两组患者治疗前血清TC、TG、LDL-C、FPG、2 h FPG和HbAlc差异无统计学意义(P>0.05);治疗后差异有统计学意义(P<0.05),均降低;观察组治疗后各指标与对照组比较,差异均有统计学意义(P<0.05),观察组低于对照组。见表2、3。
2.3 两组患者血清YKL-40、Irisin水平变化比较
两组患者治疗前血清YKL-40水平比较差异无统计学意义(P>0.05)。两组患者治疗前血清Irisin水平比较差异无统计学意义(P>0.05)。治疗后两组YKL-40水平降低,Irisin水平升高,差异均有统计学意义(P<0.05)。两组治疗后血清YKL-40、Irisin水平比较差异有统计学意义(P<0.05)。见表4。
2.4 两组母婴结局比较
观察组和对照组产妇妊娠结局异常率分别为2.9%和14.3%,差异有统计学意义(P<0.05)。新生儿异常结局发生率分别为8.6%和22.9%,组间比较差异有统计学意义(P<0.05)。见表5。
表2 两组患者血糖相关指标比较(n =70,mmol/L,±s)
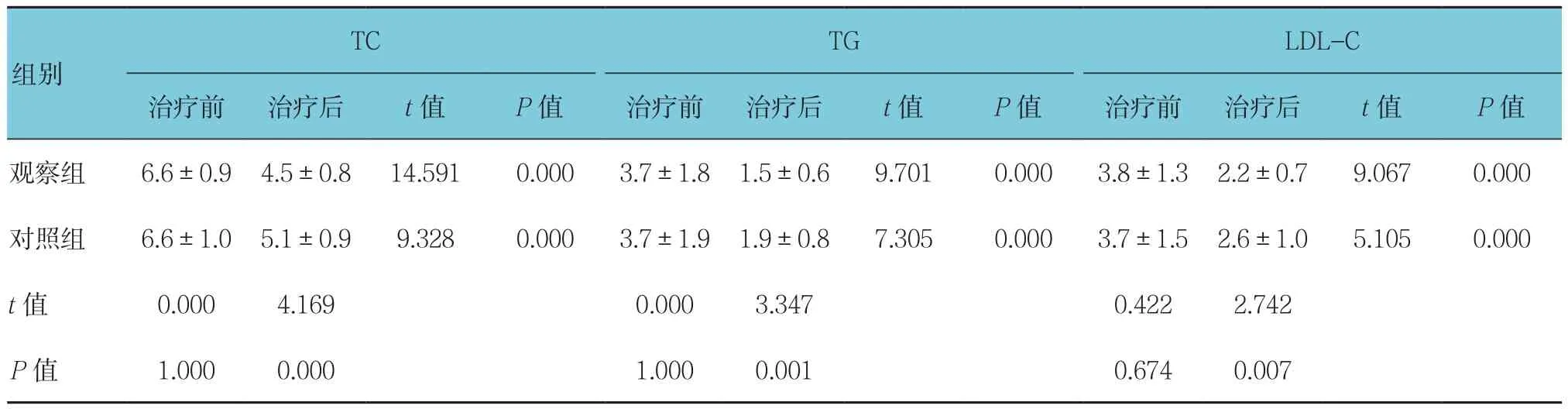
表2 两组患者血糖相关指标比较(n =70,mmol/L,±s)
TC TG LDL-C治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值观察组 6.6±0.9 4.5±0.8 14.591 0.000 3.7±1.8 1.5±0.6 9.701 0.000 3.8±1.3 2.2±0.7 9.067 0.000对照组 6.6±1.0 5.1±0.9 9.328 0.000 3.7±1.9 1.9±0.8 7.305 0.000 3.7±1.5 2.6±1.0 5.105 0.000 t值 0.000 4.169 0.000 3.347 0.422 2.742 P值 1.000 0.000 1.000 0.001 0.674 0.007组别
表3 两组患者血糖相关指标比较(n =70,±s)
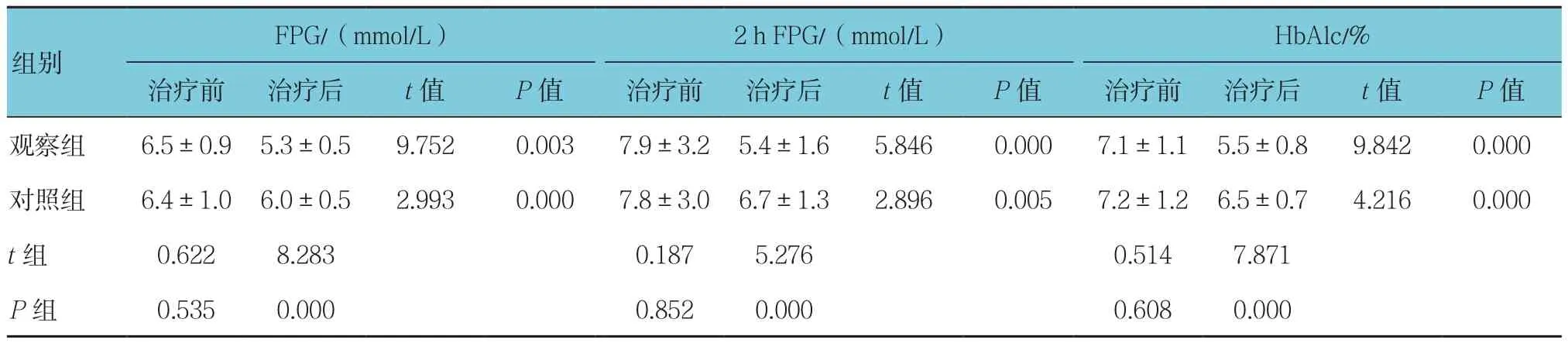
表3 两组患者血糖相关指标比较(n =70,±s)
FPG/(mmol/L) 2 h FPG/(mmol/L) HbAlc/%治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值观察组 6.5±0.9 5.3±0.5 9.752 0.003 7.9±3.2 5.4±1.6 5.846 0.000 7.1±1.1 5.5±0.8 9.842 0.000对照组 6.4±1.0 6.0±0.5 2.993 0.000 7.8±3.0 6.7±1.3 2.896 0.005 7.2±1.2 6.5±0.7 4.216 0.000 t组 0.622 8.283 0.187 5.276 0.514 7.871 P组 0.535 0.000 0.852 0.000 0.608 0.000组别
表4 两组患者血清YKL-40、Irisin水平变化比较(n =70,±s)
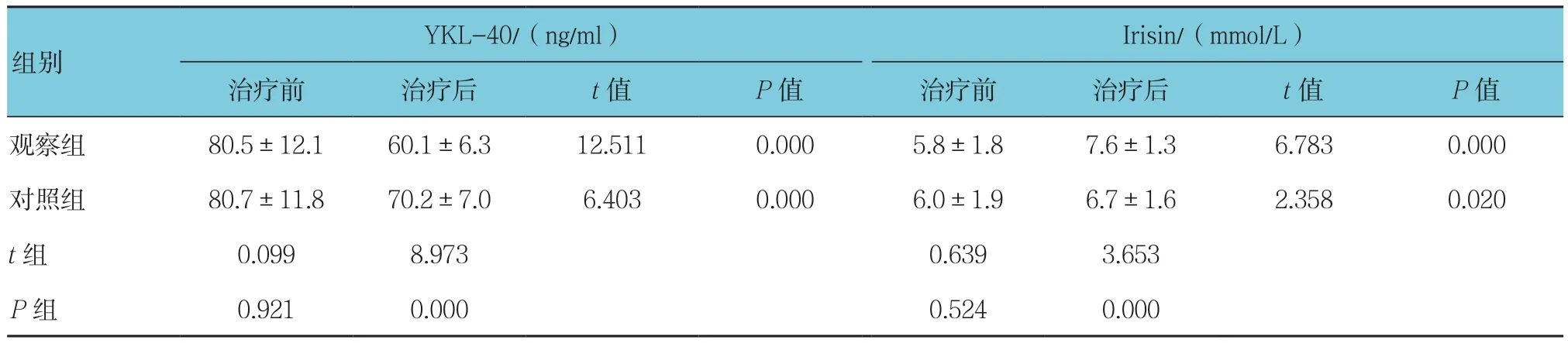
表4 两组患者血清YKL-40、Irisin水平变化比较(n =70,±s)
Irisin/(mmol/L)治疗前 治疗后 t值 P值 治疗前 治疗后 t值 P值观察组 80.5±12.1 60.1±6.3 12.511 0.000 5.8±1.8 7.6±1.3 6.783 0.000对照组 80.7±11.8 70.2±7.0 6.403 0.000 6.0±1.9 6.7±1.6 2.358 0.020 t组 0.099 8.973 0.639 3.653 P组 0.921 0.000 0.524 0.000 YKL-40/(ng/ml)组别

表5 两组患者及新生儿并发症比较(n =70)
3 讨论
随着人类生活水平的改善,GDM发病率逐年升高。由于GDM易导致早产、流产、妊娠期高血压、巨大儿、胎儿畸形、胎儿生长受限等不良妊娠结局,对母婴危害较大[11],因此,GDM的治疗尤为重要,而且,对于饮食运动治疗无效的患者,应给予药物治疗。临床研究已经证实[12],早期胰岛素治疗或口服降糖药能够有效控制患者血糖,降低产妇和新生儿的并发症发生率。
胰岛素联合二甲双胍是GDM治疗的有效方法,疗效优于单独的胰岛素注射或口服降糖药治疗[13],且安全性良好。MCGRATH等[5]研究认为二甲双胍联合胰岛素注射能够改善妊娠结局,降低产妇和新生儿并发症;IJӒS等[6]应用二甲双胍联合胰岛素注射治疗GDM患者,新生儿的神经系统发育得到改善。然而,胰岛素皮下注射的注射剂量、器械和注射方法等均会影响血糖的控制,患者低血糖的发生率较高[14]。而且,对于妊娠期妇女来说,为更好地保证产妇和胎儿的生命健康,应选择更为安全、有效的注射方式。胰岛素泵由小注射器、泵和输液管构成,通过模拟人体胰腺功能将胰岛素注射至皮下,能够确保患者血糖整天处于平稳状态。研究已经证实,胰岛素泵具有微量、持续的特征[15],治疗效果优于胰岛素皮下注射,新生儿并发症发生率低。本研究采用二甲双胍联合胰岛素泵皮下注射治疗GDM患者,各项指标改善,表明二甲双胍联合胰岛素泵皮下注射疗效优于二甲双胍联合胰岛素皮下注射治疗,这与胰岛素泵皮下注射这一给药方式息息相关。胰岛素泵皮下治疗能够持续皮下注射给药,起效快,并能模拟人体胰腺功能,患者血糖水平更为平稳,波动少,夜间低血糖发生率降低,从而缩短血糖达标时间,降低胰岛素用量,提高治疗效果。另外,两组患者母婴结局异常发生率无差异,表明二甲双胍联合胰岛素泵皮下注射并不会增加母婴结局异常发生率,安全且有效。
胰岛素抵抗是GDM发病的主要原因之一,胰岛素抵抗通过减少葡萄糖的摄取和氧化,促进脂肪和蛋白质的分解,使得空腹血糖升高,因此,GDM患者的治疗应改善胰岛素抵抗。研究已经证实[16],血清炎症因子是导致胰岛素抵抗的重要因素。YKL-40是一种新的炎症标志物,在单核细胞分化/激活的巨噬细胞中起关键作用,是导致胰岛素抵抗的炎症标志物。目前,文献[17]已经报道了GDM患者血清YKL-40水平高于健康妊娠期妇女。本研究观察发现,两组患者治疗后YKL-40下降,观察组治疗后YKL-40水平低于对照组,提示胰岛素联合二甲双胍治疗能够有效降低YKL-40水平,且胰岛素泵皮下注射的改善作用更为明显。分析认为,空腹胰岛素和胰岛素抵抗指数是YKL-40的独立影响因素[18],而胰岛素治疗提高了空腹胰岛素水平,口服二甲双胍增加了周围组织对胰岛素的敏感性,改善了胰岛素抵抗,故患者治疗后YKL-40水平降低。而观察组降低程度更高,与胰岛素泵皮下注射的血糖平稳,疗效确切有关。
胰岛β细胞功能障碍是GDM发病的重要因素,Irisin是一种新的运动诱导肌肉因子,能够改善饮食诱导的胰岛素抵抗、葡萄糖耐量及胰岛β细胞功能障碍,是GDM的治疗的促进因子。Irisin是FNDC5在蛋白水解酶水解下产生的多肽片段,通过诱导白色脂肪棕色化、刺激解偶联蛋白1表达来增加氧耗和能耗,从而减轻体重,促进糖尿病病情改善[19]。本研究中,两组患者治疗后Irisin水平升高,且观察组治疗后Irisin水平高于对照组,表明胰岛素联合二甲双胍能够有效提高GDM患者血清Irisin水平,从而改善胰岛素抵抗和胰岛β细胞功能障碍。据报道[20],2型糖尿病患者血清Irisin水平与2 h FPG独立相关,提示2 h FPG水平改善的同时,Irisin水平改善,而本研究中两组患者2 h FPG水平改善,且观察组治疗后2 h FPG水平更低,故Irisin水平更高,疗效更好。
总之,二甲双胍联合胰岛素泵皮下注射治疗妊娠期糖尿病患者疗效确切,能够有效控制血糖、改善血糖相关指标,产妇和新生儿并发症发生率低,并能降低血清YKL-40水平,升高Irisin水平,对于妊娠期糖尿病患者治疗具有重要价值。但是,由于YKL-40、Irisin是新型GDM相关性因子,故二甲双胍联合胰岛素泵皮下注射治疗改善二者水平的分子学机制以及二者之间的相关性均有待于进一步研究。

