茶多酚对重铬酸钾染毒小鼠肝脏损伤的影响*
彭敏,刘燕群,2,3△,唐元娟,程露,杨晔,甘维康,李杜(.江汉大学医学院,湖北武汉430056;2.江汉大学光电化学材料与器件省部共建教育部重点实验室,湖北武汉430056;3.江汉大学化环学院,湖北武汉430056)
工业上铬的用途比较广泛[1],在某些职业环境中,铬主要是以六价的形式存在于冶金等生产工业中。有相关实验表明,在生产过程中接触过多的六价铬(Cr6+)会使人急性中毒而引起肝脏组织的损伤,严重时可诱发肺癌甚至是死亡[2]。日常生活中人们多有喝茶的习惯,茶多酚(TP)一般安全、无污染,且有强抗氧化作用,正逐渐受到人们的认可。TP的芳香环可通过结合氧自由基中的羟基来清除机体内的自由基,表现出强抗氧化能力[3]。肝脏是人体内新陈代谢的枢纽和重要的解毒器官。肝脏如果受到影响,将会影响到人体健康。有关重铬酸钾铬损害的机制研究很多,但对其损害的修复研究报道较少[4-5],沈海涛等[6]进行了TP干预毒物研究,而利用生活中常见的茶叶提取含有多酚类化合物TP干预重铬酸钾(PD)致小鼠肝脏损伤的相关研究鲜见报道。鉴于此,本实验拟采用PD使致小鼠中毒后用TP进行干预,观察分析小鼠肝活性氧化酶指标的变化和苏木精-伊红(HE)切片情况,探讨TP对PD染毒小鼠肝脏损伤的影响,为相关研究提供实验数据和分析依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 采用无特定病原体(SPF)昆明小鼠60 只,雌雄各半,体重(23±2)g,批号:42000600023316,购于湖北省实验动物研究中心。小鼠身体状态良好,安置于室温(24±1)℃下,小鼠自由取水,每只小鼠喂食5 g饲料,适应性喂养3 d。之后称取每只小鼠的体重,根据体重差异随机分为5组,每组12只,雌雄各半,使每组小鼠的平均质量为30 g左右。
1.1.2 主要实验仪器与试剂 TP(福州日冕科技开发有限公司),纯度大于 98.0%;PD(K2Cr2O7,山东西亚化学股份有限公司),纯度99.8%。JA2003B电子天平(上海越平科学仪器有限公司),PH100-3A41L-EP生物显微镜(江西凤凰光学集团有限公司)等。
1.2 方法
1.2.1 急性毒性实验 (1)预实验:随机挑选A、B 2组小鼠进行预实验。①A组:根据相关研究,PD染毒昆明小鼠后,肾脏重量和肾脏系数均有显著升高,且浓度为21.375 mg/kg的组别升高最为明显[7]。本研究采用1/8的PD半数致死量(LD50)为标准设置浓度梯度,1/4 LD50为上限,0为下限,设置8个浓度梯度,分别为1/4 LD50、1/8 LD50、1/12 LD50、1/16 LD50、1/20 LD50、1/24 LD50、1/32 LD50、0(生理盐水)的PD溶液,分别给8只昆明小鼠灌胃。每6小时1次,每只每次灌胃0.3 mL,每天连续灌胃3次,连续灌胃3 d。不断持续观察小鼠的生活状态和活动能力,3 d后解剖观察小鼠肝脏变化情况,选出1个能使小鼠恰好表现中毒情况又不致死的适宜浓度作为正式实验PD的灌胃浓度。解剖前,小鼠生活状态不佳,精神萎靡,较安静。解剖后,因为1/4 LD50组小鼠肝脏对比0(生理盐水)组及其他组小鼠,肝脏肿大最明显,颜色暗沉且色泽不均,仔细用肉眼可观察到各叶肝脏边缘及中部均有弥漫的小结节,表现出明显病理特征。故以1/4 LD50为最适PD灌胃浓度进行正式实验。②B组:经查阅相关文献[6],设置5个浓度梯度,分别以浓度为 200、300、400、500、600 mg/kg的 TP 溶液给 10只昆明小鼠灌胃,每个浓度组2只,灌完1/4 LD50PD溶液后隔4 h灌胃TP溶液即为一轮灌胃,每次灌胃量为0.3 mL,每天连续灌胃2轮,每天给另2只小鼠灌胃2次1/4 LD50PD溶液,作为对照组,连续灌胃3 d。解剖前,各组小鼠的活动能力和生活状态没有明显区别。解剖后,对比各组小鼠肝脏病理特征,200、400、600 mg/kg组小鼠的肝脏色泽相对鲜红,小结节较少,病理变化少。故选取200、400、600 mg/kg作为正式实验TP灌胃浓度。(2)正式实验:将60只昆明小鼠分为5组,每组12只,雌雄各半,在24℃室温下分笼,早上08:00至晚上18:00灯光照明饲养。假设每只小鼠重量为30 g,每天灌胃量为0.3 mL。根据计算结果,配制浓度为4.275 mg/mL的1瓶PD溶液和浓度为200、400、600 mg/kg的3瓶TP溶液于4℃冰箱内避光储存备用。对照组灌胃生理盐水,PD染毒组灌胃42.75 mg/kg PD溶液;在灌胃PD 6 h后,TP 组分别按 200、400、600 mg/kg浓度灌胃TP溶液(即PD+L-TP组、PD+M-TP组、PD+H-TP组)。各组灌胃时间均为2周,每天1次;每只小鼠每次灌胃体积均为0.3 mL。观察每天小鼠的生活状态,记录小鼠的体重。准备解剖之前,各组小鼠自由取水,最后1次灌胃后禁食24 h。解剖小鼠时,颈椎脱位法处死小鼠,采血、取肝脏称重并制作肝脏的HE染色切片并计算其脏器系数;离心后的血清用全自动生化分析仪检测肝组织谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)水平。
1.2.2 肝组织HE染色切片的制作 处死并解剖全部小鼠并取其肝脏,称量后,投入4%甲醛溶液中固定,保持细胞形态。乙醇脱水后,再将组织块置于二甲苯中。石蜡包埋后切片,切成的薄片固定于载玻片上,放入45℃恒温箱内烘干。二甲苯可脱去切片中的石蜡,再经过高浓度到低浓度乙醇洗脱后,用蒸馏水洗。HE染色后,制成肝的HE染色切片[8-10]。
1.3 统计学处理 应用SPSS19.0统计软件处理实验各组相关数据,计量资料采用表示,并用单因素方差分析法进行组间比较,P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体重及肝脏脏器系数比较 PD染毒组体重和脏器系数均低于对照组,差异均有统计学意义(P<0.05);PD+L-TP、PD+H-TP组与PD染毒组比较,小鼠体重有一定程度的增加,PD+L-TP、PD+m-TP组小鼠肝脏脏器系数均低于PD染毒组,差异均有统计学意义(P<0.05)。见表1。
表1 各组小鼠体重及肝脏脏器系数比较(±s)
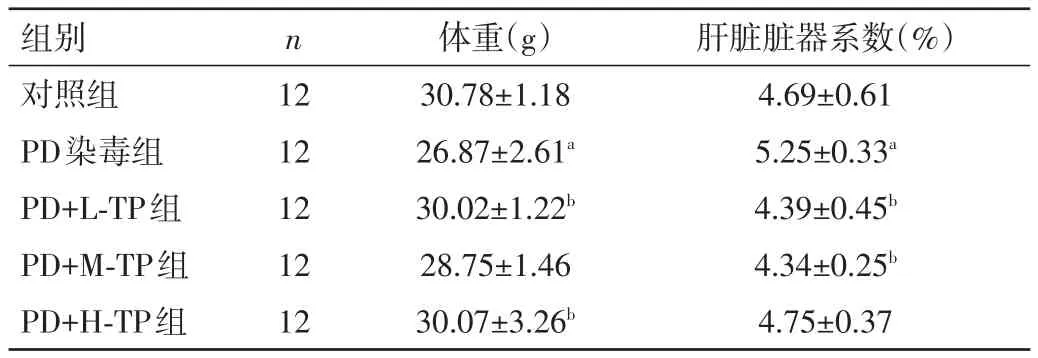
表1 各组小鼠体重及肝脏脏器系数比较(±s)
注:与对照组同指标比较,aP<0.05;与PD染毒组同指标比较,bP<0.05
组别对照组PD染毒组PD+L-TP组PD+M-TP组PD+H-TP组n 12 12 12 12 12体重(g)30.78±1.18 26.87±2.61a 30.02±1.22b 28.75±1.46 30.07±3.26b肝脏脏器系数(%)4.69±0.61 5.25±0.33a 4.39±0.45b 4.34±0.25b 4.75±0.37
2.2 各组小鼠肝功能指标比较 PD染毒组小鼠血清ALT、AST、GGT水平均高于对照组,差异均有统计学意义(P<0.05);经不同剂量 TP 干预后,PD+L-TP、PD+m-TP、PD+H-TP组的血清 ALT、AST、GGT 水平均分别低于PD染毒组,差异均有统计学意义(P<0.05)。见表2。
表2 各组小鼠肝功能指标比较(±s)

表2 各组小鼠肝功能指标比较(±s)
注:与对照组同指标比较,aP<0.05;与PD染毒组同指标比较,bP<0.05
GGT(U/L)2.34±0.37 3.91±0.09a 2.90±0.68b 2.21±0.38b 2.85±0.78b组别对照组PD染毒组PD+L-TP组PD+M-TP组PD+H-TP组n 12 12 12 12 12 ALT(U/L)49.48±1.46 57.96±9.33a 42.60±3.68b 44.0±1.71b 41.43±0.63b AST(U/L)131.73±22.57 159.85±4.12a 134.15±8.21b 133.66±5.57b 134.58±13.51b
2.3 显微镜观察 将各组小鼠肝脏HE染色切片分别置于低倍镜和40倍光学显微镜下观察,结果显示,对照组(生理盐水)肝小叶之间界限较清楚,细胞在肝小叶中部的中央静脉周围呈放射状排列,肝细胞间连接紧密,可见肝血窦和门管区;小鼠肝细胞呈多边形,细胞体积较大,细胞核大而圆,核仁明显,染色质丰富(图1)。PD染毒组肝小叶界限不清楚,肝细胞水肿,有部分细胞坏死,肝细胞界限不清,有双核,核深染,有些中央静脉轮廓不清楚,大多数充血(图 2)。PD+L-TP、PD+m-TP、PD+H-TP组肝小叶界限较清楚,细胞轻度水肿,较少坏死,大多细胞界限清楚,中央静脉大多轮廓清楚,充血少(图3~5)。

图1 对照组(HE染色,40×)

图2 PD染毒组(HE染色,40×)

图4 PD+M-TP组(HE染色,40×)

图5 PD+H-TP组(HE染色,40×)
3 讨 论
本实验采用TP作用PD染毒小鼠肝脏,结果证实,在TP的干预下,TP对PD染毒肝脏所致的损伤有一定程度的保护作用。
实验动物的脏器系数可反映毒物对脏器的综合毒性损伤程度,其增大表明脏器出现了水肿、增生和充血等病理变化,若下降则说明器官表现出萎缩和退行性病变等变化[11]。动物的体重也是研究毒理学中非特异性观察指标之一。体重和脏器系数可以综合反映机体的中毒效应。本实验图2结果显示,与对照组比较,PD染毒小鼠肝脏的脏器系数增高,说明PD溶液可引起肝脏水肿、坏死等病理变化,HE染色切片也显示肝细胞水肿、出血,部分细胞坏死;PD染毒组小鼠体重下降,与李银等[12]的实验结果一致。主要是由于PD在体内蓄积引起的毒性反应,致小鼠消化不良,食欲不振,从而进食量减少,这也是小鼠体重下降的直接原因。本研究图3~5表明,经不同剂量TP干预后,小鼠肝脏脏器系数均呈不同程度降低,体重增加,表明TP干预后可减轻PD蓄积毒性对机体的影响,不断改善和修复PD对肝脏的损伤作用,并使其生理功能逐渐恢复而增加体重,HE染色切片显示肝细胞界限较为明显,出血和坏死情况较少。
分析肝脏功能最常用的方法是肝酶活性的检测,这通常也是研究肝脏损害较常规和便捷的方法之一。相关研究表明,严重损伤的肝细胞一般会出现ALT、AST和GGT水平升高,三者的变化能够帮助判断肝脏是否损伤及其损伤程度和性质[13]。本实验结果显示,PD染毒组ALT、AST、GGT 3项指标水平均升高,表明PD可增强脂质过氧化而损伤肝脏;TP干预后,ALT、AST、GGT水平均低于PD染毒组,说明TP对PD引起的肝酶升高和肝脏组织形态破坏均有不同程度的保护作用,可能与其表现出的强大抗氧化能力有关。但其具体保护机制及其所需的最佳浓度尚需要进一步深入研究探讨。

