科华ELISA与雅培i2000sr检测系统对4种感染性疾病8项血清标志物检测的性能评价*
汪靖园,王林川,肖 尧,阮竞雄,田旭东,闫 芳
(1.西安交通大学第一附属医院检验科,西安 710061;2.西安市第三医院输血科,西安 710018)
目前,化学和电化学发光及ELISA技术广泛应用于乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、梅毒特异性抗体(TP)、艾滋病病毒(HIV)血清标志物的检测。不同检测方法或仪器之间结果是否具有可比性?检测性能是否与厂家声明一致?能否满足科室质量目标要求等问题需要对检测系统进行性能评价来确认。为此,我们参照中国合格评定国家认可委员会医学实验室质量和能力认可准则在临床免疫学定性检验领域的应用说明[1],采用 CLSI-EP方案[2~4]对这两种检测系统的性能进行了评估。
1 材料与方法
1.1 实验样本 来源于西安交通大学第一附属医院患者样本及卫计委2016,2017年感染性疾病血清标志物A,C能力验证(proficiency testing,PT)样本。
1.2 试剂和仪器 标准物质:来源于北京康彻思坦,包括HBsAg(4IU/ml),HBsAb(30mIU/ml),HBeAg(4NCU/ml),HBeAb(8NCU/ml),HBcAb(4NCU/ml),Anti-HCV(8NCU/ml),Anti-HIV(8NCU/ml),Anti-TP(特异)(400mIU/ml)。其中,IU为国际单位(international unit);NCU即国家临床单位(national clinical unit),由卫计委临检中心制定。检测系统:科华ELISA(上海科华),i2000sr化学发光流水线(美国雅培,仪器序列号分别为52691,52693,52695,50143,54290)。
1.3 方法 准确度验证:统计卫计委2016,2017年度感染性疾病血清标志物A(乙肝标志物,丙肝抗体),C(梅毒特异性抗体,HIV抗体)共6次,30个样本PT回报结果。符合率≥80%,验证通过。
检出限确认:HBsAg,HBsAb厂家声明检出下限,科华不高于0.1 IU/ml和10 mIU/ml,i2000sr不高于0.05 IU/ml和10 mIU/ml。使用生理盐水稀释标准物质制备检测样本,对其进行检测后获得线性回归方程,见表1。然后制备临界值附近浓度样本,对其进行连续20次测定。以定量项目偏倚≤允许总误差(total allowable error,TEa),定性项目阳性率≥95%的最低浓度确认为检出限。
一致性验证(方法学比对):采用ELISA,对i2000sr七种标志物(除HIV)结果分别为阴性和阳性各10例患者样本进行检测,其中弱阳性至少包含2例。弱阳性样本包括:HBsAg(0.14,0.97 IU/ml),HBsAb(12.87,12.95 mIU/ml),HBeAg(1.09,1.607 NCU/ml),HBeAb(0.91,0.89,0.88,0.86 NCU/ml),HBcAb(1.6,1.74,1.77,1.8,1.87 NCU/ml),Anti-HCV(1.45,2.44 mIU/ml),Anti-TP(1.34,1.37,1.65 NCU/ml)。
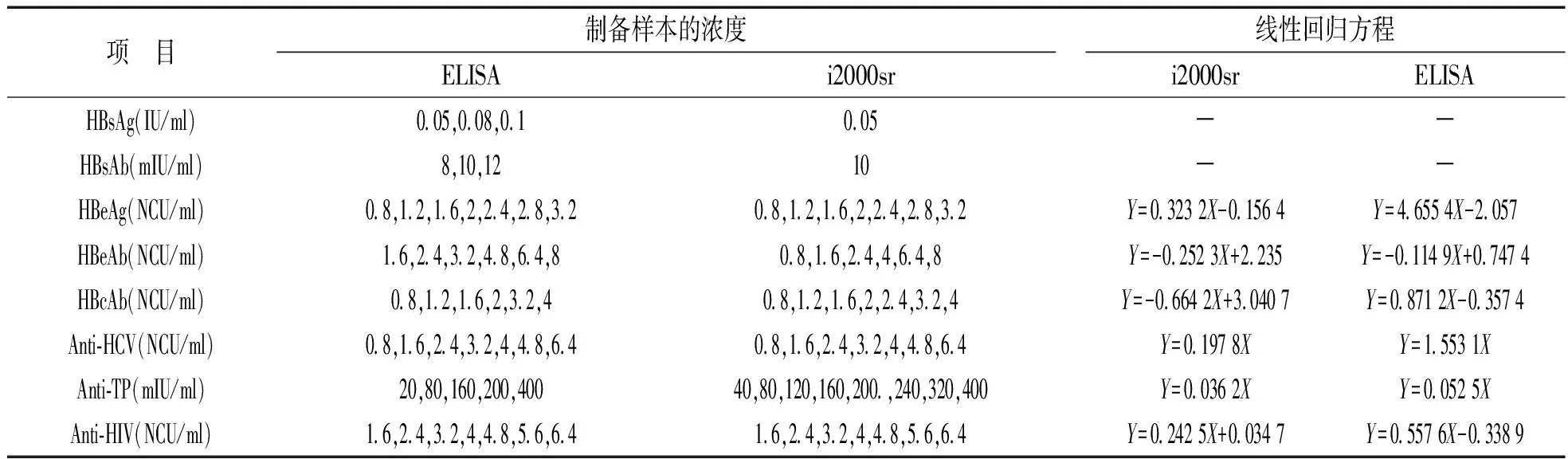
表1 检出限确认样本的制备
一致性验证(仪器间比对):定量项目(HBsAg,HBsAb)仪器间比对采用三台i2000sr对分布于低、中、高水平各20份患者样本进行测定,以中位数作为靶值。观察误差(observed error)≤1/2TEa,浓度误差指数(error index)绝对值≤1,验证通过。定性检测项目(除HIV)仪器间比对评价方案参照方法学比对进行。计算公式:观察误差(%)=(测定结果-靶值)×100/靶值,浓度误差指数=(测定结果-靶值)/(靶值×TEa)。
精密度验证:参照CLSI-EP15-A2[7],选择两个浓度水平患者样本(HIV精密度评价选择雅培低、中水平室内质控品),每个水平每日测定一批(重复测定3次),连续5天,计算批内不精密度和室内不精密度。CV同时满足:(i)批内不精密度≤1/4TEa;(ii)室内不精密度≤1/2TEa,验证通过。计算公式如下:
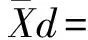
1.4 统计学分析 精密度,定量项目多台仪器间比对,线性范围验证使用EP Evaluator 11软件(Data Innovaions LLC,Suite South Burlington,Vermont,USA)进行数据处理,实验室允许总误差(TEa)设定为30%。一致性验证采用Kappa检验,系数≥0.75验证通过。线性范围验证中,采用t分布(t-statistics)判断是否存在非线性系数。通过得到的t值与t界值比较,t值>t界值,则该组数据存在非线性系数。在本研究中,其自由度为8(置信度设置为0.95),对应的t界值为2.3,即t>2.3时表明存在非线性系数。
2 结果
2.1 准确度验证 对卫计委2016,2017年度感染性疾病血清标志物A,C共6次30个PT样本,使用雅培i2000sr和科华ELISA两种系统各自检测一次。根据PT回报结果,两种检测系统结果均与预期一致,准确度验证通过。
2.2 检出限确认 HBsAg浓度为0.05,0.08,0.1 IU/ml及HBsAb浓度为10 mIU/ml样本的20次检测,科华ELISA阳性率分别为5%,95%,100%,100%。表明科华ELISA对HBsAg,HBsAb检出下限分别为0.08 IU/ml,10 mIU/ml,与厂家声明一致。i2000sr对浓度分别为0.05 IU/ml,10 mIU/ml的HBsAg和HBsAb样本20次检测,范围分别为0.051 9~0.063 9 IU/ml,10.24~11.18 mIU/ml,与理论浓度偏倚均小于TEa,检出限与厂家声明一致。利用线性回归方程制备接近理论临界值浓度的样本,20次测定获得95%阳性率的最低浓度,HBeAg,HBeAb,HBcAb,Anti-HCV,Anti-TP和Anti-HIV科华分别为0.8 NCU/ml,4.4 NCU/ml,3.2 NCU/ml,0.8 NCU/ml,20 mIU/ml和0.5 NCU/ml;i2000sr分别为0.225 NCU/ml,1 NCU/ml,1.8 NCU/ml,0.45 NCU/ml,20 mIU/ml和2.88 NCU/ml,见表2。
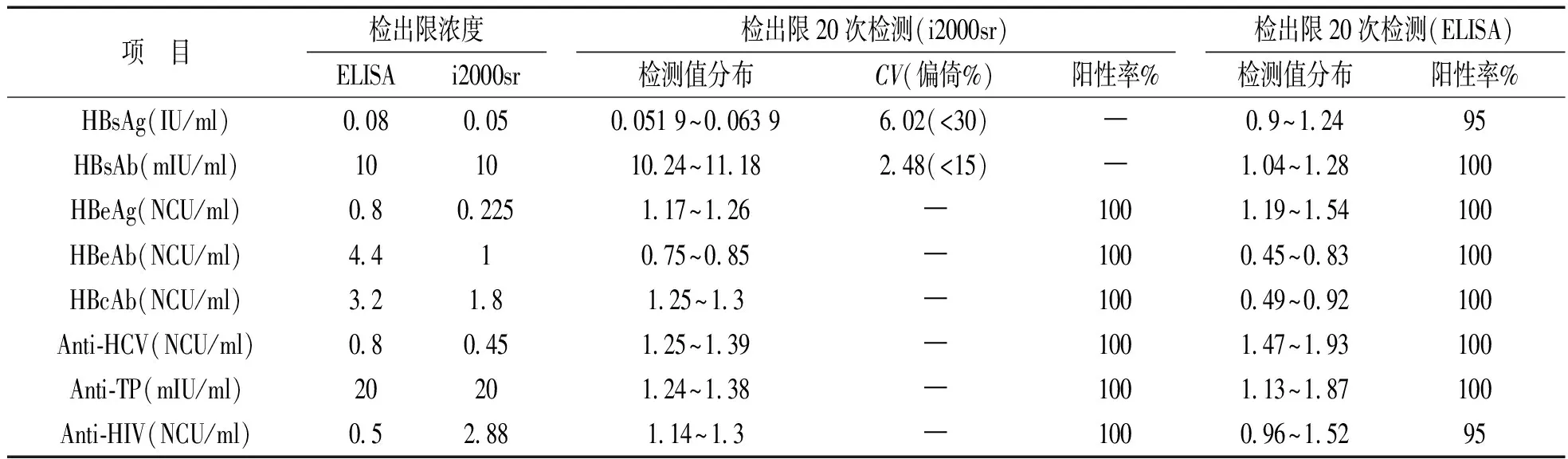
表2 两种检测系统八种血清标志物检出限确认结果
2.3 一致性验证 对七种血清标志物(除Anti-HIV)i2000sr结果已知的患者样本,采用ELISA检测进行方法学比对:10例阴性样本,除1例HBsAb结果为阳性(i2000sr:0.44 mIU/ml;科华:1.28 mIU/ml),其余均为阴性。10例阳性样本,科华阳性检出数为8~10例。两种方法一致性检验Kappa系数分布于0.8~0.9,方法学比对通过。仪器间比对:定性项目(HBeAg,HBeAb,HBcAb,Anti-HCV,Anti-TP),两台仪器(序列号:52691,52693)检测结果一致,Kappa系数均为1。定量项目(HBsAg,HBsAb),3台仪器观察误差均小于1/2TEa。HBsAg浓度误差指数,52695,50143,54290仪器分布范围分别为-0.39~0.56,-0.38~0.42,-0.28~0.28。HBsAb浓度误差指数分别为-0.27~0.21,-0.39~0.30,-0.40~0.47,i2000sr仪器间比对通过,见图1。
2.4 精密度验证 i2000sr精密度验证结果见表3。八项标志物,水平1批内不精密度CV分布范围为2.05%~4.57%,室内不精密度CV范围为2.54%~10.03%;水平2批内不精密度CV分布范围为1.10%~7.01%,室内不精密度CV分布范围为1.90%~8.61%。批内CV小于1/4TEa(7.5%),室内CV小于1/2TEa(15%),精密度验证通过。
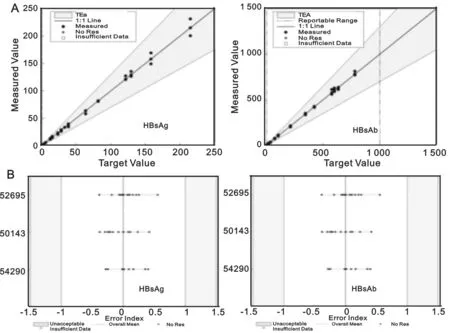
(A)检测结果散点图;(B)序列号分别为52695,50143,54290仪器低、中、高浓度20例样本检测,浓度误差指数(Error Index)分布。

表3 雅培i2000sr八种血清标志物精密度验证结果
2.5 线性范围验证 使用生理盐水对接近线性范围上限的患者样本进行稀释,制备线性范围验证的样本。短时间内对其按照从低到高,然后从高到低二次检测,目视均值无离群点。多项式回归分析见表4,HBsAg三项回归方程不存在非线性系数b3(t值1.8<2.3),而二项回归方程存在非线性系数b2(t值3.7>2.3),因此HBsAg最适模型为二项回归模型。与此类似,HBsAb二项回归方程非线性系数b2,三项回归方程非线性系数b3,对应的t值均>2.3,故两种回归方程均存在非线性系数。但三项回归方程标准误最小,因此三项回归模型为HBsAb最适模型。各个点最适模型与线性模型偏倚均小于1/2TEa,见图2。表明i2000srHBsAg,HBsAb线性范围分别为0.73~245 IU/ml,4.21~960.89 mIU/ml,与雅培说明书一致,见表5。
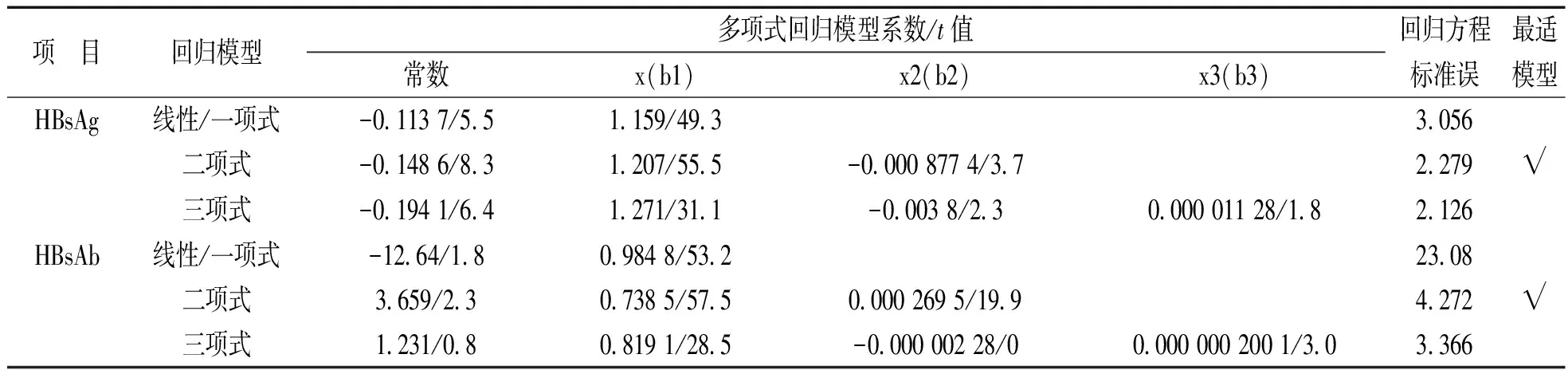
表4 雅培i2000sr HBsAg,HBsAb线性范围验证多项式回归分析
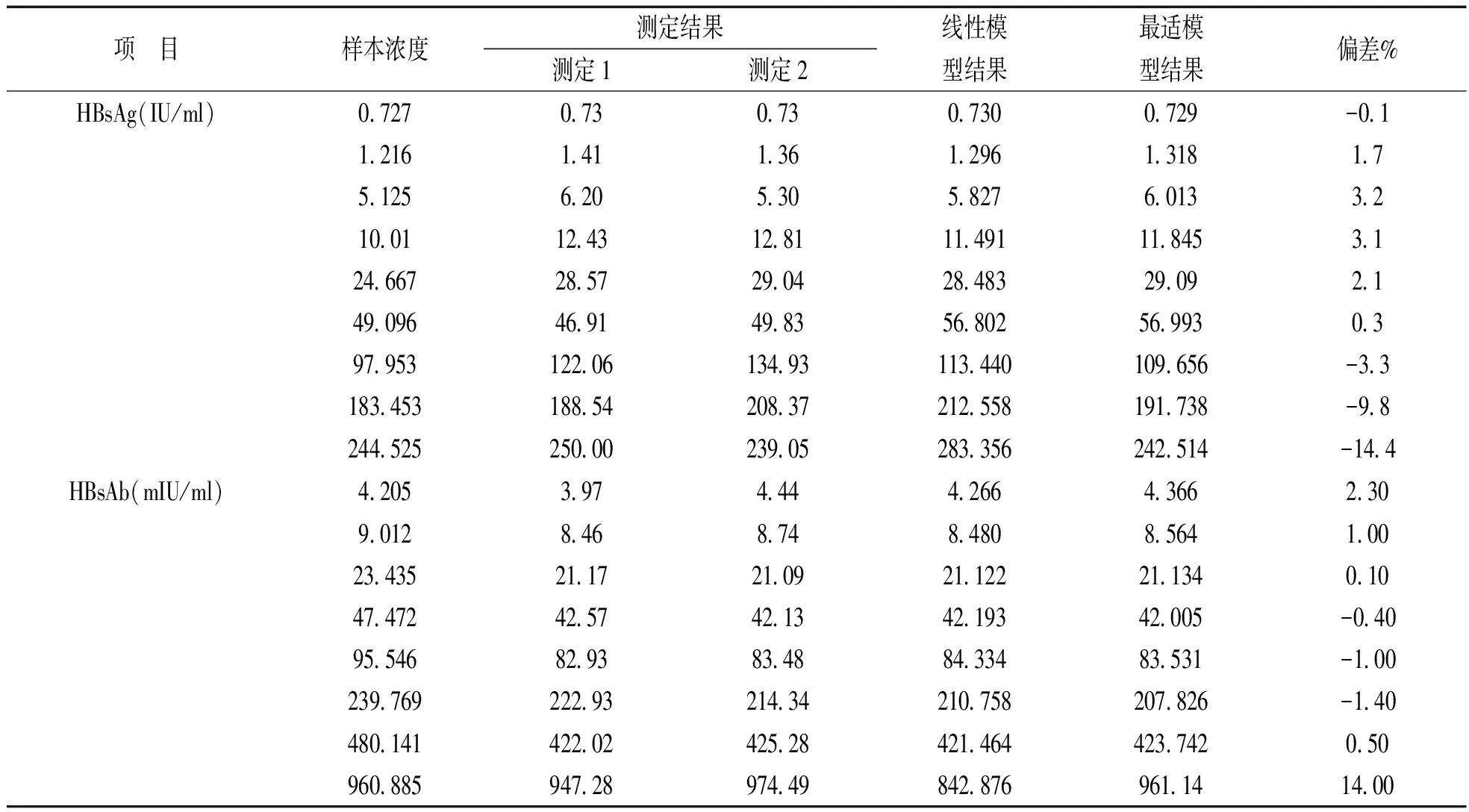
表5 雅培i2000sr HBsAg,HBsAb线性范围验证不同模型拟合结果
3 讨论
提高实验室的质量管理水平和检测技术能力,为临床和患者提供可靠的检测结果,已成为医学实验室生存发展和学科建设的关键。《医疗机构临床实验室管理办法》和《全国临床操作规程》规定,实验室在开展新项目之前,检测系统更换或者发生重大改变时,应进行性能验证[5]。CNAS-CL39明确指出,免疫学定性项目性能验证内容应参考试剂盒说明书的性能参数进行,但至少应包括检出限、符合率,如为定量方法应验证精密度[1]。国内外已有较多文献对以罗氏或雅培为代表的感染性疾病血清标志物发光检测系统的分析性能进行了评价[6~11],但其局限性在于:①评价主要基于HBV[10]或HBsAg[6~9]等单一指标性能;②性能验证涉及的参数不够全面,多限于精密度[9,10],不同仪器对患者检出能力比较[7],不同仪器间相关性[6~8];③仅评价发光与ELISA的一致性[11]。本文对同时允许于我室的雅培i2000sr化学发光和科华ELISA两种检测系统4种感染性疾病8项血清标志物的性能进行了全面的验证和比较。
定性试验由于CV较大,对其精密度常不做评价。CLSI EP12-A2通过对临界值±20%以外浓度样本10天(每日两次)或20天(每日一次)检测,能否获得≥95%阳性率、阴性率来评价其再现性[4]。对于定量检测系统,EP15-A2通过对两种以上水平样本连续5天(每日3次)检测来确认其精密度[2]。本次对八种标志物两个水平样本检测中,i2000sr批内不精密度为1.10%~7.01%(<1/4TEa),室内不精密度为1.90%~10.03%(<1/2TEa),表明该系统精密度满足科室要求,也与国内其他研究结果接近[9,10]。检验结果互认是近年来人们比较关注的话题,通过能力验证/室间质评以及实验室定期外部内部比对是实现检验结果互认前提。按照CNAS-RL02《能力验证规则》的要求,实验室应参加相应的能力验证/室间质评。对没有开展能力验证/室间质评的检验项目,实验室应通过与其他实验室比对的方式判断检验结果的可接受性[12]。实验室同一项目使用两套及以上检测系统时,应至少每年进行1次内部比对评价结果一致性[1]。在本次验证中,科华ELISA与i2000sr化学发光对卫计委HBV,HCV,TP和HIV 8项血清标志物30份PT样本准确度均为100%。方法学和仪器间比对,定性项目Kappa值为0.8~1,定量项目观察误差,浓度误差指数绝对值分别小于1/2TEa和1。表明两种检测系统准确度、一致性均能满足实验室要求。卢婷等[11]在类似检测中,i2000sr与ELISA在乙肝标志物总体一致性(符合率)达99%~100%。检出限的确认是评价检测方法对目标物检出能力的重要环节。在本次评价中,两种检测系统HBsAg,HBsAb,Anti-TP检出限差异不大,但i2000sr对HBeAg,HBeAb,HBcAb和Anti-HCV检出能力明显优于科华,而科华对Anti-HIV检出能力优于i2000sr。线性范围验证,HBsAg,HBsAb分别为0.73~245 IU/ml,4.21~960.89 mIU/ml,与雅培声明(HBsAg:0~250 IU/ml;HBsAb:0~1 000 mIU/ml)接近。
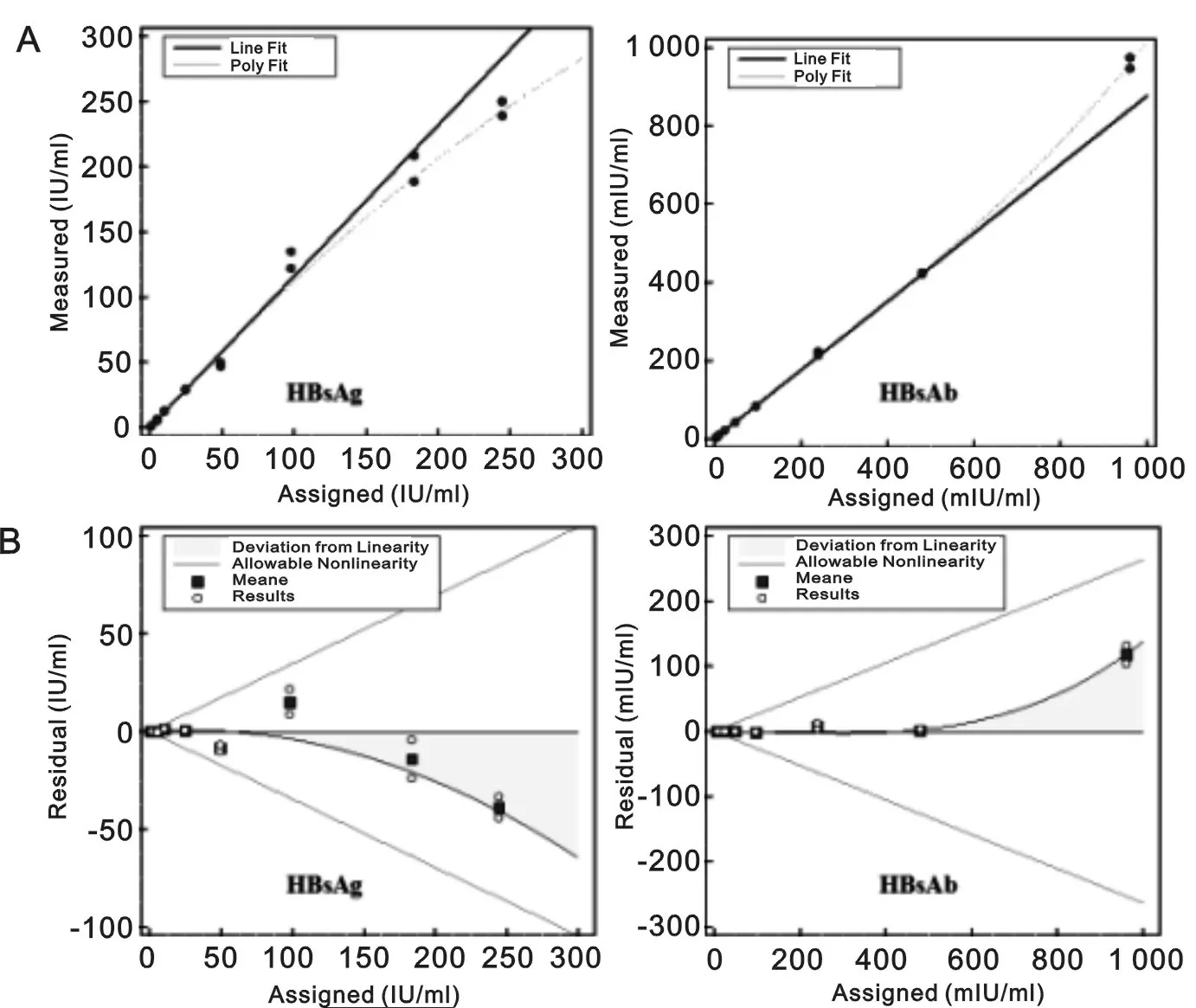
(A)多项式回归分析,线性拟合曲线与最适模型拟合曲线;(B)系列分析样本检测结果残差分布图。
综上,在术前八项检测中,雅培i2000sr化学发光和科华ELISA准确度、检出限、精密度和线性范围等性能指标与厂家声明一致并能满足实验室要求,同时两种系统检测结果具有很高的一致性。在感染疾病四种关键血清标志物(HBsAg,Anti-HCV,Anti-TP,Anti-HIV)的常规筛查中,两种系统对HBsAg,Anti-TP检出能力相近,i2000sr仅在Anti-HCV检出能力上明显优于科华,但科华对Anti-HIV检出能力优于i2000sr。

