类风湿性关节炎患者血清RF-IgM和RF-IgG检测的临床诊断价值*
罗改莹,王 瑞,周 辉,来艳君
(1.西安市第五医院a.检验科;b.内科五病区,西安 710082;2.西安市第九医院检验科,西安 710054)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节病变为主的慢性、全身性、自身免疫性疾病[1,2],其主要病理变化是关节滑囊组织增生,炎症细胞浸润,及软骨关节进行性及不可逆伤害[3]。病因复杂、症状多样、致残率高,是全世界公认的疑难病。如未早期诊断治疗,将会导致病情加重致残[4,5]。在全世界RA的发病率约为0.5%~1.0%[6],我国RA的发病率约为0.4%,并有逐年增加的趋势。临床上主要通过类风湿因子(rheumatoid factor,RF)、红细胞沉降率(erythrocyte sedimentation rate,ESR)及C-反应蛋白(C-reactive protein,CRP)等实验室指标检查进行辅助诊断,目前仍缺乏针对RA患者预后做出有效判断的检测指标。有研究表明,RF-IgM,RF-IgG对RA的诊断价值较高。基于此,本研究选取RF-IgM,RF-IgG阳性患者52例,阴性患者46例和50例健康体检者,探讨IgM,IgG阳性及阴性RA患者存在治疗的反应差异,为RF-IgM,RF-IgG诊断RA患者提供临床参考价值,现报道如下:
1 材料与方法
1.1 研究对象 选择2016年7月~2017年6月在西安市第五医院就诊的RA患者(诊断符合1987年美国风湿病协会(ARA)修订的RA诊断标准[7],且排除其他严重的器质性疾病、感染性疾病、肿瘤、妊娠及哺乳期妇女、严重并发症及临床资料不全者),将其中RF-IgM,RF-IgG阳性患者列为观察组(n=52),RF-IgM,RF-IgG阴性患者列为对照组(n=46),两组平均年龄51.32±3.58岁。健康体检者列为健康组(n=50),年龄23~65岁,平均年龄39.62±1.27岁,均来自门诊体检的健康人员,且排除类风湿性关节炎、高血脂、糖尿病等。各组间年龄、性别无显著性差异。
1.2 试剂及仪器 RF-IgA,RF-IgM使用ELASA方法检测,选用雷杜 RT-6100酶标仪,试剂盒由德国AESKU公司提供;RF使用免疫散射比浊法检测,选用BECKMAN COULTER Immage800特种蛋白分析仪及原厂配套试剂;ESR使用红外线阻挡法检测,使用ESR-30全自动动态血沉仪;FDP,DD使用免疫学(乳胶颗粒法)检测,使用ACL TOP 700全自动凝血仪和BECKMAN COULTER 原厂配套试剂。
1.3 检测方法 RF-IgA和RF-IgM检测:采集患者空腹静脉血,CENCE湘仪离心机3 500 r/min离心10 min后检测。ESR检测:采集患者静脉抗凝血(1.6 ml静脉血加入109 mmol/L枸橼酸钠0.4 ml),采样后轻轻颠倒混匀6~8次检测。FDP,DD检测:采集患者空腹静脉血(1.8 ml静脉血加入109 mmol/L枸橼酸钠0.2 ml),采样后轻轻颠倒混匀6~8次,CENCE湘仪离心机3 000 r/min离心15 min后检测。
1.4 观察指标 ①检测各组入院时及观察组和对照组治疗6个月后的FDP,DD,ESR和RF水平并进行比较;②采用视觉模拟疼痛(VAS)评分评价两组患者的疼痛程度,选取一条标记0~10 cm长标尺,分别标记0~10分,0分表示无疼痛症状,10分表示疼痛剧烈;③记录两组患者的晨僵时间,晨僵指晨起病变的关节在静止不动后出现较长时间僵硬;④记录两组患者的关节压痛数,双上肢近端指间关节、掌指关节、腕关节,肘关节、肩关节、膝关节、踝关节中有压痛关节的数目[4]。
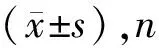
2 结果
2.1 入院时各组间FDP,DD,ESR和RF指标的比较 见表1。入院时观察组和对照组患者的血浆DD及FDP水平均显著高于健康组,两两比较差异均有统计学意义(P<0.05);观察组、对照组分别与健康组两两比较,ESR和RF指标差异均无统计学意义(P>0.05)。
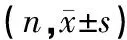
表1 各组间检测结果的比较
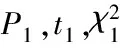
2.2 治疗6个月后观察组与对照组的FDP,DD,ESR及RF水平比较 见表2。98例患者出院后,经服药治疗6个月后观察组患者FDP与DD水平均高于对照组且差异具有统计学意义(均P<0.05);两组患者ESR和RF指标比较差异也均具有统计学意义(均P<0.05)。
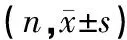
表2 两组间检验结果比较
2.3 治疗6个月后观察组与对照组VAS评分、晨僵时间(min)、关节压痛数指标比较 见表3。治疗6个月后观察组患者的VAS评分、晨僵时间(min)、关节压痛数均高于对照组且差异具有统计学意义(P<0.05)。
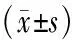
表3 两组间VAS评分、晨僵时间以及关节压痛数指标比较
3 讨论
传统的RF检测,是目前RA诊断指南中实验室指标之一。因检测方法不同,其在RA中的阳性率为50%~90%,在健康人群中有3%~5%的阳性率,在75岁以上老人血清有2%~25%的阳性率,并且在其它疾病中也可出现;ESR,DD,FDP等作为RA活动性指标也经常用于临床辅助诊断,但因为特异度较差,亦不能判断病情发展及预后,在临床应用上有很大的局限性。因此,讨论和探究RF-IgG,RF-IgM的临床价值就具有重要的意义[7]。
DD含量增高见于血栓形成及继发性纤溶;FDP是指在纤溶亢进时产生的纤溶酶的作用下,纤维蛋白或纤维蛋白原被分解后产生的降解产物的总称。相关文献报道[8,9]RA患者中存在DD,FDP增高现象。本研究中结果显示,观察组与对照组患者血清DD,FDP水平明显高于空白组,差异具有统计学意义(P<0.05)。提示血清DD,FDP与RA存在相关性,这与相关研究结果保持一致[10]。
研究显示RF-IgM,RF-IgG阳性的RA患者在治疗后无论是在ESR,RF,FDP,DD检测指标,还是在VAS评分、晨僵时间、关节压痛数评价方面均劣于RF-IgM,RF-IgG阴性的RA患者,提示两组间的治疗差异与RF-IgM,RF-IgG存在明确相关性,因此我们认为RF-IgM,RF-IgG阳性的RA患者其功能预后不良率更高,其机制可能与RF-IgG与RA的血管炎及淀粉样病变相关[11],因此此类患者的治疗需要临床医师更多关注。
综上所述,RF-IgM,RF-IgG有可能成为RA预后判断重要指标之一,对病情转归具有重要的指导意义,为临床医师治疗策略的制定可提供一定的参考。

